Навигация
Структура периодической системы: периоды, группы, подгруппы
2.3 Структура периодической системы: периоды, группы, подгруппы
Итак, мы выяснили, что периодическая система – это графическое выражение периодического закона.
Каждый элемент занимает определённое место (клетку) в периодической системе и имеет свой порядковый (атомный) номер. Например:
|
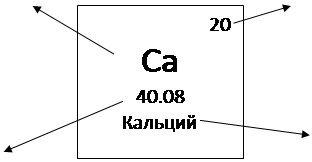
Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами (начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)).
Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым.
Периоды разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды). Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными, нижние ряды – нечётными.
В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы.
В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются.
В чётных рядах больших периодов находятся только металлы.
В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами – это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы.
Исключения:
| Номер группы | Элемент | Высшая валентность |
|
I | Cu Ag Au | II III III |
| VI | O | II |
| VII | H F | I I |
В VIII группе только Ru и Os имеют высшую валентность VIII.
Группы - вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого.
В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами.
2.4 Периодический закон и его обоснование
Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи.
Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями.
Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства. Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону.
Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально.
Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы.
Всего же Менделеевым были предсказаны двенадцать элементов.
С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках. Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ). Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника.
Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра. Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75).
Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы.
Исходя из положения элементов в Периодической системе, химики-теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию гексафторида платины с кислородом, получив гексафтороплати-нат ксенона XePtF^, а за ним и другие соединения газов, которые теперь правильнее называть благородными, а не инертными.
Свою предсказательную функцию периодический закон сохраняет и до наших дней.
Нужно отметить, что предсказания неизвестных членов любого множества могут быть двух видов. Если предсказываются свойства элемента, находящегося внутри известного ряда себе подобных, то такое предсказание носит название интерполяции. Можно предположить, что эти свойства будут подчинены тем же закономерностям, что и свойства соседних элементов. Так были предсказаны свойства недостающих элементов внутри периодической таблицы. Гораздо труднее предвидеть характеристики новых членов множеств, если они находятся за пределами описанной части. Экстраполяция — предсказание значений функции, находящихся за пределами ряда известных закономерностей, — всегда носит менее определенный характер.
Искусственно синтезированный Еиенном Теодором Сиборгом и его сотрудниками элемент № 101 получил название «менделевий». Сам Сиборг об этом сказал так: «Особенно существенно отметить, что элемент 101 назван в честь великого русского химика Д. И. Менделеева американскими учеными, которые всегда считали его пионером в химии».
3. Выводы
Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии ХIX века, стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Так же можно сказать, что периодический закон является началом эпохи современной химии. Изучение строения атомов вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и в группах периодической системы. Знание строения атомов явилось необходимым для понимания причин образования химической связи, а природа химической связи в молекулах определила свойства веществ.
Периодическую систему по праву называют «компасом для исследователя, путеводной нитью в области химии, физики, минералогии, технике, таблицей истории и мироздания».
Академик Ферсман неоднократно подчёркивал, что периодический закон помогает поискам и разведке полезных ископаемых, так как место химического элемента в периодической системе тесно связано с местом того же элемента в самой природе, его реальным местом нахождением.
Возможность предсказания свойств элементов и их соединений по положению элемента в периодической системе широко использовалась и используется в различных областях промышленности техники для решения разнообразных проблем, связанных с созданием новых материалов с определёнными, заранее заданными свойствами. Таким образом: появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека.
«Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев.
4. Список используемой литературы:
1. Глинка Н.Л. «Общая химия», Москва , изд. «Интеграл – пресс», 2002 г.
2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г.
3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г.
4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г.
5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г.
6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г.
7. Авт. Сост. Савина Л.А. Я познаю мир: Детская энциклопедия: Химия, Москва, изд. «АСТ – ЛТД», 1988 г.
8. Химия. 9 класс: Учеб. Для общеобразоват. учеб. заведений. – 3-е изд., стереотип. – Москва, изд. «Дрофа», 2000 г.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... закона и его роль 2.1 Предпосылки Конечно, начиная рассказывать об открытиях гениального ученого, нельзя не осветить главное открытие Д.И. Менделеева – Периодический закон. Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их многочисленных химических соединений. Многие ученые пытались классифицировать химические элементы. Одним из ...
... при 800о. Если над сплавом, полученным восстановлением оксидов меди и никеля водяным газом (56% Н2 и 25% СО) при 350 – 400оС пропускать оксид углерода (ІІ), нагретый до 50 – 60оС, при атмосферном давлении, образуется тетракарбонил никеля Ni(CO)4. Его отгоняют, и при 180 – 200оС разлагают на металлический никель и оксид углерода (ІІ) . Последний снова вводится в процесс. Никель, полученный по ...
... на 240; Тория с 116 на 232).3.2. Современная формулировка периодического закона. Д.И. Менделеев прекрасно понимал, что открытый им периодический закон и составленная на его основе периодическая система элементов обладает внутренней способностью к развитию. Современная квантово-механическая теория строения атома подтвердила правильность менделеевских воззрений на периодичность свойств химических ...









0 комментариев