Навигация
4. Синтез Гриньяра
При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот:
CH3CH2MgBr + CO2 ® CH3CH2COO-Mg+Br
Под действием сильной кислоты (обычно HCl) соль превращается в кислоту:
CH3CH2COO-Mg+Br + HCl ® CH3CH2COOH + MgBrCl
5. Гидролиз жиров
Жиры и масла - сложные эфиры глицерина и высших жирных кислот. Как все сложные эфиры, жиры могут быть подвергнуты гидролизу (омылению) действием водных растворов щелочей, минеральных кислот или водяным горячим паром под давлением
химические свойства
Карбоновые кислоты, как и спирты, способны образовывать водородные связи. Если акцептором является достаточно сильное основание, образование водородной связи предшествует полному переносу протона к основанию. В этом случае донор водородной связи считают «кислотой». Будет ли данное соединение «донором водородной связи» или «кислотой», зависит от природы «акцептора водородной связи» или «основания». Чем сильнее основание, тем больше вероятность того, что данное соединение будет вести себя по отношению к нему как кислота:
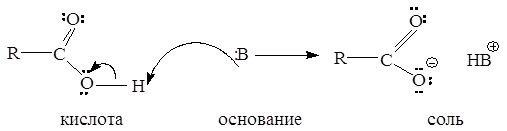
Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:
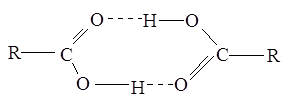
С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается.
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат-аниона, вызванной делокализацией p-электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:
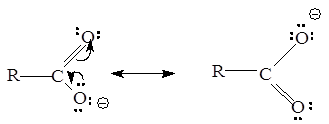
Степень делокализации изменяется в ряду RCOO- >>RCOOH >> ROH, RO-.
![]() RO- + +BH
RO- + +BH
 Энергия
Энергия
![]() RO-H + B
RO-H + B
RO-H + :B « RO- + +BH
![]() координата реакции
координата реакции

![]()
 Энергия
Энергия
 | |||
 | |||
![]() RCOOH + :B « RCOO- + +BH
RCOOH + :B « RCOO- + +BH
координата реакции
Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCO-; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу кислотности (называемую также константой диссоциации) Ка или через рКа:
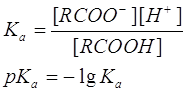
Константы кислотности большинства карбоновых кислот составляют около 10-5 (например, для уксусной кислоты 1,8×10-5), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-ион. К таким заместителям относятся галогены и прочие электроотрицательные группы. Влияние заместителей на кислотность показано в Таблице.
| Кислота | рКа |
| CH3COOH | 4,8 |
| ClCH2COOH | 2,9 |
| Cl2CHCOOH | 1,3 |
| Cl3CCOOH | 0,7 |
| FCH2COOH | 2,6 |
| CH3CH2CH2COOH | 4,8 |
| F3CCOOH | 0,2 |
1. Образование солей
Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
CH3COOH + NaOH ® CH3COONa + H2O
2. Образование галогенангидридов
Под действием галогенидов фосфора карбоновые кислоты образуют ангидриды (гидроксил замещается на галоген):
CH3COOH + PCl5 ® CH3COCl + POCl3 + HCl
Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:
CH3COOH + SOCl2 ® CH3COCl + SO2 + HCl
3. Восстановление
Карбоновые кислоты можно восстановить только с помощью очень сильных восстановителей, поэтому в качестве продуктов реакции всегда образуются первичные спирты (а не альдегиды):
CH3COOH + LiAlH4 ® CH3CH2OH
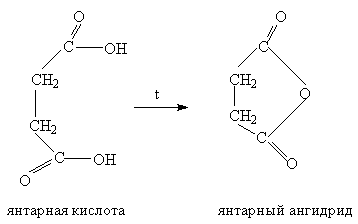
4. Декарбоксилирование
Карбоновые кислоты очень легко теряют диоксид углерода. Как правило, при этом образуется углеводород. Алифатические карбоновые кислоты декарбоксилируют в присутствии различных катализаторов, содержащих медь. CH3CH2COOH ® CH3CH3 + CO2.
К реакциям декарбоксилирования относится и синтез Кольбе (см. Лекцию №2).
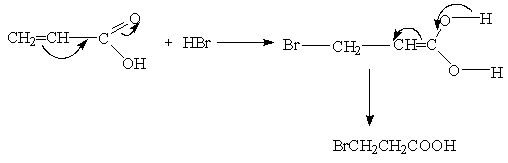
5. Этерификация
В присутствии сильной кислоты (например, серной) карбоновые кислоты дают со спиртами сложные эфиры:
CH3COOH + CH3CH2OH « CH3COOCH2CH3 + H2O
В результате реакции образуется равновесная смесь. Чтобы сместить равновесие в сторону образования продукта, используют большой избыток спирта или удаляют воду по мере ее образования.
Механизм этерификации представляет собой реакцию присоединения – отщепления (нуклеофильное ацильное замещение) Протон, являющийся катализатором, облегчает атаку карбонильной группы нуклеофилом:
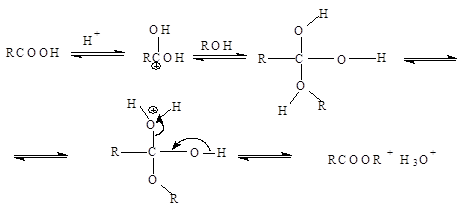
Отдельные представители
Муравьиная кислота. Получают из ее натриевой соли (формиата), которая образуется при пропускании оксида углерода через 25-30% раствор щелочи:
NaOH + CO ® HCOONa
Суспензию формиата натрия затем разлагают муравьиной кислотой.
Муравьиная кислота применяется для приготовления катализаторов, в медицине и в ряде синтезов. Из ее производных наибольшее значение имеет N,N-диметилформамид HCON(CH3)2. Он является селективным растворителем при выделении ацетилена из газовых смесей и при абсорбции HCl, SO2, CO2 и некоторых других газов.
Муравьиная кислота обладает многими химическими свойствами кислот, но ей присущи и некоторые специфические особенности:
1. является хорошим восстановителем (легко окисляется):
HCOOH + HgCl2 ® Hg + CO2 + 2 HCl
Восстановительные свойства муравьиной кислоты объясняются тем, что она в одно и то же время является кислотой и оксиальдегидом, что видно из ее формулы.
2. при нагревании с концентрированной H2SO4 распадается с образованием воды и СО:
HCOOH ® H2O + CO
3. соли щелочных металлов при сплавлении распадаются с образованием солей щавелевой кислоты (оксалаты):
2 HCOONa ® H2 + NaOOC-COONa
Уксусная кислота. Широко применяется для получения сложных эфиров, уксусного ангидрида, винилацетата, а также в производстве красителей, лекарственных и душистых веществ. Большое практическое значение имеют и соли уксусной кислоты - натрия, алюминия, хрома, железа, меди, свинца и др. В промышленности уксусная кислота получается рядом способов:
1. окисление алканов;
2. окисление этанола;
3. гидратация ацетилена и окисление получаемого ацетальдегида;
4. уксуснокислое брожение сахарсодержащих растворов.
Похожие работы
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...
... высших одноатомных спиртов. Так, например, в состав пчелиного воска входит эфир пальмитиновой кислоты и мирицилового спирта С15Н31-СО-ОС30Н61 (Тпл. 72 оС). Глицериды Глицеридами называются сложные эфиры карбоновых кислот и трехатомного спирта глицерина. Они входят в состав чрезвычайно важных веществ – жиров, поэтому на рассмотрении глицеридов мы остановимся несколько подробнее. Жиры Природные жиры ...
... вещество с запахом пота, т.пл. 31 С, т. кип. 233 С. Получают ее каталитическим гидрированием бензойной кислоты. [8] 3. ПРИМЕРЫ ПРОБЛЕМНЫХ СИТУАЦИЙ И ИХ РЕШЕНИЕ Проблемные ситуации при изучении предельных одноосновные кислоты можно рассмотреть через систему уроков по теме: «Карбоновые кислоты». УРОК 1. Карбоновые кислоты, их классификация. Краткое содержание. Строение карбоксильной группы. ...
... смол и сополимеров со стиролом, акриловым и метакриловым эфирами. Гидратацией малеинового ангидрида получают яблочную кислоту, применяемую в пищевой промышленности. Монокарбоновые кислоты ароматического ряда Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с ароматическим ядром. Кислоты, содержащие карбоксильные ...
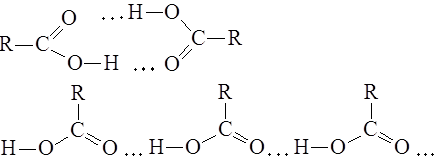

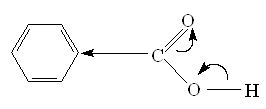
0 комментариев