Навигация
 |
Реферат
з Хімії
на тему:
p=16; p=8
e=16; 1S2 2S2 2p6 3S2 3p4 — Електронна Формула — 1S22S22p4 e=8
n=16 n=8
Підготували: Карапенко Р.
Колот А.
Дніпропетровськ - 2006
ОксигенКИСЕНЬ (лат. Oхygenіum), O, хімічний елемент з атомним номером 8, атомна маса 15,9994. У періодичній системі елементів Менделєєва розташований у другому періоді в групі VІ.
Природний кисень складається із суміші трьох стабільних нуклідів з масовими числами 16 (домінує в суміші, його в ній 99,759 % по масі), 17 (0,037%) і 18 (0,204%). Радіус нейтрального атома кисню 0,066 нм. Конфігурація зовнішнього електронного шару нейтрального не збудженого атома кисню 2 s 2 р 4. Енергії послідовної іонізації атома кисню 13,61819 і 35,118 Ев, спорідненість до електрона 1,467 Ев. Радіус іона О2-при різних координаційних числах від 0,121 нм (координаційне число 2) до 0,128 нм (координаційне число 8). У з'єднаннях виявляє ступінь окислювання -2 (валентність ІІ) і, рідше, -1 (валентність І). По шкалі Полінга электронегативність кисню 3,5 (друге місце серед неметалів після фтору ).
У вільному виді кисень - газ без кольору, запаху і смаку.
Історія відкриттяІсторія відкриття кисню, як і азоту, зв'язана з вивченням, що продовжувалися кілька століть, атмосферного повітря. Про те, що повітря по своїй природі не однорідний, а включає частини, одна з яких підтримує горіння і подих, а інша - ні, знав ще в VIII столітті китайський алхімік Мао Хоа, а пізніше в Європі - Леонардо Да Вінчі. У 1665 англійський натураліст Р. Гук писав, що повітря складається з газу, що міститься в селітрі, а також з неактивного газу, що складає велику частину повітря. Про те, що повітря містить елемент, що підтримує життя, у 18 столітті було відомо багатьом хімікам. Шведський аптекар і хімік Карл Шееле почав вивчати склад повітря в 1768. Протягом трьох років він розкладав нагріванням селітри (KNO3, NaNO3) і інші речовини й одержував "вогненне повітря", що підтримує подих і горіння. Але результати своїх досвідів Шееле обнародував тільки в 1777 році в книзі "Хімічний трактат про повітря і вогонь". У 1774 англійський священик і натураліст Дж. Прістлі нагріванням "паленої ртуті" (оксиду ртуті Hg) одержав газ, що підтримує горіння. Будучи в Парижі, Прістлі, що не знав, що отриманий їм газ входить до складу повітря, повідомив про своє відкриття А. Лавуазьє й іншим ученим. До цього часу був відкритий і азот. У 1775 Лавуазьє прийшов до висновку, що звичайне повітря складається з двох газів - газу, необхідного для подиху і підтримуючого горіння, і газу "протилежного характеру" - азоту. Лавуазьє назвав підтримуючий горіння газ oxygene - "утворюючий кислоти" (від грецьк. oxys - кислий і gennao - народжую; звідси і російська назва "кисень"), тому що він тоді вважав, що всі кислоти містять кисень. Давно уже відомо, що кислоти бувають і безкисневими, але назва, дана елементу Лавуазьє, залишилося незмінною.
Протягом майже півтора століть 1/16 частина маси атома кисню служила одиницею порівняння мас різних атомів між собою і використовувалася при чисельній характеристиці мас атомів різних елементів (так називана киснева шкала атомних мас).
Кисень - найпоширеніший на Землі елемент, на його частку (у складі різних з'єднань, головним чином силікатів), приходиться близько 47,4% маси твердої земної кори. Морські і прісні води містять величезна кількість зв'язаного кисню - 88,8% (по масі), в атмосфері зміст вільного кисню складає 20,95 % (по обсязі). Елемент кисень входить до складу більш 1500 з'єднань земної кори.
ОдержанняВ даний час кисень у промисловості одержують за рахунок поділу повітря при низьких температурах. Спочатку повітря стискають компресором, при цьому повітря розігрівається. Стиснутому газу дають остудитися до кімнатної температури, а потім забезпечують його вільне розширення. При розширенні температура газу різко знижується. Охолоджене повітря, температура якого на кілька десятків градусів нижче температури навколишнього середовища, знову піддають стиску до 10-15 МПа. Потім знову відбирають теплоту, що виділилася. Через кілька циклів "стиск-розширення" температура падає нижче температури кипіння і кисню, і азоту. Утвориться рідке повітря, що потім піддають перегонці (дистиляції). Температура кипіння кисню (-182,9°C) більш ніж на 10 градусів вище, ніж температура кипіння азоту (-195,8°C). Тому з рідини азот випаровується першим, а в залишку накопичується кисень. За рахунок повільної (фракційної) дистиляції вдається одержати чистий кисень, у якому зміст домішки азоту складає менш 0,1 об'ємного відсотка.
Ще більш чистий кисень можна одержати при електролізі водяних розчинів лугів (NaOH чи KOH) чи солей кисневмісних кислот (звичайно використовують розчин сульфату натрію Na2SO4). У лабораторії невеликі кількості не дуже чистого кисню можна одержати при нагріванні перманганату калію KMn4:
![]() 2KMn4 = K2Mn4 + Mn2 + O2.
2KMn4 = K2Mn4 + Mn2 + O2.
Більш чистий кисень одержують розкладанням пероксиду водню Н2O2 у присутності каталітичних кількостей твердого діоксида марганцю Mn2:
![]() 2Н2O2 = 2Н2O + O2.
2Н2O2 = 2Н2O + O2.
Кисень утвориться при сильному (вище 600°C) прожарюванні нітрату натрію NaNO3:
![]() 2NaNO3 =2NaNO2 + O2,
2NaNO3 =2NaNO2 + O2,
при нагріванні деяких вищих оксидів:
![]() 4Cr3= 2Cr2O3 + 3O2;
4Cr3= 2Cr2O3 + 3O2;
![]() 2Pb2 = 2Pb + O2;
2Pb2 = 2Pb + O2;
![]() 3Mn2 = Mn3O4 + O2.
3Mn2 = Mn3O4 + O2.
Раніше кисень одержували розкладанням Бертолетової солі KCl3 у присутності каталітичних кількостей диоксида марганцю Mn2:
![]() 2KCl3 = 2KCl + 3O2.
2KCl3 = 2KCl + 3O2.
Однак бертолетова сіль утворить вибухові суміші, тому її для одержання кисню в лабораторіях тепер не використовують. Зрозуміло, зараз нікому в голову не прийде використовувати для одержання кисню прожарювання оксиду ртуті Hg, тому що кисень, що утвориться в цій реакції, забруднений отрутними парами ртуті.
Джерелом кисню в космічних кораблях, підвідних човнах і т.п. замкнутих приміщеннях служить суміш пероксиду натрію Na2O2 і супероксиду калію KO2. При взаємодії цих з'єднань з вуглекислим газом звільняється кисень:
![]() 2Na2O2 + 2CO2 = 2Na2CO3 + O2,
2Na2O2 + 2CO2 = 2Na2CO3 + O2,
![]() 4K2 + 2CO2 = 2K2CO3 + 3O2.
4K2 + 2CO2 = 2K2CO3 + 3O2.
Якщо використовувати суміш Na2O2 і K2, узятих у молярному відношенні 1:1, то на кожен моль поглиненого з повітря вуглекислого газу буде виділятися 1 моль кисню, так що склад повітря не буде змінюватися за рахунок поглинання при подиху кисню і виділення CO2.
Особливості будови молекули O2
Атмосферний кисень складається з двохатомних молекул. Міжатомне відстань у молекулі O2 0,12074 нм. Молекулярний кисень (газоподібний і рідкий) - парамагнітна речовина, у кожній молекулі O2 знаходиться по 2 неспарених електрони.
Енергія дисоціації молекули O2 на атоми досить висока і складає 493,57 кдж/моль.
Фізичні і хімічні властивостіПри нормальних умовах щільність газу кисню 1,42897 кг/м3. Температура кипіння рідкого кисню (рідина має блакитний колір) -182,9°C. При температурах від -218,7°C до -229,4°C існує твердий кисень з кубічними ґратами (модифікація), при температурах від -229,4°C до -249,3°C - модифікація з гексагональними ґратами і при температурах нижче -249,3°C - кубічна -модифікація. При підвищеному тиску і низьких температурах отримані й інші модифікації твердого кисню.
При 20°C розчинність газу O2: 3 ,1 мл на 100 мл води, 22 мл на 100 мл етанолу, 23,1 мл на 100 мл ацетону. Існують органічні фторовмісні рідини (наприклад, перфторбутилтетрагідрофуран), в яких розчинність кисню значно вища.
Висока міцність хімічного зв'язку між атомами в молекулі O2 призводить до того, що при кімнатній температурі газоподібний кисень хімічно досить малоактивний.
У природі він повільно вступає в перетворення при процесах гниття. Крім того, кисень при кімнатній температурі здатний реагувати з гемоглобіном крові (точніше з залізом ІІ гема), що забезпечує перенос кисню від органів подиху до інших органів.
З багатьма речовинами кисень вступає у взаємодію без нагрівання, наприклад, з лужними і лужноземельними металами (утворяться відповідні оксиди типу Lі2O, CaО і інші, пероксиди типу Na2O2, BaО 2 та ін. і супероксиди типу KО 2, RbО 2 та ін.), викликає утворення іржі на поверхні сталевих виробів.
Без нагрівання кисень реагує з білим фосфором, з деякими альдегідами й іншими органічними речовинами.
При нагріванні, навіть невеликому, хімічна активність кисню різко зростає. При підпалюванні він реагує з вибухом з воднем, метаном, іншими пальними газами, з великою кількістю простих і складних речовин. Відомо, що при нагріванні в атмосфері кисню чи на повітрі багато простих і складних речовин згоряють, причому утворюються різні оксиди, наприклад:
![]() S+O2 = SO2
S+O2 = SO2
![]() С + O2 = СО2
С + O2 = СО2
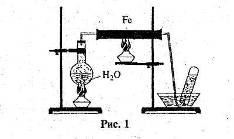
![]() 4Fe + 3O2 = 2Fe2O3
4Fe + 3O2 = 2Fe2O3
![]() 2Cu + O2 = 2Cu
2Cu + O2 = 2Cu
![]() 4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
![]() 2H2S + 3O2 = 2H2O + 2SO2
2H2S + 3O2 = 2H2O + 2SO2
Якщо суміш кисню і водню зберігати в скляній судині при кімнатній температурі, то екзотермічна реакція утворення води
![]() 2Н2 + O2= 2Н2O + 571 кДж
2Н2 + O2= 2Н2O + 571 кДж
протікає вкрай повільно; з розрахунку, перші крапельки води повинні з'явитися в судині приблизно через мільйон років. Але при внесенні в судину із сумішшю цих газів Платини чи Палладія (що грають роль каталізатора), а також при підпалюванні реакція протікає з вибухом.
З азотом N2 кисень чи реагує при високій температурі (близько 1500-2000 C), чи при пропущенні через суміш азоту і кисню електричного розряду. При цих умовах оборотно утвориться оксид азоту (ІІ):
![]() N2 + O2 = 2NO
N2 + O2 = 2NO
Утворений NO потім реагує з киснем з утворенням бурого газу (диоксида азоту):
![]() 2NO + O2 = 2NO2
2NO + O2 = 2NO2
З неметалів кисень прямо ні при яких умовах не взаємодіє з галогенами, з металів - зі шляхетними металами: Сріблом, Золотом, Платиною й ін.
Бінарні сполуки кисню, у яких ступінь окислювання атомів кисню дорівнює -2, називають оксидами (колишня назва - окисли). Приклади оксидів: оксид вуглецю (ІV) CO2,оксид сірки (VІ) SO3, оксид міді (І) Cu2O, оксид алюмінію Al2O3, оксид марганцю (VІІ) Mn2O7.
Кисень утворює також сполуки, у яких його ступінь окислювання дорівнює -1. Це - пероксиди (стара назва - перекиси), наприклад, пероксид водню Н2O2, пероксид барію ВаО2, пероксид натрію Na2O2 і інші. У цих сполуках міститься пероксидне угруповання —O—O—.
З активними лужними металами, наприклад, з калієм, кисень може утворювати також супероксиди, наприклад, KО2 (супероксид калію), RbО2 (супероксид рубідію). У супероксидах ступінь окислювання кисню -1/2. Можна відзначити, що часто формули супероксидів записують як K2O4, Rb2O4 і т.д.
Із самим активним неметалом фтором кисень утворить з'єднання в позитивних ступенях окислювання. Так, у з'єднанні O2F2 ступінь окислювання кисню +1, а в з'єднанні O2F - +2. Ці з'єднання належать не до оксидів, а до фторидам. Фториди кисню можна синтезувати тільки непрямим шляхом, наприклад, діючи фтором F2 на розведені водяні розчини КОН.
Застосування киснюЗастосування кисню дуже різноманітно. Основна кількість одержуваного з повітря кисню використовуються в металургії. Кисневе (а не повітряне) дуття в домнах дозволяє істотно підвищувати швидкість доменного процесу, заощаджувати кокс і одержувати чавун кращої якості. Кисневе дуття застосовують у кисневих конвертерах при переділі чавуна в сталь. Чистий кисень чи повітря, збагачене киснем, використовується при одержанні і багатьох інших металів (міді, нікелю, свинцю й ін.). Кисень використовують при різанні і зварюванні металів. При цьому застосовують "балонний" кисень. У балоні кисень може знаходитися під тиском до 15 Мпа. Балони з киснем пофарбовані в блакитний колір.
Рідкий кисень - потужний окислювач, його використовують як компонент ракетного палива. Просочені рідким киснем такі матеріали, як деревні опилки, вата, вугільний порошок та ін. (ці суміші називають оксиліквітами ), використовують як вибухові речовини, застосовувані, наприклад, при прокладці доріг у горах.
Біологічна роль киснюКисень в атмосфері Землі почав накопичуватися в результаті діяльності первинних фотосинтезуючих організмів, що з'явилися, імовірно, близько 2,8 млрд. років тому. Вважають, що 2 млрд. років тому атмосфера вже містила близько 1% кисню; поступово з відбудовної вона перетворювалася в окисну і приблизно 400 млн. років тому придбала сучасний склад. Наявність в атмосфері кисню в значній мірі визначило характер біологічної еволюції. Аеробний (за участю О2) обмін речовин виник пізніше анаеробного (без участі O2), але саме реакції біологічного окислювання, більш ефективні, чим древні енергетичні процеси шумування і гліколізу, постачають живі організми здебільшого необхідної їм енергії. Виключення складають облігатні анаероби, наприклад, деякі паразити, для яких кисень є отрутою.
Використання кисню, що володіє високим окислювально-відновним потенціалом, як
кінцевого акцептор електронів у ланцюзі дихальних ферментів, привело до виникнення біохімічного механізму подиху сучасного типу. Цей механізм і забезпечує енергією аеробні організми.
Кисень - основний біогенний елемент, що входить до складу молекул усіх найважливіших речовин, що забезпечують структуру і функції кліток - білків, нуклеїнових кислот, вуглеводів, ліпідів, а також безлічі низькомолекулярних сполук. У кожній рослині чи тварині кисню набагато більше, ніж будь-якого іншого елемента (у середньому близько 70%).
М'язова тканина людини містить 16% кисню, кісткова тканина - 28.5%; усього в організмі середньої людини (маса тіла 70 кг) міститься 43 кг кисню. В організм тварин і людини кисень надходить в основному через органи подиху (вільний кисень) і з водою (зв'язаний кисень). Потреба організму в кисні визначається рівнем (інтенсивністю) обміну речовин, що залежить від маси і поверхні тіла, віку, статі, характеру харчування, зовнішніх умов і ін.
Невеликі кількості кисню використовують у медицині: киснем (з так званими кисневими подушками) дають якийсь час дихати хворим, у яких утруднений подих. Потрібно, однак, мати на увазі, що тривале вдихання повітря, збагаченого киснем, небезпечно для здоров'я людини. Високі концентрації кисню викликають у тканинах утворення вільних радикалів, що порушують структуру і функції біополімерів. Подібною дією на організм володіють і іонізуючі випромінювання. Тому зниження вмісту кисню (гіпоксія) у тканинах і клітках при опроміненні організму іонізуючою радіацією має захисну дію - так називаний кисневий ефект. Цей ефект використовують у променевій терапії: підвищуючи вміст кисню в пухлині і знижуючи його зміст у навколишніх тканинах підсилюють променеву поразку пухлинних кліток і зменшують ушкодження здорових. При деяких захворюваннях застосовують насичення організму киснем під підвищеним тиском - гіпербаричну оксигенацію.
Сульфур Хімічні властивостіХімічна активність сірки також доволі висока. При нагрівання вона реагує майже з усіма елементами.
Похожие работы
... енергетичних рівнів.) 2. Чому електрони внутрішніх енергетичних рівнів не беруть участі в утворенні хімічного зв'язку? Розповідь учителя. Знаючи будову електронної оболонки атомів, можна припустити | можливі валентності елементів, тобто можливу кількість хімічних: зв'язків, які може утворити атом. Електрони, що беруть участь в утворенні хімічного зв'язку, ще називають валентними. В утворенні ...
... умови проведення процесу; -уміти проводити економічний аналіз; -уміти складати план природоохоронних заходів та заходів з охорони праці на виробництві. Обладнання: схеми "Наукові основи виробництва", "Комплексне використання мідної руди", "Контактний спосіб виробництва сульфатної кислоти". Виконання проекту І. Організація класу. II. Підведення учнів до формування проблеми. " Мозкова атака" ...
... шаром гасу чи вазелинового масла. При внесенні у вогонь деякі лужноземельні метали дають характерне забарвлення: кальцій - темно-оранжеве, барій та радій - темно-червоне, стронцій - блідо-зелене. 2.2.3 Хімічні властивості Метали ІІА-підгрупи мають загальну електронну формулу зовнішнього енергетичного рівня ns2, на попередньому електронному шарі містять по всім електронів, а атом берилію - ті ...
... сполуки”, а також зорієнтовані на їх загальний розвиток. Об’єкт дослідження: процес вивчення теми “Залізо та його сполуки” у класах з поглибленим вивченням хімії,мтворчо та інтелектуально обдарованими учнями. Предмет дослідження: навчання особливості організації та змісту урочної навчальної діяльності учнів. Дане педагогічне дослідження має переваги над існуючою традиційною технологією, яка ...


0 комментариев