Навигация
Анализ ВАХ циклированых кривых
2.2 Анализ ВАХ циклированых кривых
Раствор медно-аммиачного комплекса приготовленного химически
А) Исследование циклических вольт-амперных зависимостей red-ox реакций осуществлялась на вольтолабе как в анодную так и в катодную сторону при скорости развертки 10мВ/с.
Развертку потенциала Е вели от стационарного значения до потенциала начала разложения воды, то есть при анодной развертки до выделения О2, а при катодной – до выделения Н2. На анодной кривой четко видны пики тока при Е = 0,27 В. Так как в системе Pt| [Cu(NH3) 4] SO4 |Pt окислятся нечему, при данных условиях, то очевидно этот пик соответствует окислению Cu+ до Cu2+. Начиная от Е=1В начинается выделение кислорода. При движении в катодную сторону виден сглаженный противопик. Так как потенциалы не близкие со следующим то процесс Cu2+→Cu невозможен. Поэтому пики соответствуют процессам:
Cu2+→Cu+ и [Cu(NH3) 4] SO4 → Cu
Дальше протекает процесс выделения водорода.
Б) При движении в катодную сторону видно откланение потенциала от стационарного, это свидетельствует о протекании постороннего процесса. Электроды после первого эксперимента не были очищены! (Рис. 3)
Вывод: Анодно свободная медь не образуется. Из раствора образуется одновалентная медь. Область разложения воды от 0,8 до 1 В.
Раствор медно-аммиачного комплекса приготовленного Эл.химически
А) При движении в анодную сторону виден явно выраженный пик. Потенциал Е=0,1–0,15В соответствует окислению раннее наработанной одновалентной меди: Cu+ →Cu2+
Противопик Е=-0,3В не явно соответствует процессу восстановлению меди из комплекса, так как потенциал выделения водорода не установлен. Необходимо работать в более расширенном диапазоне!
Б) При движении в катодную сторону протекают те же процессы, что и при анодном движении. На катодном участке, при 4 – ох циклах видны пики (Е=0,25), потенциалы которых отличаются на не значительную величину, что говорит о протекании посторонних процессов. Электрод загрязнен! Так же на анодной кривое не достигнут потенциал выделения кислорода.
Вывод: Как видно из кривых, медноаммиачный раствор приготовленный электрохимически более чистый (имеет на кривой более четкий вид), но с меньшей концентрацией меди. (Рис. 4)
Раствор медно-аммиачного комплекса с целлюлозой приготовленного химически
А) При анодном движении виден потенциал отклоненный от стационарного – электрод не очищен! Заметен пик окисления одновалентной меди:
Cu+ →Cu2+ Е=0,25В
Начиная с потенциала Е=1В – Выделение O2 – Е=1,25В
На катодной кривой – слабый пик восстановлении меди – Cu++→Cu+ и восстановление свободной меди из комплекса – [Cu(NH3) 4] SO4 → Cu.
Б) При движ в катодную сторону виден слабый противопик восстановления меди – Cu++→Cu+ и дальнейшее восстановление Cu из лиганда.
Раствор медно-аммиачного комплекса с целлюлозой приготовленного Эл. химически
Пики на анодной кривой, при движении в а. и к. стороны отличаются. Комплекс полученый электрохимическим путем сонержит в себе меньшую концентрацию меди, чем раствор полученый из сульфата, но при более отрицательном потенциале происходит окисление постороннего вещества, так как электрод не был ранее очищен! (Рис. 6)
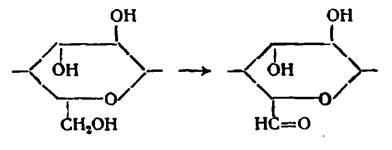
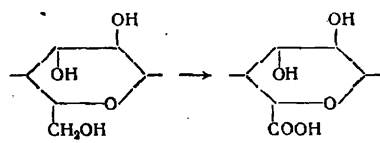
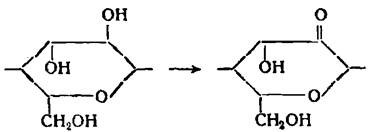
Вывод: Дальнейшая работа с раствором предусмотрена в области выделения кислорода, потому как в противоположной стороне (выд. Н2) – образование кетонов.
Заключение
Химический метод получения волокна имеет ряд существенных отличий и достоинств, простота, удобство и по этому быстрое получение, и по этому широко применяется в производстве. Однако электрохимический метод имеет свою весомую характеристику и отличие. Электрохимически, получение медно аммиачного волокна формируется не только внешними факторами (температура, концентрация.), как это наблюдается в химическом методе, но и возможность варьировать внутренними показателями – это электрические параметры (напряжение, плотность тока…). Это приносит весомое достоинство, потому как подбором параметров, на поверхности электрода образуется двойной электрический слой, и потому осадки могут иметь различную толщину с различными свойствами и большой рассеивающей способностью. По данным проведенного эксперимента и анализа растворов, а это снятие вольтамперных циклических характеристик, данные растворы пригодны для дальнейшего эксперимента, электрохимическое осаждение волокна на поверхность электрода.
Электрохимический метод, в будущем, может принести особую пользу в промышленности
Литература
1. Технология медноаммиачного волокна. / Под ред. Доктора техн. Наук, проф. А.Б. Пашкевер. Москва, 1941. 345 с.
2. Химия древесины и ее основных компонентов. Методическое пособие./ составитель: проф. Н.Г. Базарнова. Бараул, 2002.
Похожие работы
... известное синтетическое волокно – полиамидное (США). Производство в промышленном масштабе полиэфирных, полиакрилонитрильных и полиолефиновых синтетических волокон осуществлено в 1954 –1960. Свойства. Химические волокна часто обладают высокой разрывной прочностью [до 1200 Мн/м2 (120кгс/мм2)], значит разрывным удлинением, хорошей формоустойчивостью, несминаемостью, высокой устойчивостью к ...
... свойствами, тогда как возможности варьировать свойства искусственных волокон очень ограничены, поскольку их формуют практически из одного полимера (целлюлозы и её производных). Синтетические волокна характеризуются высокой прочностью, водостойкостью, износостойкостью, эластичностью и устойчивостью к действию химических реагентов. Производство синтетических волокон развивается более быстрыми ...
... кислот с соответствующим катализатором, например серной кислотой. Простые эфиры могут образовываться в результате действия концентрированного гидроксида натрия, приводящего к образованию натронной целлюлозы, и последующей реакции с алкилгалогенидом: Реакция с оксидом этилена или пропилена дает гидроксилированные простые эфиры: Наличием этих гидроксильных групп и геометрией макромолекулы ...
... в виде волокнистого материала и бинта) обрабатывалась 1 М водным раствором перекиси водорода. Как было показано в литературном обзоре, при окислении целлюлозы перекисью водорода происходит неизбирательное окисление, в результате которого возможно образование карбонильных (альдегидных и кетонных) и карбоксильных групп, с разрывом и без разрыва пиранового кольца. Вторым компонентом, используемым ...
0 комментариев