Навигация
Определение массовой доли вещества
Задача 1. Раствор нитрата калия объемом 60 мл и концентрацией 2 моль/л прокипятили в сильнощелочной среде с 6,48 г алюминия. Выделившийся газ пропустили при нагревании через трубку с оксидом меди(П) массой 11,2 г. Рассчитайте массовую долю меди в полученном твердом остатке.
Решение
1. Напишем уравнения реакций:
![]()
![]()
2. Рассчитаем количество вещества KNO3, Al и по веществу, которое прореагировало полностью, определим количество вещества
NH3:
ra(KNO3)ζ 0,06 л 2моль/лζ 0,12 моль;
![]() ж 0,24 моль — прореагирует полностью;
ж 0,24 моль — прореагирует полностью;
![]() 0,09 моль.
0,09 моль.
3. Так как по условию задачи необходимо рассчитать массовую долю меди в твердом остатке, следовательно, оксид меди(П) в избытке:
![]()
![]()
![]()
ra(CuO) ж 0,005 моль; (CuO) 0,005 моль 80 г/моль ж 0,4 г.
4. Рассчитаем количество вещества и массу образовавшейся меди:
Ti(Cu) ж Ti^^CuO) ж 0,135 моль; to(Cu) ж 0,135 моль 64 г/моль ж 8,64 г.
5. Hайдем массу смеси и массовую долю меди в ней: т(см.) = m(CuO) K m(Cu); т(см.) = 0,4г K 8,64г = 9,04 г;
![]()
Ответ:![]() = 95,58%.
= 95,58%.
Задача 2. Cмесь кальция и алюминия (молярное отношение металлов в смеси 2: 3) прокалили с избытком углерода без доступа воздуха. Полученную смесь продуктов обработали водой. Выделившиеся газы пропустили через склянку с бромной водой. Масса склянки увеличилась на 2,6 г. Определите массу исходной смеси.
Решение
1. При прокаливании с углеродом без доступа воздуха (отсутствие кислорода) образуются только карбиды металлов, при обработке которых водой получаются метан и ацетилен. При пропускании этих газов через бромную воду с бромом реагирует только ацетилен, поэтому масса склянки увеличилась на массу ацетилена. Запишем уравнения реакций:
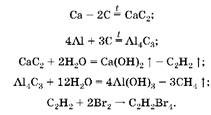
2. Hайдем массу кальция:
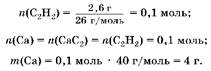
3. Hайдем массу алюминия.
По условию A (Ca): A (Al) = 2: 3, следовательно,
![]()
m(Al) = 0,15 моль ■ 27 г/моль = 4,05 г.
4. Вычислим массу смеси:
![]()
то(см.) ж 4 г K 4,05 г ж 8,05 г. Ответ: то(см.) ж 8,05г.
Задача 3. Смесь хрома и железа массой 1,6 г полностью прореагировала с газом, выделившемся при электролизе 30,4 г 20%-го раствора хлорида меди (II). Определите массовые доли металлов в смеси.
Решение
1. С хлором взаимодействуют и хром, и железо с образованием хлоридов трехвалентных металлов:
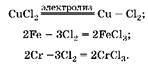
2. Определим количество вещества хлора, полученного при электролизе:
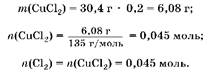
3. Выразим массы металлов через,.
Пусть ra2(Cl2)ζ, моль, тогда ra3(Cl2)ζ (0,045 —,)моль;
![]()
![]()
4. Составим уравнение:
![]()
Решая уравнение, получаем, что, ж0,015.
5. Найдем массовые доли металлов в смеси:
![]()
![]()
![]()
Ответ:![]() ж 65%;
ж 65%;![]() ж 35%.
ж 35%.
Задача 4. Продукты реакции, образовавшиеся при сплавлении смеси, содержащей оксид хрома(Ш), гидроксид калия и хлорат калия в стехиометрических количествах, растворили в воде и добавили избыток раствора хлорида бария. При этом образовался осадок массой 50,6 г. Найдите массу оксида хрома(Ш) в смеси.
Решение
1. При сплавлении Cr2O3 с щелочными расплавами окислителей происходит окисление хрома(Ш) и образуются хроматы:
![]()
2. Найдем количество вещества и массу Cr2O3 в смеси:
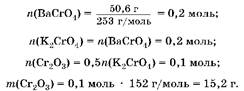
Ответ:![]() ж 15,2 г.
ж 15,2 г.
Задача 5. Смесь оксидов алюминия и хрома(Ш) обработали избытком концентрированного раствора щелочи. Раствор отфильтровали. Осадок отделили, промыли, высушили и прокалили с гид-роксидом натрия, при этом образовалась соль массой 16,05 г. Через фильтрат пропустили избыток углекислого газа, в результате чего образовался осадок массой 3,9 г. Определите массовую долю оксида хрома(Ш) в смеси.
Pешение
1. В концентрированном растворе щелочи растворяется только оксид алюминия с образованием комплексной соли. При пропускании углекислого газа через ее раствор эта соль разрушается и образуется гидроксид алюминия. Смесь хрома(Ш), который не растворился в растворе щелочи, при сплавлении с гидроксидом натрия образует хромит натрия:
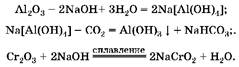
2. Oпределим массу Al2O3 в смеси:
![]()
![]()
An(Al2O3) = 0,025 моль ■ 102 г/моль = 2,55 г.
3. Hайдем массу Cr2O3 в смеси:
![]()
![]()
An(Cr2O3) = 0,075 моль ■ 152 г/моль = 11,4 г.
4. Hайдем массовую долю Cr2O3 в смеси:
т(см.) = 11,4 г K 2,55 г = 13,95 г;
![]()
Oтвет: MJ(Cr2O3) = 81,72%.
Задача 6. Cмесь хлоридов алюминия и хрома(Ш) массой 317 г обработали сначала избытком раствора гидроксида калия, а затем — избытком хлорной воды. К полученному раствору прилили избыток нитрата бария, при этом образовалось 126,5 г осадка желтого цвета. Рассчитайте массовую долю хлорида хрома(Ш) в исходной смеси.
Pешение
1. В избытке щелочи образуются гидроксокомплексы и алюминия, и хрома(Ш), но с хлорной водой реагирует только гидроксо-комплекс хрома(Ш):
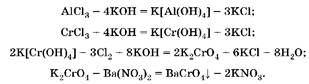
2. По количеству хромата бария (осадок желтого цвета) рассчитаем количество вещества, массу и массовую долю CrCl3:
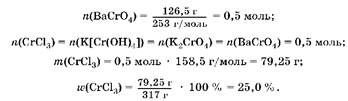
Oтвет: M(CrCl3) = 25,0%.
Задача 7. При гидролизе средней соли образовалось 20,4г вещества H2X, массовая доля водорода в котором равна 5,88%, и 41,2 г вещества M(OH)3, массовая доля M в котором равна 50,49%. Oпределите формулу соли.
Pешение
1. Для определения элемента X находим массу и количество вещества элементов водорода и X, содержащихся в 20,4 г вещества H2X, а также молярную массу элемента X:
![]()
m(X) = 20,4 г - 1,2 г = 19,2 г;
![]()
![]()
следовательно, X — это сера.
2. Определяем массу элемента М:
![]()
то(М) ж41,2 г 0,5049 ж 20,8 г.
3. Так как количество вещества элемента М и количество вещества M(OH)3 равны, то составим уравнение и определим элемент М, обозначив его молярную массу через
![]()
Решая уравнение, находим, что - = 52 г/моль, следовательно, элемент М — это хром.
4. Для определения формулы соли необходимо знать количество вещества элементов серы и хрома:
![]()
следовательно, формула соли Cr2S3. Ответ: Cr2S3.
Задача 7. Газ, образовавшийся при разложении дихромата аммония массой 126 г, смешали с газом, выделившимся при растворении 42 г гидрида натрия в 900 мл 2 M раствора хлороводорода, и пропустили при соответствующих условиях над никелевым катализатором. Продукт реакции растворили в избытке раствора азотной кислоты. Рассчитайте, насколько увеличится масса раствора азотной кислоты.
Решение
1. Масса азотной кислоты увеличивается за счет поглощения аммиака, который образуется при соответствующих условиях из водорода и азота:
(1) (2)
(3) 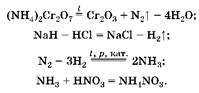 (4)
(4)
2. Найдем количество вещества азота:
![]()
3. Определим количество вещества водорода:
![]()
ra(HCl) ж 2 моль/л 0,9 л ж 1,8 моль — избыток, значит, количество вещества водорода определяем по NaH:
ra(H2)ζ ra(NaH) ж 1,75 моль.
4. Сравним количество вещества N2 и H2. По уравнению:
![]()
а имеем 0,5 моль, следовательно, азот прореагирует полностью.
5. Вычислим массу аммиака:
ra(NH3)ζ 2ra(N2)ζ 1моль; то(NH3)ζ 1 моль ■ 17 г/моль ж 17 г — на столько увеличится масса раствора азотной кислоты. Ответ:![]() ж 17 г.
ж 17 г.
Задача 8. К раствору хлорида железа, содержащему 13,0 г соли, прибавили избыток гидроксида калия. При этом образовался осадок массой 8,56 г. Определите валентность железа в хлориде.
Решение
1. Известны нераствормые гидроксиды железа(11) и железа(Ш). Обозначим валентность железа в хлориде через,:
![]()
2. Выразим через & количество вещества соли и гидроксида железа:
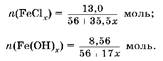
3. вставим уравнение:
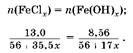
Pешая уравнение, получаем, что валентность железа в хлориде равна III.
Oтвет: III.
Задача 9. Cмесь металла и сульфида данного металла полностью растворилась в 10%-ной соляной кислоте, при этом выделилось 11,2 л (н. у.) газа. При добавлении к образовавшемуся раствору раствора красной кровяной соли образуется осадок синего цвета. При пропускании выделившегося газа через избыток раствора нитрата свинца образуется 47,8 г осадка черного цвета. Oпределите массовые доли компонентов смеси.
Pешение
1. Исходная смесь полностью растворилась в соляной кислоте, следовательно, и металл, и сульфид данного металла прореагировали нацело. Взаимодействие с красной кровяной солью с образованием осадка синего цвета (турнбулевой сини) — качественная реакция на катион Fe2K, следовательно, металл — железо, сульфид металла — FeS:
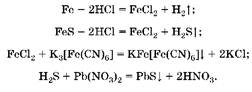
2. Hайдем массу сульфида железа: 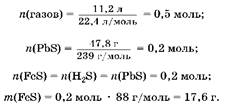
3. Oпределим массу железа:
Ai(H2) = га(газов) - Ai(H2S); Ai(H2) = 0,5 моль - 0,2 моль = 0,3 моль; Ai(Fe) = (H2) = 0,3моль; An(Fe) = 0,3 моль ■ 56 г/моль = 16,8 г.
4. Вычислим массовые доли компонентов смеси:
т(см.) = 16,8 г K 17,6 г = 34,4 г;
![]()
M(Fe) = 100%- 51,16%=48,84%. Oт в е т: M(Fe) = 48,84%; M(FeS) = 51,16%.
Задача 6.334. Cмесь железа и магния обработали концентрированной серной кислотой и собрали газ объемом 1,68 л (н. у.). ^ра-створившийся остаток отделили и обработали разбавленной азотной кислотой, при этом остаток полностью растворился. Полученный раствор осторожно выпарили, соль прокалили. Масса твердого остатка составила 12 г. Oπределите количественное соотношение металлов в смеси.
Pешение
1. Железо при обычных условиях с концентрированной серной кислотой не взаимодействует, но растворяется в разбавленной азотной кислоте с образованием нитрата железа(Ш):
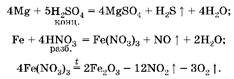
2. Вычислим количество вещества магния:
![]()
3. Вычислим количество вещества железа: 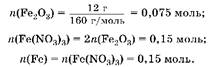
Похожие работы
ерхового брожения типа Hefeweizen, Wei bier и др. Благодаря высокой экстрактивности доля пшеничного солода при производстве пшеничного пива находится в пределах 50-60%. [4] В качестве пивоваренных используются только некоторые сорта пшеницы, причем большим спросом пользуются озимые сорта из-за более низкого содержания белка и повышенного содержания экстракта, а также как дающие более светлое ...
... . Это приводит к ошибкам из-за отсутствия стандартного эталонного препарата и варьирования коэффициентов поглощения у препаратов различного происхождения. 1. Предварительная обработка При количественном определении лигнина кислотным гидролизом из растительного сырья необходимо предварительно удалить из древесины смолы, жиры, воски, неомыляемые вещества подходящими органическими растворителями. ...
... даются обволакивающие средства и анальгетики, подается О2 с обеспечением адекватной вентиляции легких, производится коррекция водноэлектролитного баланса. 7. Физико-химические методы определения фенола 7.1 Фотоколориметрическое определение массовой доли фенолов в очищенных производственных сточных водах после установки обессмоливания фенол химический токсический получение 1. Цель работы. ...
... от теоретических · объяснить отклонения полученных результатов от теоретических · сделать вывод о применимости данного метода определения германия в соединениях для вычисления его массовой доли в твердом электролите GeSe-GeJ2 и об отклонении состава твердого электролита от теоретического. Литературный обзор При подготовке к проведению экспериментальной части курсовой работы был проведен ...


0 комментариев