Навигация
Характеристика исходного сырья
2.1. Характеристика исходного сырья
Сырьем для получения фосфорной кислоты являются ортофосфаты – соли ортофосфорной кислоты.
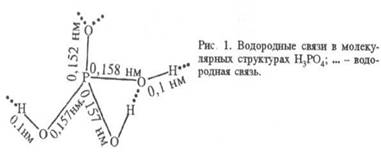
Содержащийся в ортофосфатах ион РО43- имеет структуру тетраэдра, расстояние Р-О составляет 1,54-1,60Å. Известны однозамещенные (например, КН3РО4,Са(Н3РО4)2 и др.), двузамещенные (например, (NH4)2НРО4, NH4NаНРО4 и т.д.) и трехзамещенные (например, Са3(РО4)2, NH4MgPO4 и т.д.) ортофосфаты. При прокаливании кислых ортофосфатов в зависимости от условий нагревания образуются кольцевые мета- или цепные полифосфаты. Однозамещениые ортофосфаты растворимы в воде, из двузамещенных и трехзамещенных растворимы только соли щелочных металлов и аммония. В водных растворах ортофосфаты щелочных металлов гидролизуются. Большинство ортофосфатов, кроме ортофосфатов Bi, Sn, Ti, Zr, Hf, Th, растворимы в сильных кислотах.
Растворимые в воде ортофосфаты получают добавлением необходимых количеств Н3РО4 к растворам гидроокисей или карбонатов, нерастворимые ортофосфаты получают с помощью реакции обмена. Ортофосфаты Ca, NH4+ используются в производстве фосфорных удобрений, эмалей, матовых стекол, в фармацевтической промышленности, в производстве огнестойких материалов.
2.2. Характеристика готового продукта
Ортофосфорная кислота (Н3РО4) – бесцветные кристаллы, плотность 1,87, температура плавления 42,35°С, теплота образования DН0298= -309,4 ккал/моль.
Безводная Н3РО4 склонна к переохлаждению. При нормальной температуре инертна и ниже 350°С не восстанавливается углеродом и водородом. При повышенных температурax реагирует с большинством металлов и их окислов, действуя даже на кварц, золото и т.д. С водой Н3РО4 смешивается во всех отношениях. Кипение растворов Н3РО4 сопровождается разложением и образованием азеотропной смеси, содержащей 91,1-92,1%Р2О5 (чистая Н3РО4 содержит 72,4% Р2О5). Для Н3РО4 окислительные и восстановительные свойства не характерны. При обычной температуре в водных растворах Н3РО4 взаимодействует лишь с щелочами. При повышенных температурax и пониженных давлениях Н3РО4 реагирует со спиртами с образованием эфиров. Однако чаще всего эфиры Н3РО4 получают взаимодействием спиртов ROH с РОС13 или РС15.
Фосфорная кислота - важный полупродукт для производства удобрений, технических. реактивов, например, фосфатов аммония, натрия, кальция и т.д. Н3РО4 применяют в синтезе ряда органических продуктов, в производстве активированного угля, для создания на металлах защитных покрытий. Очищенная, или так называемая пищевая Н3РО4, применяется в производстве безалкогольных напитков, фармацевтических препаратов, для приготовления кормовых концентратов и т.д.
2.3 Модели ХТС
2.3.1 Химическая модель
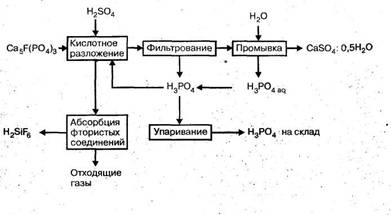
Разложение фосфата при избытке ионов кальция в растворе происходит с образованием фосфополугидрата и монокальцийфосфата (МКФ):
Са5(РО4)3F + 5H2SO4 + 2,5H2O ® 3H3PO4 + 5CaSO4×0,5H2O + HF
Са5(РО4)3F + 7H3PO4 ® 5Ca(H2PO4)2 + HF
Далее, при снижении содержания ионов кальция в фосфорной пульпе, идет взаимодействие МКФ с черной кислотой с перекристаллизацией крупнокристаллических форм полугидрата сульфата кальция:
5Ca(H2PO4)2 + H2SO4 + 0,5H2O ® CaSO4×0,5H2O + 3H3PO4
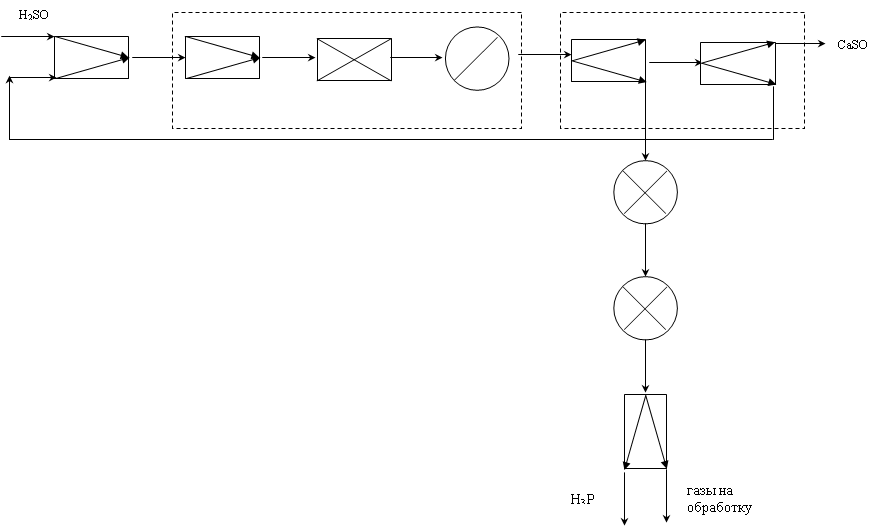
2.3.2 Функциональная модель
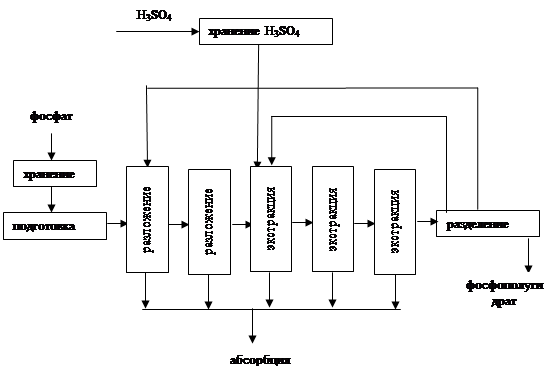
2.3.3 Структурная модель
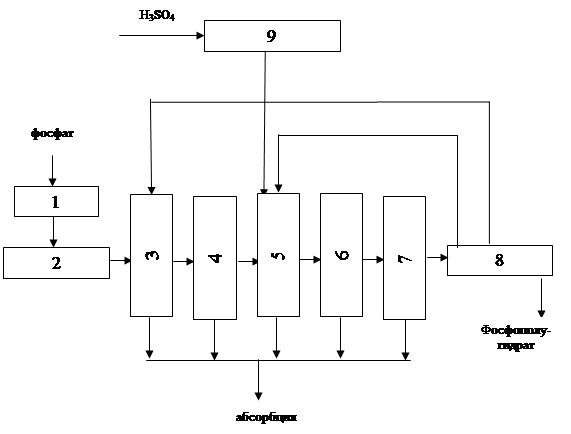
2.3.4 Операторная модель
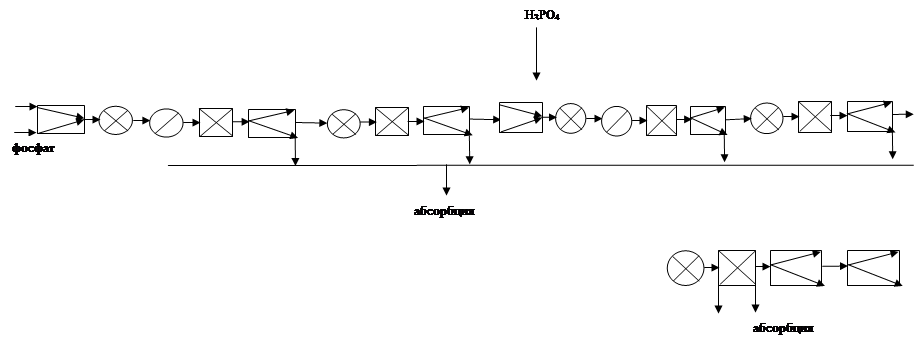
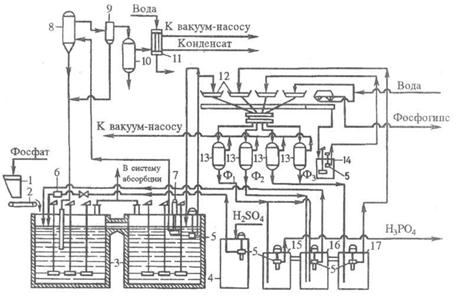
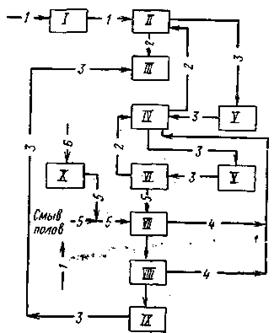
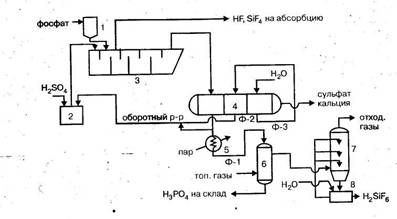
2.3.5 Технологическая схема
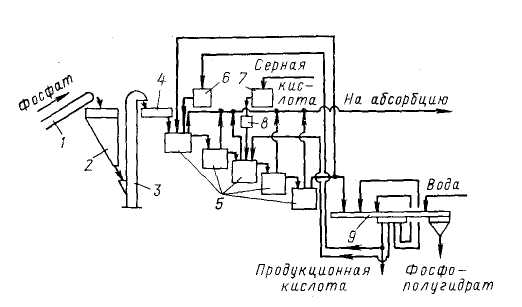
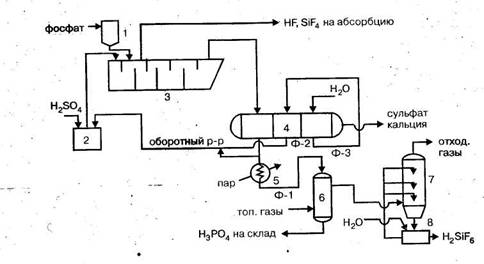
1 – ленточный конвейер; 2 – бункер; 3 – элеватор; 4 – весовой дозатор;
5 – экстракторы с мешалками; 6,7 – напорные баки; 8 – щелевой расходомер;
9 – карусельный вакуум-фильтр
В полугидратном процессе фосфатное сырье, фосфорная кислота и ретурная пульпа попадают в первый из двух каскадно расположенных реакторов 5 первой монокальцийфосфатной стадии процесса. В двух реакторах этой стадии при температуре 90-95°С в течение 1,2-1,7 ч фосфат разлагается 3,5-4,0 кратным (в расчете на образование Са(Н3РО4)2) избытком фосфорной кислоты. По истечении указанного времени на выходе из второго реактора коэффициент разложения фосфата достигает 98-99%.
В последующих трех реакторах 5 происходит экстракция фосфорной кислоты при взаимодействии вводимой в третий реактор серной кислоты и находящегося в пульпе монокальцийфосфата в присутствии второго фильтрата, поступающего с фильтра. Процесс идет очень быстро при температуре 95-100°С и при отсутствии в жидкой фазе свободной серной кислоты. Применение определенных способов подачи реагентов, способствующих минимизации возникающих в объеме реакционной пульпы градиентов температуры и концентраций, обеспечивает также минимальные значения величин пресыщения жидкой фазы по сульфату кальция. Такие меры позволяют выделять полугидрат в виде изометричных, близких к сферической форме кристаллов, сросшихся в агрегата диаметром до 100 мкм.
Пульпа, содержащая в жидкой фазе 45-50% Р2О5, делится на два потока: один (2/3 пульпы) возвращают в экстрактор, а второй (1/3 пульпы) направляют на разделение на карусельном вакуум-фильтре 9. Продукционную кислоту частично возвращают в процесс, осадок фосфополугидрата промывают водой противотоком.
Заключение
В данной курсовой работе рассмотрены методы получения экстракционной фосфорной кислоты. Наиболее перспективным является полугидратный способ получения фосфорной кислоты, так как дает возможность получения концентрированной фосфорной кислоты (35-37% Р2О5) и увеличение эффективности стадии фильтрации пульпы в 1,5-2 раза по сравнению с дигидратным способом.
В работе представлена характеристика исходного сырья и готовой продукции. Построены химическая, функциональная, структурная, операторная, технологическая модели ХТС по получению фосфорной кислоты.
Список использованной литературы
1. Кислотные методы переработки фосфатного сырья / Е.Л. Яхонтова, И.А. Петропавловский, В.Ф. Кармышов, И.А. Спиридонова. – М.: Химия, 1988. – 288 с.
2. Шуб Б.И. Перспективы развития полугидратного процесса получения экстракционной фосфорной кислоты / Б.И. Шуб, Э.В. Хлебодарова // Химическая промышленность. – 1999. - №11. – С.41-43.
3. Большая советская энциклопедия / под ред. А.Н. Прохорова. – М.: Советская энциклопедия, 1976. – Т.23.
4. Копылев В.Н. Технология экстракционной фосфорной кислоты / В.Н. Копылев. – М.: Химия, 1981. – 224 с.
Похожие работы
... технической поддержки компании “ИндаСофт” (телефон, электронная почта, личное присутствие) значительно облегчили процесс освоения и внедрения ПО iFIX. Все вопросы решались профессионально и оперативно [2]. ГЛАВА 3. Очистка сточных вод производства экстракционной фосфорной кислоты Замкнутый цикл воды в производстве экстракционной фосфорной кислоты Использование воды в замкнутом цикле в ...
... , разложением соляной кислотой - в преципитат. Сернокислотное разложение фосфатного сырья [в странах СНГ гл. обр. хибинского апатитового концентрата - основной метод получения экстракционной фосфорной кислоты, применяемой для производства концентрированных фосфорных и комплексных удобрений. Суть метода - извлечение (экстрагирование) P4O10 (обычно используют формулу P2O5) в виде H3PO4. По этому ...
... в электрофильтр 14. Сконденсировавшаяся в нем из тумана фосфорная кислота поступает в сборник 15, а отходящие газы выбрасываются в атмосферу. Рис. 4. Технологическая схема производства термической фосфорной кислоты двухстадийным методом: 1 - электропечь, 2 - бункер шихты, 3 - газоотсекатель, 4, 14 - электрофильтры, 5 -горячий конденсатор, 6 - холодный конденсатор, 7, 8 - сборник ...
... отходы образуются в процессе переработки нефти в виде кислых гудронов, нефтяных шламов, отработанных масел и др. ГЛАВА 3. ИЗВЛЕЧЕНИЕ КРЕМНЕФТОРИСТОВОДОРОДНОЙ КИСЛОТЫ ИЗ ПРОЦЕССА ПРОИЗВОДСТВА ФОСФОРНОЙ КИСЛОТЫ В процессе производства концентрированных фосфатных удобрений фосфорсодержащая руда подвергается экстракции раствором серной кислоты. Полученная разбавленная фосфорная кислота ...
0 комментариев