Навигация
1. Протолитические реакции
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе протона от одних реагирующих веществ к другим.
В основе этой классификации лежит протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например
CH3COOH + H2O = CH3COO- + H3O+
кислотаI основаниеI основаниеII кислотаII,
NH3 + H2O = NH4+ + OH-
основаниеI кислотаII кислотаII основаниеII.
К протолитическим реакциям относят реакции нейтрализации и гидролиза.
2. Окислительно-восстановительные реакции.
К таковым относят реакции, в которых реагирующие вещества обмениваются электронами, изменяя при этом степени окисления атомов элементов, входящих в состав реагирующих веществ. Например:
Zn + 2H+ → Zn2+ + H2↑,
FeS2 + 8HNO3(конц) = Fe(NO3)3 + 5NO↑ + 2H2SO4 + 2H2O.
3. Лиганднообменные реакции
К таковым относят реакции, в ходе которых происходит перенос электронной пары с образованием ковалентной связи по донорно-акцепторному механизму. Например:
Cu(NO3)2 + 4NH3 = [Cu(NH3)4](NO3)2,
Fe + 5CO = [Fe(CO)5],
Al(OH)3 + NaOH = [NaAl(OH)4].
Характерной особенностью лиганднообменных реакций является то, что образование новых соединений, называемых комплексными, происходит без изменения степени окисления.
4. Реакции атомно-молекулярного обмена.
К данному типу реакций относятся многие из изучаемых в органической химии реакций замещения, протекающие по радикальному, электрофильному или нуклеофильному механизму.
5. Обратимые и необратимые химические реакцииОбратимыми называют такие химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ.
Для обратимых реакций уравнение принято записывать следующим образом А + В АВ.
Две противоположно направленные стрелки указывают на то, что при одних и тех же условиях одновременно протекает как прямая, так и обратная реакция, например
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании
2КСlО3 → 2КСl + ЗО2↑,
или окисление глюкозы кислородом воздуха
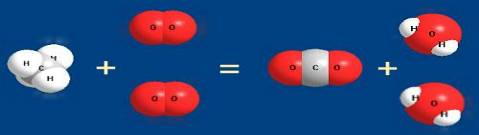
С6Н12О6 + 6О2 → 6СО2 + 6Н2О.
6. Знак теплового эффекта
Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом - выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом - поглощением энергии в форме теплоты (Q<0, ∆H>0):
N2 +О2 = 2NО - Q.
Такие реакции относят к термохимическим.
Заключение
Химическая реакция - это процесс превращения одних веществ в другие, отличающиеся от них по составу и (или) строению. При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
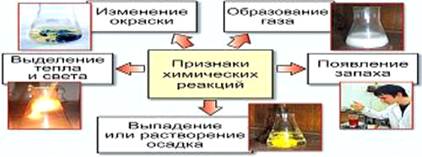
Признаки химических реакций: выделяется газ, выпадет осадок, происходит изменение окраски веществ, выделяется или поглощается тепло, свет и др.
Химические реакции записываются посредством химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Уравнение химической реакции - это представление химического процесса с помощью знаков, химических формул и коэффициентов перед ними.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки. В работе рассмотрена следующая классификация химических реакций.
I. По числу и составу исходных веществ и продуктов реакции:
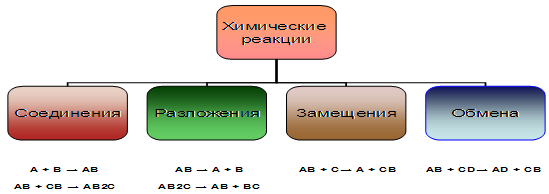
1) Реакции соединения - это реакции, в ходе которых из двух или нескольких веществ образуется одно вещество более сложного состава. Реакции соединения простых веществ всегда являются окислительно-восстановительными реакциями. В реакциях соединения могут участвовать и сложные вещества.
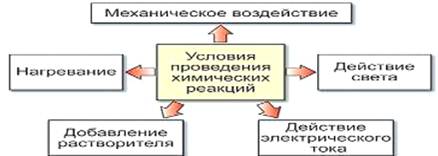
2) Реакции разложения - реакции, при протекании которых из одного сложного вещества образуются два или несколько более простых веществ. Продуктами разложения исходного вещества могут быть как простые, так и сложные вещества. Реакции разложения обычно протекают при нагревании веществ и являются эндотермическими реакциями. Как и реакции соединения, реакции разложения могут протекать с изменением или без изменения степеней окисления элементов;
3) Реакции замещения - это реакции между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества. В результате реакции замещения образуются новое простое и новое сложное вещество. Эти реакции почти всегда являются окислительно-восстановительными реакциями.
4) Реакции обмена - это реакции между двумя сложными веществами, молекулы которых обмениваются своими составными частями. Реакции обмена всегда протекают без переноса электронов, т. е. не являются окислительно-восстановительными реакциями. В результате реакций обмена обычно образуются: осадок, газ, слабый, электролит (вода).
II. По признаку изменения степени окисления
1) Реакции, которые идут без изменения степени окисления - реакции нейтрализации.
III. В зависимости от присутствия катализатора
1) Некаталитические (идут без присутствия катализатора)
2) Каталитические (идут с присутствием катализатора)
IV. По признаку теплового эффекта
1) Экзотермические (с выделением теплоты)
2) Эндотермические (с поглощением теплоты)
V. По признаку обратимости
1) Необратимые (протекают только в одном направлении)
2) Обратимые (протекающие одновременно в прямом и обратном направлении)
VI. По признаку однородности
1) Гомогенные (протекающие в однородной системе)
2) Гетерогенные (протекающие в неоднородной системе)
Список используемой литературы
1. Габриелян О.С. Химия. 11 класс: Учебник для общеобразовательных учреждений / О.С.Габриелян. - М.: Дрофа.- 304 с.
2. Иванова Р.Г. Химия. Учебник для 10 кл. общеобразовательных учреждений / Р.Г.Иванова, А.А.Каверина. – М.: Просвещение, 2001. – 287 с.
3. Кузнецова Н.Е. Химия. Учебник. 8 класс / Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара, А.Ю.Жегин М.: Вентана-Граф, 2005. – 224 с.
4. Мануйлов А.В. Основы химии. Электронный учебник / А.В.Мануйлов, В.И.Родионов. [Электронный ресурс]. Режим доступа: http://www.hemi.nsu.ru/
5. Химия. 8-9 класс: Поурочные планы / Авт. сост. С.Ю.Дибленко, Е.А.Смирнова, С.М.Колмыкова. – Волгоград: Учитель, 2005. – 169 с.
Похожие работы
... – реакции, идущие без изменения степени окисления: S+4O4-2 + H2O → H2+ S+4O4-2 CH3NH2 + HCl → (CH3NH3)Cl Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие. По признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения, реакции разложения, ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... . Реакция среды в этом случае зависит от соотношения констант диссоциации соответствующих основания и кислоты. Усилить гидролиз можно разбавлением раствора, нагреванием системы. 2. Химические реакции Химические реакции (химические явления) – это процессы, в результате которых одни вещества превращаются в другие. Признаками осуществления химических реакций являются: – изменение цвета; ...



0 комментариев