Навигация
Сорбция тяжелых металлов почвами
7 Сорбция тяжелых металлов почвами
В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции ТМ пользуются уравнением Фрейндлиха или уравнением Ленгмюра.
Эмпирическое уравнение Фрейндлиха имеет вид
Lg x/m =lg Kф +1/n lg C C = 1 + C
x/m Klb b
где х/m и С – концентрация ТМ в адсорбированном состоянии и в равновесном растворе соответственно. Кф и 1/n – константная и максимальная адсорбция ТМ в уравнении Ленгмюра [14].
Рисунок 10 - Изотерма адсорбции [14]
Процессы адсорбции элементов почвами и их компонентами в большинстве случаев удовлетворительно описывают уравнениями Ленгмюра и Фрейндлиха, позволяющее представить криволинейную экспериментальную зависимость между равновесной концентрацией и количеством сортированного элемента в линейной форме. Так, по мнению В.С.Горбатова [15] показатели сорбции ТМ определялись статистическим методом, который заключался в следующем: к серии навесок почвы приливали соли ТМ переменных концентраций (Pb от 0.02 – 9.65, Cd от 0.01 – 4.9,Zn от 0.02 – 15.25 ммоль/л) на фоне 0.0025 М раствора хлорида кальция. Отношение почва: раствор- 1:10, время взбалтывания на ротаторе – 2 часа при 250 градусах, время установления равновесия 24 ч. Суспензии центрифугировали при 10 тыс. об/мин, фильтровали и определяли концентрацию ТМ в равновесных растворах методом атомно-сорбционной спектрофотомерии. Количество металла, адсорбированного повой рассчитывали по разнице между добавленным количеством и содержащимся в растворе.
В исследованиях многих авторов [15] : Т.Е.Bastaи S. Kuo отмечается, что с увеличением почвенной кислотности способность почв адсорбировать ТМ снижается. Влияние кислотности на величину адсорбции обусловлено несколькими процессами, протекание которых зависит от реакции среды: гидролизом ТМ, изменением ЕКО, специфической адсорбцией ТМ на илистых частицах.
На адсорбцию сильно влияет органическое вещество почвы. Так адсорбции ТМ гумусом происходит с участием карбоксильных (-СООН) и фенольных (-ОН) групп, путем замещение водорода на ионы металла. При этом образуются хелаты, в которых металл входит в анионную часть молекул органического вещества. В этом случае металл соединен координационными (гомеополярными) связями и не проявляет себя как катион:
Комплекс также может металл в обмен на катион водорода во вне функциональных группах.
Следовательно металлы могут входить как в катионную так и в анионную частимолекул гумусовых кислот.
Использование логарифмической формулы Фрейндлиха для описания процессов адсорбции ТМ почвами также позволяет обнаружить на изотермах наличие двух и более контрастно адсорбции [15].
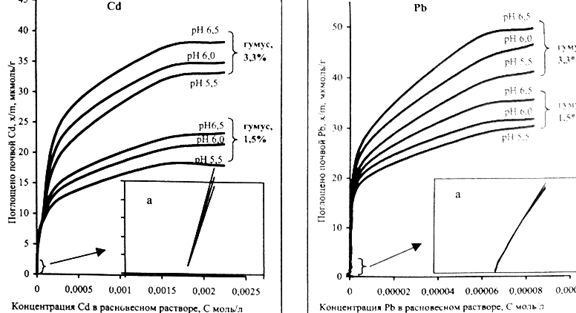
Рисунок 11- Изотермы адсорбции свинца дерново-подзолистой
почвы [15]
По мнению В.С.Горбатова [15] разделение изотерм адсорбции на два участка с энергетической гетерогенностью адсорбционных мест и указывает на наличие в почве двух и более групп обменных центров. Наличие нескольких групп обменных центров, обладающих не одинаковым сродством к тяжелым металлам, свидетельствует о, что часть катионов адсорбируется почвой специфически, а часть неспецефически. На эти процессы влияет кислотность почвы. Данные представлены в таблице 2. При низких концентрациях заполняются места с более высокой энергией связи, т. е имеет место специфическая адсорбция. С увеличением концентрации ТМ происходит неспецифическая адсорбция, заполняются места с более низкой энергией связи.
Таблица 2 - Влияние кислотности на специфическую адсорбцию ТМ дерново-подзолистой почвы (гумус 2.2%) [15]
| Кислотность почв | ЕКО смоль(+)/кг | Специфическая адсорбция Q смоль/кг | Q от EKO % |
| кадмий | |||
| 5 | 14.22 | 0.29 | 2.0 |
| 6 | 18.96 | 0.30 | 1.6 |
| 6.5 | 33.97 | 0.30 | 0.9 |
| свинец | |||
| 5.0 | 14.22 | 2.4 | 16.9 |
| 6.0 | 18.96 | 2.4 | 12.7 |
| 6.5 | 33.97 | 2.6 | 7.7 |
Содержание гумуса в большей степени влияет на специфическую адсорбцию, чем кислотность. Так с увеличением содержания в почве гумуса с 1.5- 3.3% наблюдается увеличение специфической адсорбции кадмия и цинка на 7-9%,а свинца на 12%. При этом доля максимального количества специфически поглощенных ТМ от ЕКО снижается. Данные представлены в таблице 3. Установлено, что специфическая адсорбция металлов в большей степени зависит от генетических особенностей почвы (гранулометрического и минерального состава, содержания полуторных гидроксидов Fe и Al Mn,чем от их агрохимических свойств. Было доказано, что максимальное количество элементов, адсорбируемых специфически, изменяется в ряду Pb2+, Zn2+, Cd2+ [14].
Свинец по сравнению с другими металлами в больших количествах поглощается и удерживается почвой. Отношение максимальной сорбции свинца к ЕКО находится в пределах 31-58%,в то время как для цинка и кадмия такой показатель равен 25-46 и 17-32% соответственно. Этим и объясняется малая подвижность в почве свинца. При этом с уменьшением кислотности и увеличением содержании гумуса максимальное количество поглощенных металлов, отнесенное к общему количеству ионов в ППК, способных к обмену, снижается, что может быть связано с возрастанием конкуренции за адсорбционные места в ППК [14].
Показано что поглощение свинца черноземом, серой-лесной и дерново-подзолистой почвой при рН 4.5 и 6 сопровождается вытеснением в раствор не только иона кальция, но и иона водорода, и представляет собой не бинарный, а трехкатионный ионный обмен. Этот обмен является обратимым процессом. При рН 6 и выше вступает в действие и начинает превалировать другой механизм поглощения Pb2+ - осаждение карбоната свинца. Поведение Pb2+ в почвах и его доступность растениям зависит от того, насколько прочно он связан и насколько легко может быть высвобожден в раствор под влиянием тех или иных воздействий.
Таблица 3 - Влияние кислотности и содержания гумуса на величину максимальной сорбции ТМ дерново-подзолистой почвы [14]
| Гумус % | pH почвы | ЕКO cмоль(+) | кадмий | свиней | ||
| Q смоль(+) на кг | Q в% от EKO | Q смоль(+)/кг | Q в%от EKO | |||
| 1.5 | 5.5 | 14.22 | 4.61 | 32.4 | 7.55 | 53 |
| 6.0 | 18.17 | 5.02 | 27.6 | 8,26 | 45,5 | |
| 6.5 | 24.49 | 5.11 | 20.9 | 8,89, | 36,3 | |
| 2.2 | 5.5 | 14.22 | 4.68 | 32.9 | 7,87 | 54,7 |
| 6.0 | 18.96 | 5.42 | 28.6 | 9,56 | 50,4 | |
| 6.5 | 33.97 | 5.74 | 16.9 | 10,64 | 31,3 | |
| 3.3 | 5.5 | 18.96 | 6.11 | 32.2 | 10,53 | 55,5 |
| 6.0 | 21.33 | 6.43 | 30.1 | 12,05 | 56,5 | |
| 6.5 | 34.76 | 6.75 | 19.4 | 13,51 | 38,3 | |
| 6.5 | 5.5 | 24.49 | 7.02 | 28.7 | 14,28 | 58,3 |
| 6.0 | 27.65 | 7.6 | 27.5 | 15,96 | 57,7 | |
| 6.5 | 39.5 | 8.1 | 20.3 | 20,2 | 53,0 | |
Поглощение Pb2+ существенно зависит от типа почв и возрастает с увеличением рН. При одинаковых условиях чернозем связывает больше Pb2+, чем серая, лесная и дерново-подзолистая почвы. Известно, что количество поглощенного Pb2+ может превышать величину емкости катионного обмена. Было установлено, что связывание Pb2+ сопровождалось выделением из почв в раствор не только иона кальция, но и иона водорода, а также выделением или поглощения небольшого количества иона калия,
Общий баланс катионов при поглощении Pb2+ при рН 5 , при концентрации раствора примерно до 0.6ммоль/л (содержание Pb2+ до 50ммоль/кг) [20].
SCa+SH+SK=0.83SPb
Где SCa SH SK - количество ионов ,SPb количество поглощенного свинца
При большей концентрации Pb2+ в растворе количество вытесняемых ионов кальция и Н+ в расчете на 1моль Pb2+ оказывается меньшим. При других значениях рН и для других почв поглощение свинца почвой также сопровождалось выделением в раствор как Ca2+так и Н+. Поскольку поглощение Рb2+ всеми рассмотренными почвами сопровождается выделением в раствор, как ионов кальция, так и Н+, можно утверждать, что процессе взаимодействия, происходит ионный обмен, но не бинарный, а трехкатионный [18].
Суммарное количество вытесненных катионов кальция Н+ и К+ при низких концентрациях Рb2+ при рН 4 и 5 близко к количеству поглощенного Рb2+ это свидетельствует в пользу механизма эквивалентного ионного обмена. С ростом рН количество вытесняемых ионов Н+ для всех почв уменьшается это, очевидно вызвано возрастанием заполнением ППК катионами Са2+, При высоких концентрациях рН суммарное количества ионов кальция водорода и калия ниже, чем количество поглощенного свинца [20].
Как правило, поглощение ТМ почвами сопровождается подкислением раствора. Хотя уменьшение рН имеет место и в водных растворах ТМ, при равновесии почвы с растворами ТМ наблюдается более значительное уменьшение рН раствора, т.е. дополнительный источник кислотности связан с адсорбцией ТМ почвой.
Подкисление равновесных растворов происходит счет:
1) выделение Н+ при гидролизе солей ТМ
2) вытеснение катионами ТМ обменного водорода (алюминия) из ППК
3) выделение протонов при специфической адсорбции ТМ глинистыми минералами, оксидами и гидрооксидами железа, алюминия, гумусовыми кислотами
Так гидролиз катионов ТМ в растворе можно записать:
Ме2+ + nН20 = Ме(ОН)м(Н2О)n-m + mH2O (m<n)
Обмен с участием гидролизованных форм ТМ
2Ме(ОН)+ + СаП2 =2Ме(ОН)П + Са2+
Обмен с участием свободных катионов.
Ме2+ + СаП2 = МеП2 + Са2+
Обмен с участием образовавшихся в результате гидролиза протонов
2Н+ + СаП2 = Са2+ + 2НП [17]
При этом протоны, которые образуются в ходе гидролиза также вступают в ионный обмен и частично выводятся из реакционной сферы. В результате поглощения почвой части выделавшейся в процессе гидролиза протонов реальное подкисление равновесных растворов в присутствии почв должно быть меньше, чем в их отсутствие (эффект чистого гидролиза селей ТМ в растворе в аналогичных условиях). В действительности контакт раствора содержащего ТМ, с почвой всегда усиливает подкисление ионообменной системы в целом. Из этого следует, что подкисление почвенных ионообменных систем не может быть связано только с гидролизом катионов и при малых концентрациях тяжелые металлы практически полностью поглощаются почвой. Специфическая адсорбция этих элементов почвами в большей степени зависит от гранулометрического состава почв, чем от их агрохимических свойств. Снижение кислотности и повышение содержания гумуса в почве способствует увеличению неспецефической и общей максимальной адсорбции ТМ и их закреплению в почвенное поглощающем комплексе [17].
0 комментариев