Навигация
Диференційована імунотерапія хронічного гломерулонефриту
АКАДЕМІЯ МЕДИЧНИХ НАУК УКРАЇНИ
Державна установа «Інститут нефрології»
Зуб Лілія Олексіївна
УДК 616.611-002-036.12-085:615.37
ДИФЕРЕНЦІЙОВАНА ІМУНОТЕРАПІЯ ХРОНІЧНОГО ГЛОМЕРУЛОНЕФРИТУ
14.01.37 – нефрологія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
доктора медичних наук
Київ – 2008
Дисертацією є рукопис
Робота виконана в ДУ «Інституті нефрології» АМН України ,
м. Київ.
Науковий консультант:
доктор медичних наук, професор,
Колесник Микола Олексійович,
ДУ «Інститут нефрології» АМН України, м. Київ, директор
Офіційні опоненти: доктор медичних наук, професор, Никула Тарас Денисович, Національний медичний університет ім. О.О. Богомольця МОЗ України, завідувач кафедри пропедевтики внутрішніх хвороб №2
доктор медичних наук, професор Лапчинська Інна Ігорівна, медичний радник ГСК, м.Київ
доктор медичних наук, професор Луньова Ганна Геннадіївна, Національна медична академія післядипломної освіти ім. П.Л. Шупика, завідувач кафедри клінічної лабораторної діагностики
Захист дисертації відбудеться 22.02.2008 р. о 12 годині на засіданні спеціалізованої вченої ради Д 26.565.01 при ДУ «Інститут нефрології» АМН України за адресою: 04053, м. Київ, вул. Ю. Коцюбинського 9А.
З дисертацією можна ознайомитись в бібліотеці Інституту нефрології АМН України за адресою: : 04053, м. Київ, вул. Ю. Коцюбинського 9А.
Автореферат розісланий 18.01.2008 р.
Вчений секретар
спеціалізованої вченої ради,
кандидат медичних наук,
провідний науковий співробітник
ДУ «Інститут нефрології» М.Б.Величко
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Актуальність проблеми вчасного та якісного лікування хронічного гломерулонефриту (ХГН) обумовлена зростанням поширеності даної патології, розширенням вікових меж, підвищенням резистентності до традиційної терапії. Зусилля клініцистів спрямовані насамперед на поглиблене вивчення патогенезу вищевказаної патології, покращення результатів лікування, гальмування темпів прогресування та віддалення розвитку хронічної ниркової недостатності (Колесник М.О., 2005; Никула Т.Д., 2005).
За останніми літературними даними, у розвитку та прогресуванні ХГН надають значення трьом основним механізмам: імунним, гемодинамічним та метаболічним. Однак, у його розвитку найбільше значення має перший з цих факторів. Раніше основна увага приділялась гуморальним факторам ушкодження – імунним комплексам, антитілам до базальної мембрани. Зараз їм надають значення скоріше в індукції процесу. У подальшому прогресуванні, поряд з активацією гуморальних імунних процесів, яка відбувається у частини хворих, провідну роль відводять медіаторам запалення – лімфоцитам, моноцитам, макрофагам, нейтрофілам, тромбоцитам, зокрема клітинам клубочка. За останні десять років стало очевидним, що первинним імунним механізмом розвитку нефропатій є ураження системи лімфопоезу, що проявляється проявом дефіциту та дисбалансу Т-клітинної ланки імунітету (Дранник Г.М., 2006; Паунова С.С., 2002; Рябов С.А., 2000).
На сьогодні відомо чимало робіт, в яких простежено особливості розвитку клінічних та морфологічних форм, результативність лікування й темпи прогресування імунних нефропатій (Колесник М.О., 2005; Дудар І.О., 2002; Бездітко Т.В., 2001; Дядик О.І., 2000; August Pb., 2003; Baer P.C., 2000; Brener B.M., 2003).
Залишаються проблемними питання, пов’язані з низькою результативністю терапії ХГН, неспинним розвитком склерозу ниркової тканини.
Успіх лікування будь-якого захворювання багато в чому залежить від корекції загальних та окремих ланок патогенезу, а також від можливості цілеспрямованої дії на них. Використання препаратів активної терапії у лікуванні хворих на ХГН з нефротичним синдромом (НС) (цитостатиків, глюкокортикоїдів) часто є неефективним та потребує подальшого вивчення дії цих препаратів та розробки диференційованих підходів до лікування різних морфологічних форм ХГН (Пиріг Л.А., 2004; Дудар І.О., 2002; Day C.J., 2002; Campana G., 2000; Cattran D.C., 2000; De Mattos A.M., 2000).
На даний час недостатньо вивчені фактори, що впливають на перебіг та прогноз ХГН. У зв’язку з цим виникає необхідність здійснювати пошук нових підходів до лікування даної патології. Визначення прогностичних критеріїв є надзвичайно актуальним, так як дозволить клініцисту проводити індивідуальний облік та корекцію в динаміці спостереження та лікування. Аналіз даних наукової літератури свідчить про те, що прогнозування є новим і недостатньо вивченим науковим напрямком в медицині (Бездітко Т.В., 2000; Ратнер М.Я., 2000; Laluck B.J. Jr., 2000; Fogo A.B., 2001; Kim Y.S., 2001; Martinez-Maldonado M., 2001; Massaguy J., 2002; Roberts I.S.D., 2004).
Перспективним, на наш погляд, є вивчення впливу дефіциту та дисбалансу у Т-клітинній ланці імунітету, що на сьогодні є доведеним фактом, на перебіг, прогноз та ефективність лікування ХГН.
Основою проведення даного дослідження є відсутність чіткої концепції прогресування ХГН та незначна кількість досліджень і безліч протиріч щодо вивчення проблеми неефективності імуносупресивної терапії даного захворювання.
Зв'язок роботи з науковими програмами, планами, темами. Дисертація виконана в Інституті нефрології АМН України як фрагмент науково–дослідної теми:”Вивчити роль факторів міжклітинної взаємодії у прогресуванні хронічного гломерулонефриту та діабетичної нефропатії”, номер держреєстрації 0107В000278, шифр МВ07. Дисертант є співвиконавцем даної НДР.
Мета і завдання дослідження. На основі вивчення особливостей механізмів прогресування розробити диференційовані підходи до імунотерапії різних морфологічних форм хронічного гломерулонефриту з нефротичним синдромом.
Відповідно до поставленої мети були визначені наступні завдання:
Дослідити стан клітинного імунітету та цитокінового профілю до призначення імунотерапії у хворих з різними морфологічними формами ХГН з НС;
Вивчити особливості характеру реакцій перекисного окислення ліпідів та антиоксидантного захисту у хворих з різними морфологічними формами ХГН з НС;
Дослідити особливості ферментурії та ферментемії холінестерази і гамма-глутаміл-транспептидази у хворих з різними морфологічними формами ХГН з НС;
Визначити ефективність преднізолону у хворих з різними морфологічними формами ХГН з НС;
Визначити ефективність застосування «пульсових» доз циклофосфану у хворих з різними морфологічними формами ХГН з НС;
Визначити ефективність застосування циклоспорину у хворих з різними морфологічними формами ХГН з НС;
Оцінити ефективність мікофенолату мофетилу у хворих з різними морфологічними формами ХГН з НС;
Оцінити прогностичне значення вмісту ІФН-г, ФНП-б, ТФР-в та ІЛ-10 при визначенні ефективності імунотерапії хворих з різними морфологічними формами ХГН з НС;
Оцінити прогностичне значення вмісту та співвідношень рецепторів контактної взаємодії (CD4+, CD8+, CD54+, CD95+) при визначенні ефективності імунотерапії хворих з різними морфологічними формами ХГН з НС;
Розробити та обґрунтувати оптимальний підхід до диференційованої імунотерапії ХГН з використанням сучасних засобів імуносупресії.
Об'єкт дослідження. Хворі на хронічний гломерулонефрит.
Предмет дослідження. Стан клітинного імунітету та цитокінового профілю: CD4+, CD8+, CD54+, CD95+, фактору некрозу пухлин-б (ФНП-б), інтерлейкіну-10 (ІЛ-10), а також інтерферону-г (ІФН-г), трансформуючого фактору росту-в (ТФР-в), показники біохімічного аналізу сироватки крові, стан про- та антиоксидантної системи захисту організму у хворих на ХГН в динаміці лікування із застосуванням глюкокортикоїдів (преднізолону), цитостатиків - циклофосфану (ЦФ), циклоспорину, мікофенолату мофетилу (ММФ), біопсійний матеріал нирок у хворих на ХГН з НС.
Методи дослідження. В роботі використані загальні клінічні методики, які включали вивчення анамнезу, об’єктивних даних, загальний аналіз крові та сечі, добовий діурез, добову протеїнурію, сеча за Нечипоренком, білковий та ліпідний спектр крові (загальний білок крові, загальний холестерин, ЛПНЩ). Функціональний стан нирок оцінювався дослідженням рівнів сечовини та креатиніну в крові та сечі, визначенням швидкості клубочкової фільтрації (ШКФ). З метою визначення продуктів пероксидації в біологічних рідинах та антиоксидантного захисту досліджено глутатіон відновлений (ГЛ-SH), глутатіон-s-трансфераза (Гл-s-тр.), малоновий диальдегід (МДА), дієнові кон’югати (ДК). Проведено дослідження реноспецифічних ферментів крові та сечі - холінестераза (ХЕ), гама-глутамілтранспептидаза (ГГТП). Загальний імунний статус визначено тестами І та ІІ рівнів. Визначалися вміст CD4+-, CD8+-, CD54+-, CD95+-клітин, IЛ-10, ІФН-г, ФНП-б, ТФР-в. З метою верифікації діагнозу визначали морфологічну форму ХГН, 219 хворим проведено прижиттєву транскутанну біопсію нирок. Морфологічні зміни, що виявлені на світлооптичному рівні, кваліфіковані за класифікацією Churg J. and Sobin L., (1982). Проведено математично-статистичну обробку отриманих даних з використанням програм EXCEL та BioStat.
Наукова новизна одержаних результатів. Вперше встановлено, що дисбаланс в системі Т-клітинного імунітету є характерною патологічною ознакою ХГН, що має різний ступінь вираженості та різну направленість залежно від морфологічної форми ХГН, віку хворих. Найвагоміше пригнічення CD4+-лімфоцитів відмічене у хворих з проліферативними морфологічними формами ХГН з НС, що найбільше проявилося у пацієнтів раннього періоду старості у порівнянні з іншими віковими групами.
Вперше виявлена залежність між рівнем ФНП-б та віком хворих; між рівнем ІФН-г та віком хворих; між рівнем ТФР-в та зростанням добової протеїнурії, ступенем вираженості гіпертензивного синдрому і рівнем ТФР-в, а також залежність вмісту ТФР-в крові від рівня клубочкової фільтрації.
Вперше доведено вірогідне зниження рівня ІФН-г та відповідне підвищення вмісту ІЛ-10 у крові хворих з проліферативними морфологічними формами ХГН з НС в динаміці лікування з урахуванням значення коефіцієнта їх співвідношення К<1 при настанні повної клініко-лабораторної ремісії (ПКЛР) та відсутності рецидивів НС протягом 1 року. У пацієнтів з частими рецидивами НС відмічене К>1, що реєструвалося на 3-му та 6-му місяцях імунотерапії.
Набуло подальшого розвитку вивчення динаміки ПОЛ та системи АОЗ у хворих на ХГН. Встановлено пригнічення АОЗ та активацію ПОЛ під дією терапії із застосуванням глюкокортикоїдів і цитостатиків.
Вперше встановлено, що підвищення вмісту ХЕ в сечі та зниження у крові рівнів ХЕ та ГГТП характеризує активність патологічного процесу в нирках у хворих на ХГН з НС, що найінтенсивніше проявляється у хворих з непроліферативними морфологічними формами ХГН.
Вперше виявлено, що статини сприяють стабілізації рівня ТФР-в і знижують вміст МДА крові у хворих на ХГН з НС.
Вперше встановлено нову складову механізму дії ММФ, що реалізується через зниження рівня ТФР-в крові хворих на ХГН з НС.
Практичне значення отриманих результатів. Практичне значення результатів роботи полягає у виявленні критеріїв прогнозування ефективності лікування проліферативних та непроліферативних морфологічних форм ХГН та нових підходів до диференційованого застосування імуносупресивної терапії у хворих на ХГН з НС.
Продемонстровано неоднотипні закономірності дисбалансу Т-клітинного імунітету та цитокінового профілю у пацієнтів з проліферативними та непроліферативними морфологічними формами ХГН з НС. Виділено найбільш важливі фактори клітинного імунітету (CD4, CD8, CD54, CD95), дисбаланс яких відіграє важливу роль у прогресуванні ХГН та є причиною неєфективності терапії.
Встановлено критерії прогнозу ефективності імунотерапії проліферативних морфологічних форм ХГН: відсутність стійкої АГ, вік до 40 років; зростання рівнів CD4+-, CD54+-, зниження рівня CD95+-клітин, значення К (ІФН-г/ІЛ-10<1) (Патент України на корисну модель №22358, МПК (2006) GO1N 33/53).
Встановлено критерії прогнозу ефективності імунотерапії непроліферативних морфологічних форм ХГН: відсутність стійкої АГ, вік до 40 років; зростання рівня ІФН-г, зниження рівня ТФР-в.
Визначено необхідність індивідуального підходу до вибору імуносупресивної терапії на базі комплексної оцінки клінічних, імунних, морфологічних та вікових особливостей ХГН з НС.
Результати досліджень запроваджені в клініці ДУ «Інститут нефрології», в практику роботи нефрологічних та терапевтичних відділень обласних, міських та районних лікарень Чернівецької, Івано-Франківської, Полтавської, областей України, а також у навчальний процес кафедри внутрішньої медицини, фізіотерапії та інфекційних хвороб Буковинського медичного університету та кафедри поліклінічної і сімейної медицини Вінницького медичного університету(лекції та практичні заняття).
Положення дисертації викладено на 12 конгресах, конференціях спеціалістів України, ближнього та далекого зарубіжжя, двох засіданнях Чернівецького обласного товариства терапевтів. За матеріалами дисертації отримано патент України на винахід.
Особистий внесок здобувача. Дисертаційна робота є самостійним завершеним науковим дослідженням, що виконане на базі ДУ «Інститут нефрології АМН України» та Буковинського державного медичного університету. Автор самостійно обрала тему наукової роботи, опрацювала дані літератури, визначила мету і завдання, розробила дизайн дослідження, забезпечила організацію та проведення набору матеріалу. Особисто розроблена схема спеціального дослідження, що відповідає меті та завданням дисертації. Створено критерії оцінки ефективності терапії проліферативних та непроліферативних морфологічних форм ХГН, оцінено клінічну ефективність та розроблено новий диференційований підхід до імунотерапії хворих на ХГН з НС. Проведено аналіз, статистичну обробку результатів клінічного дослідження, теоретично узагальнено отримані результати. На основі положень дисертації побудовано відповідні висновки та рекомендації, підготовлений рукопис дисертації. Основні результати досліджень самостійно опубліковані та викладені автором на конгресах, семінарах, конференціях, симпозиумах спеціалістів. В загальних публікаціях та винаході 90% ідей та 70% розробок належить автору.
Апробація результатів дисертації. Основні наукові положення, висновки та практичні рекомендації дисертаційної роботи доповідалися та обговорювалися на 85-й підсумковій науковій конференції Буковинської державної медичної академії (Чернівці, 2005); щорічній нефрологічній конференції «Білі ночі» (Росія, С.-Петербург, 2005); науково-практичній конференції «Актуальні питання фізіо- та фітотерапії в нефрології» (Чернівці, 2004); VІІ науково-практичній конференції «Актуальні питання клінічної, лабораторної імунології та алергології» (Київ, 2005); Всеукраїнській науково-практичній конференції «Сучасні проблеми терапії: від гіпотез до фактів» (Вінниця, 2005); науково-практичній конференції «Актуальні питання діагностики та лікування захворювань нирок» (Донецьк, 2005); International Disease Management Simposium (Bulgaria, Varna, May, 2006); VІІ міждисциплінарній науково-практичній конференції «Епідеміологія, імунопатогенез, діагностика та лікування імунопатологій, хламідіозу та TORCH-інфекцій» (Київ, 2006); VІІІ науково-практичній конференції «З актуальних питань клінічної і лабораторної імунології, алергології та імунореабілітації» (Київ, 2006); ІХ Українській науково-практичній конференції з актуальних питань клінічної і лабораторної імунології, алергології та імунореабілітації (Київ, 2007); Всеукраїнській науково-практичній конференції, присвяченій 100-річчю з дня народження професора Шинкермана Н.М. (засновника кафедри та патологоанатомічної служби на Буковині) «Патологічна діагностика хвороб людини: здобутки, проблеми, перспективи» (Чернівці, 2007).
Публікації. Матеріали дисертації опубліковано у 30 наукових працях, в тому числі, 20 статей в журналах та збірниках, затверджених ВАК України (одноосібних - 9), 10 – в інших журналах та матеріалах конгресів та симпозиумів.
Структура та обсяг дисертації. Дисертаційна робота викладена на 341 сторінці, складається з вступу, огляду літератури, розділу “Матеріали та методи досліджень”, вісьми розділів власних досліджень, аналізу та обговорення отриманих результатів, висновків, практичних рекомендацій та списку літератури.
Робота ілюстрована 41 таблицею, 59 рисунками та 12 кольоровими фотографіями морфологічного матеріалу. Список використаної автором літератури складається з найменувань 450 джерел (179 кирилицею та 271 латиницею). Робота доповнена трьома додатками.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Характеристика методів дослідження. Клінічний матеріал дисертації базується на аналізі історій хвороб пацієнтів, які лікувались у клініці Інституту нефрології АМН України та у нефрологічному відділенні обласної клінічної лікарні м. Чернівці у період 2000-2007 р.р., а також даних виконаних досліджень та робіт in vitro. Під спостереженням знаходилось 264 хворих на ХГН, з них 239 з наявністю НС.
Верифікація діагнозу проводилась за допомогою загальноприйнятих методів обстеження хворих. Вивчалися дані анамнезу, клінічні аналізи крові та сечі, добовий діурез, рівень протеїнурії, гематурії, ШКФ, білковий спектр крові, ліпіди, дані імунологічних досліджень. За вираженістю розрізняли мінімальну, помірну та значну протеїнурію при добових втратах білка відповідно до 1 г, від 1 до 3 г та більше 3 г.
Наявність хронічної хвороби нирок встановлювали згідно класифікації, прийнятій 2-м з’їздом нефрологів України (24 вересня 2005 р., м. Харків). Наявність та ступінь вираженості артеріальної гіпертензії встановлювали відповідно до рекомендацій ВООЗ та Міжнародної асоціації гіпертензії (1999 р.).
Забір крові для біохімічних досліджень проводився вранці натще після 12-годинного голодування з ліктьової вени хворого, в положенні сидячи протягом не менше 5 хвилин.
Вміст загального білка у сироватці крові визначали біуретовим методом, альбуміну – фотометричним, білкових фракцій – шляхом электрофоретичного фракціювання.
Визначення азотистих низькомолекулярних речовин або азотистих небілкових компонентів у сироватці крові проводили таким чином: сечовину визначали прямим фотометричним методом; креатинін – за кольоровою реакцією Яффе (метод Поппера).
Вміст загального холестерину досліджували методом Ілька з використанням оцтового ангідриду.
За рекомендаціями Національної Освітньої Програми по Холестерину США по визначенню рівня холестерину крові та проведенню популяційного скринінгу холестерину, рівні загального холестерину сироватки вважали нормальними при значеннях його менше 5,2 ммоль/л, незначно підвищеними – від 5,2 до 6,5 ммоль/л та високими – більше 6,5 ммоль/л. Наявність гіпо- та диспротеїнемії встановлювали відповідно при наявності рівнів загального білка крові менше 60 г/л, альбуміну сироватки крові менше 50 % та значеннях альбуміно-глобулінового (А/Г) коефіцієнту менш, як 1,0.
Черезшкірна біопсія нирки проводилась за загальноприйнятою методикою. Біопсійний матеріал вивчали за допомогою світлооптичних, імунофлюоресцентних методів, а в окремих випадках (для морфологічного уточнення діагнозу) проводили електронно-мікроскопічні дослідження.
Всі дослідження було проведено у динаміці 4 рази: до лікування, через 3, 6 місяців та після закінчення застосування імуносупресантів.
У зв’язку з тим, що хворим при відсутності ефекту від глюкокортикоїдів призначались циклофосфан, циклоспорин, або ММФ в комплексі з малими чи середньотерапевтичними дозами преднізолону, або шляхом самостійного прийому та можливими змінами у хворих методів імуносупресії у зв’язку з їх неефективністю, кількість спостережень, що оцінювали ефективність методів терапії перевищувала загальну кількість пацієнтів, що отримували терапію.
Оцінку клітинної ланки імунітету проводили за допомогою моноклональних антитіл (МКА) до диференціювальних антигенів лімфоцитів, CD4+, CD8+, CD54+, CD95+. Рівень ІФН-г, ІЛ-10, ТФР-в, ФНП-б у сироватці крові визначали за допомогою імуноферментного аналізу, використовували тест-системи «Diaclone» (Франція) і TRG (США).
Інтенсивність кінцевих продуктів вільнорадикального окислення оцінювали шляхом спектрофотометричного визначення вмісту МДА в крові та сечі за модифікованим методом Н.Д Стальної (1972). Визначення ГЛ-SH проводилось з використанням реактиву Еллмана. Активність Гл-s-тр. Визначали за методикою Власової С.Н., Шабуніної Є.І. (1990).
Статистична обробка отриманих даних проведена на персональному комп’ютері IBM PC на базі процесора Intel Celeron 2200, з використанням пакету прикладних програм для проведення медико-біологічних досліджень «BioStat». Рандомізація здійснена шляхом централізованого комп’ютерного розподілу груп за даними клінічного спостереження.
Всі цифрові показники, одержані під час досліджень, оброблялися методом варіаційної статистики з використанням критерію Ст`юдента-Фішера. Вивчення взаємозв’язків отриманих даних проведено із застосуванням кореляційного аналізу. Для визначення критеріїв ефективності імунотерапії проліферативних та непроліферативних морфологічних варіантів ХГН здійснено покроковий множинний лінійний регресійний аналіз та аналіз хі-квадрат Пірсона. Виведено коефіцієнт прогнозу ефективності імуносупресивної терапії (К).
Розподіл хворих здійснено за клінічними (згідно класифікації, прийнятій 2-м з’їздом нефрологів України 24 вересня 2005 р., м. Харків) та морфологічними (згідно класифікації первинних гломерулярних хвороб за Churg J. And Sobin I., 1982) формами ХГН. НС діагностували на основі таких критеріїв (добова протеїнурія ≥ 3,5 г/л; гіпопротеїнемія; диспротеїнемія; гіперхолестеринемія; набряки).
Морфологічний діагноз підтверджений у 219 осіб з НС, з них у 61 виявлено мезангіопроліферативний гломерулонефрит (МезПГН), у 37 – мембранозно-проліферативний гломерулонефрит (МПГН), у 39 – мінімальні зміни (МЗ), у 33 – мембранозна нефропатія (МН), у 49 – фокально-сегментарний гломерулосклероз (ФСГС).
За умов нерівномірного розподілу хворих за морфологічними формами ХГН, пацієнтів було розподілено на 2 групи, що визначили хворих з проліферативними та непроліферативними морфологічними формами ХГН. Такий розподіл узгоджується з даними літературних джерел, в яких запропоновано виділяти проліферативні та непроліферативні форми ХГН.
Розподіл хворих за віком проводився згідно з розподілом за віковими групами Американської асоціації лікарів.
З метою проведення порівняльної характеристики було досліджено групу здорових осіб (100 донорів) віком від 20 до 55 років.
Комплексне клініко-лабораторне обстеження виконано в періоді розгорнутих клінічних проявів (до призначення лікування), через 3 та 6 місяців під час проведення терапії. Результати дослідження співставлені з даними обстеження здорових осіб. Лікування проводили у відповідності з існуючими принципами терапії ХГН. Всім хворим з наявністю НС призначали терапію глюкокортикоїдами, яка при документованій частковій чи повній гормонорезистентності доповнювалася цитостатиками. Преднізолон призначали у дозі 1 мг/кг/добу у хворих з МЗ протягом 12-16 тижнів, у пацієнтів з ФСГС та МН – протягом 8-12 тижнів, у хворих з МезПГН та МПГН – не менш як 8 тижнів до початку відміни препарату. Потім пацієнтам, у яких не було досягнуто ПКЛР застосовували пульс-терапію ЦФ з розрахунку 0,75 г/мІ площі тіла 1 раз на місяць протягом 6 місяців. Пацієнтам, що були резистентними до терапії ЦФ, або тим, у кого виникли ускладнення даної терапії, припиняли подальше уведення ЦФ. Таким хворим у подальшому проводили лікування циклоспорином (5 мг/кг/добу) протягом 6 місяців, або ММФ (2 г/добу) також протягом 6 місяців. Препарати цитостатичної дії призначалися як самостійно, так і у комплексі з малими або середньотерапевтичними дозами (10-30 мг/добу) преднізолону. В результаті цього оцінка ефективності терапії проводилась в залежності від методу прийому активної терапії, що було розподілено таким чином: преднізолон; ЦФ; ЦФ + преднізолон; циклоспорин; циклоспорин+преднізолон; ММФ; ММФ + преднізолон .
За наслідками лікування пацієнтів розподілено на 3 групи:
- повна клініко-лабораторна ремісія (ПКЛР) - зникнення набряків, зникнення протеїнурії, нормалізація протеїнограми, ШКФ та артеріального тиску (АТ);
- часткова клініко-лабораторна ремісія (ЧКЛР) – зникнення набряків, зниження рівня протеїнурії < 3,5 г/добу, нормалізація протеїнограми, ШКФ та АТ;
- відсутність ефекту – відсутність достовірних змін.
Аналіз відносної кількості клітин, що несуть рецептори контактної взаємодії, показав достовірне зниження CD4+- та підвищення CD8+-лімфоцитів у хворих на ХГН з нефротичним синдромом як в порівнянні з нормою, так і з хворими на ХГН без наявності НС. У хворих на ХГН з нефротичним синдромом спостерігалося посилення експресії проапоптотичних маркерів CD95+ на лімфоцитах периферичної крові. Експресія CD95+ на лімфоцитах периферичної крові може бути додатковим критерієм у діагностиці прогресування ХГН, що характеризує ступінь активації імунокомпетентних клітин і, відповідно, вираженості імунних зрушень. Зростання експресії CD95+, імовірно, вказує на посилення ризику неконтрольованого апоптозу лімфоцитів. Цей процес стає більш помітним при прогресуванні ХГН, тобто збільшення вмісту CD95+-клітин у хворих на ХГН з НС стає вірогідним у порівнянні з показниками вмісту CD95+-клітин у групі хворих без наявності НС.
Результати дослідження вмісту рецепторів контактної взаємодії у крові хворих з різними морфологічними формами ХГН представлені у таблиці 1. Як видно з таблиці, найменш виражені відхилення від норми спостерігалися у хворих з МЗ, але рівень CD95+ був вірогідно підвищеним навіть у цих хворих. У решти пацієнтів вміст CD95+ значно зростав у порівнянні з нормою (р<0,05 ), але його рівень у пацієнтів з ФСГС та МН був вірогідно нижчим, ніж у хворих з МЗ (р < 0,05).
Концентрація лімфоцитів з маркерами CD54+ значно підвищувалася у хворих з проліферативними морфологічними формами ХГН (МезПГН, МПГН) у порівнянні з нормою та з пацієнтами, що мали МЗ (р<0,05), а у хворих з ФСГС та МН рівень CD54+-клітин був вірогідно зниженим по відношенню до норми та показників осіб з МЗ (р<0,05).
При дослідженні вмісту CD8+-клітин виявлено вагоме зростання його у всіх хворих, окрім пацієнтів з МЗ у порівнянні з нормою. Тут рівень CD8+-клітин був вірогідно нижчим у порівнянні з показниками всіх решти пацієнтів (р < 0,05).
Таблиця 1
Вміст лімфоцитів з рецепторами контактної взаємодії у крові хворих з різними морфологічними формами ХГН
| Хворі на ХГН | Показники | |||
| CD4(%) | CD8(%) | CD54(%) | CD95(%) | |
| Здорові n=55 | 30,22±0,41 | 19,13±0,52 | 18,50±0,85 | 11,91±1, 12 |
| МЗ n=21 | 29,92±1,63 | 19,11±1,67 | 19,11±1,22 | 19,22±1,41* |
| МезПГН n=45 | 26,05±1,44*^ | 23,93±1,41*^ | 25,12±2,14*^ | 20,22±2,40* |
| МПГН n=25 | 26,14±1,33*^ | 22,71±0,12*^ | 22,15±1,52* | 22,04±1,51* |
| МН (n=21) | 28,92±2,41 | 22,83±1,21*^ | 14,33±2,82*^ | 15,28±1,25*^ |
| ФСГС n=35 | 28,69±2,25 | 22,95±1,24*^ | 14,22±2,83*^ | 16,82±1,32*^ |
* - р < 0,05 у порівнянні з групою здорових осіб
^ - p < 0,05 у порівнянні з показниками пацієнтів з МЗ
Показники вмісту CD4+-клітин були значно зниженими у всіх пацієнтів з проліферативними морфологічними формами ХГН у порівнянні з нормою (р < 0,05), у решти хворих, які мали непроліферативні морфологічні варіанти ХГН показники CD4+ вірогідно не відрізнялися (р>0,05).
Звертають на себе увагу різнонаправлені зміни рівнів досліджуваних CD-маркерів у пацієнтів з різними морфологічними формами ХГН. Так, у хворих з мінімальними змінами спостерігалися найменш виражені порушення, однак рівень проапоптотичного маркеру CD95+ був значно підвищеним, що, імовірно, вказує на посилення ризику апоптозу лімфоцитів. Решта активаційних маркерів у хворих з мінімальними змінами залишалися близькими до норми, що характеризує найменший ступінь вираженості імунних зрушень у даної групи пацієнтів. Зниження вмісту CD4+-клітин у всіх хворих з проліферативними морфологічними варіантами ХГН, вказує на дефіцит диференційованої хелперної ланки Т-клітинного імунітету, що є загрозою порушення балансу синтезу прозапальних та протизапальних цитокінів. Це може спровокувати прискорення прогресування ХГН. У хворих з ФСГС та МН знижені рівні CD54+- та CD95+-клітин можуть вказувати на низьку активність імунозапальних процесів в нирках що, на нашу думку, передбачає абсолютно інший механізм розвитку патологічного процесу в нирках.
Посилення експресії CD54+ у хворих з МезПГН та МПГН вказує на збереження компенсаторних можливостей Т-клітинного імунітету та наявність лімфоцитарної активації, а зниження цього показника при зниженні вмісту CD4+-клітин у даних пацієнтів підтверджує масивний дисбаланс в системі клітинного імунітету та його виснаження, що буде мати негативний прогноз щодо перебігу та лікування ХГН без відповідної корекції імунних зрушень. Збільшення концентрації CD95+-клітин вказує на можливість посилення апоптотичних процесів, що при наявності активного імунного запалення з підвищеним рівнем CD8+- та CD54+-клітин може бути позитивною ознакою.
Враховуючи зміни, виявлені при дослідженні показників клітинного імунітету у пацієнтів різного віку, великий інтерес представляла характеристика показників CD-маркерів лімфоцитів у хворих різного віку, що відрізнялися за морфологічними формами ХГН. Так, було досліджено вміст рецепторів контактної взаємодії в осіб різного віку з наявністю проліферативних та непроліферативних морфологічних форм ХГН. Аналіз результатів показав, що у хворих з непроліферативними морфологічними формами ХГН вміст CD4+-клітин незалежно від віку зберігався високим і вірогідно знижувався у порівнянні з нормою тільки у пацієнтів раннього періоду старості (28,48±0,44%) (р<0,05). Отже, зниження рівня CD4+-клітин у даному випадку не вказує на активність імунного запалення, а тільки на зниження резервних можливостей організму у пацієнтів цієї вікової групи. Підтвердженням цьому є відповідне зниження вмісту CD54+-клітин (16,02±0,11 у порівнянні з нормою 18,50±0,15%) (р<0,05) у даної вікової категорії хворих, чого не можна сказати про активність проапоптотичного фактора CD95 (15,11±0,99), яка є значно підвищеною у порівнянні з нормою (11,91±1, 12%), але вірогідно знижена у порівнянні з даними всіх інших вікових груп хворих (р<0,05).
Характеристика вмісту CD-маркерів лімфоцитів у хворих з проліферативними морфологічними формами ХГН з НС продемонструвала у всіх пацієнтів вірогідно знижений вміст СD4+-клітин, що особливо проявилося у хворих раннього періоду старості (24,6±0,18% у порівнянні з нормою 30,22±0,11%) (р<0,05). Вміст CD8+-клітин вірогідно нижчий за норму у пацієнтів раннього періоду старості відповідно (15,44±0,17 у порівнянні з нормою 19,13±0,12%) (р<0,05). Враховуючи високі значення цього показника в усіх інших вікових групах хворих, можна припустити, що це зниження обумовлено поганою адаптаційною здатністю організму у хворих цього віку. Рівень CD54+-клітин, на відміну від групи хворих з непроліферативними формами ХГН, у всіх пацієнтів значно підвищений за виключенням хворих найстаршої вікової групи (10,98±0,19 у порівнянні з нормою 18,50±0,15%) (р<0,05), що підтверджує послаблення відновлюючої здатності організму, а в даному випадку Т-клітинної ланки імунітету у даному віці. Отже, у результаті проведених досліджень нами виявлено значне зниження адаптаційної здатності Т-клітинної ланки імунітету у хворих на ХГН раннього періоду старості, що однаково стосується обох виділених нами морфологічних груп із збереженням особливостей імунних процесів у кожній з них.
Виявлені зміни клітинного імунітету у хворих різного віку повинні бути враховані при прогнозуванні перебігу ХГН та виборі оптимальної стратегії фармакотерапії з обов’язковим включенням корекції імунних зрушень. У хворих середнього віку та раннього періоду старості оптимальним було б дослідження CD4-маркерів лімфоцитів периферичної крові з метою передбачуваних грубих зрушень у Т-клітинній ланці імунітету, внаслідок можливого призначення імуносупресивної терапії.
Результати проведеного дослідження дозволили не тільки виявити важливу роль активаційних антигенів лімфоцитів периферичної крові у патогенезі ХГН, але і констатувати відмінності їх дисбалансу у хворих з різними морфологічними формами ХГН, що спонукає до розробки методів диференційованого лікування різних морфологічних форм ХГН з урахуванням виявлених імунних порушень.
Враховуючи те, що гломерулонефрити є різнорідною за морфологією групою ниркової патології, при якій переважно вражається клубочковий апарат, а зміни канальців та строми є вторинними, а також беручи до уваги визначну роль цитокінів в репарації структур ниркового клубочка, клітинній проліферації, синтезі та утилізації екстрацелюлярного матриксу, важливим кроком на шляху до розробки методів впливу на характер прогресування ХГН вважаємо вивчення цитокінового профілю у хворих з різними морфологічними формами ХГН.
Результати проведених досліджень виявили виражене зростання у порівнянні з нормою вихідних значень показників ІФН-г у хворих з МезПГН та МПГН (р < 0,05). Рівень ІЛ-10 був значно зниженим у всіх хворих, але вірогідно вищим у осіб з МЗ, МН та ФСГС, ніж у хворих з проліферативними формами ХГН з НС (р<0,05). Оцінка рівнів ТФР-в і ФНП-б у хворих на ХГН з НС виявила, що вміст ТФР-в підвищувався у порівнянні з нормою до значно високих цифр у пацієнтів з ФСГС (р<0,05), що значно перевищувало його показники у хворих з іншими морфологічними формами ХГН. Значне підвищення цього показника спостерігалося у пацієнтів з МН (р<0,05) (таблиця 2).
Отже, результати досліджень виявили активну участь прозапальних та протизапальних цитокінів у розвитку імунного гломерулярного запалення у хворих з проліферативними морфологічними формами ХГН з НС.
Досліджено вміст ІФН-г, ФНП-б, ТФР-в та ІЛ-10 в осіб різного віку з наявністю проліферативних та непроліферативних морфологічних форм ХГН. У хворих з непроліферативними морфологічними формами ХГН не виявлено проявів активних імунозапальних процесів, що проявили б себе вираженим підвищенням вмісту прозапальних цитокінів. Отже, вміст ІФН-г та ФНП-б незначно відрізнялися від даних показників у хворих, що не мали НС (р>0,05).
Таблиця 2
Характеристика цитокінового профілю крові хворих з різними морфологічними формами ХГН з НС(М±m, n)
| Групи обстежених | Показники (пг/мл) | |||
| ІФН-г | ІЛ-10 | ТФР-в | ФНП-б | |
| Здорові n=30 | 20,2±5,50 | 200,1+9,40 | 56,5+7,81 | 47,5+8,24 |
| МЗ n=21 | 31,5±4,72* | 99,72±5,95* | 79,9±8,12** | 99,7±7,8* |
| МезПГН n=35 | 87,8±5,51** | 62,4±4,22** | 95,6±6,45** | 189,9±7,1** |
| МПГН n=25 | 92,3±4,43** | 75,8±6,13** | 98,7±7,28** | 172,3±8,0** |
| МН (n=21) | 33,8±5,44 | 178,5±9,12* | 113,4±8,92* | 79,8±8,5* |
| ФСГС n=35 | 33,5±5,83 | 98,9±6,94* | 123,7±8,33* | 77,9±8,43* |
* - р < 0,05 у порівнянні з групою здорових осіб
** - р < 0,05 у порівнянні з ФСГС та МН
Вміст ІЛ-10 був значно зниженим у порівнянні з нормою, але вірогідно відрізнявся від значень цих показників у пацієнтів з проліферативними морфологічними формами ХГН (р<0,05). Лише ТФР-в у даних хворих сягав високих цифр, особливо у пацієнтів раннього періоду старості і хворих середнього віку (відповідно 121,1±7,88 пг/мл та 123±8,32 пг/мл). Отже, у хворих старших вікових груп значно підвищений вміст ТФР-в при наявності непроліферативних процесів в нирках може спричиняти прискорення розвитку склеротичних процесів в нирках.
У хворих з проліферативними морфологічними формами ХГН з НС визначалося вірогідне підвищення у порівнянні з нормою активності прозапальних цитокінів ІФН-г та ФНП-б, вміст яких був зниженим тільки у пацієнтів юного віку (відповідно 89,9±5,50 пг/мл при нормі 20,2±5,55 пг/мл та 172,3±3,11 пг/мл при нормі 47,5±3,12 пг/мл).
Це може вказувати на недосконалість адаптаційних імунних реакцій у пацієнтів юного віку. Концентрація ІЛ-10 значно знижена у всіх хворих з проліферативними процесами в нирках, але найбільше у найстаршої вікової групи (62,7±5,01 пг/мл при нормі 200,1±12,11)(р<0,01), що підтверджує вищевказане припущення. Показники ТФР-в вірогідно підвищені у порівнянні з нормою, що може вказувати на наявність активних проліферативних процесів, внаслідок підвищеного апоптозу при проліферативних процесах в нирках. Найбільше проявилося зростання ТФР-в у групі хворих раннього періоду старості (112,1±8,12 пг/мл), що потрібно враховувати при плануванні імунотропної терапії таким хворим у плані ризику прискорення процесів склерозування в нирках.
Таким чином, звертають на себе увагу виявлені нами відмінності цитокінового профілю у пацієнтів з МезПГН та МПГН у порівнянні з МН та ФСГС. Отримані результати свідчать про відмінності патогенетичних механізмів прогресування ХГН у хворих з досліджуванми морфологічними формами ХГН та підтверджують думку вчених про доцільність об’єднання непроліферативних морфологічних форм ХГН (МН та ФСГС) у групу окремих нефропатій з переважанням імунних змін незапального характеру.
Аналіз результатів дослідження спонукає до перегляду схем призначення імунотропної терапії хворим на ХГН з НС з врахуванням морфологічних особливостей захворювання та віку хворих.
Особливе місце в роботі відведено дослідженню маркерів клітинного ушкодження нирок: продуктам ПОЛ та ферментам, синтез, або обмін яких відбувається у нирці. Визначення активності ПОЛ та ферментів в плазмі крові та сечі являються на даний час доступними методами дослідження. Отримана діагностична інформація може бути використана для раннього виявлення серйозного ушкодження нирок, підвищення якості диференційної діагностики та корекції тактики ведення хворих.
Дослідження ферментів (ГГТП, що у великій кількості міститься в нирках, приймає участь у процесах ПОЛ та ХЕ, що вказує на стан проникливості ниркових клубочків так, як практично в нормі не виявляється в нирковій тканині ) є важливим та нескладним діагностичним тестом при обстеженні хворих на ХГН.
Результати проведеного дослідження до початку лікування виявили виражене підвищення активності ГГТП в сечі хворих, що найбільше проявилося у пацієнтів з наявністю НС (12,6±2,88 при нормі 3,8±1,83 Од/л)(р<0,05). В крові даної групи хворих відмічене значне зниження цього ферменту (21,3±7,11 при нормі 56,3±3,25 Од/л) (р<0,05). Активність ХЕ крові була значно знижена в осіб з НС (102,1±8,12 при нормі 152,3±8,21 Од/л)(р<0,05), а в сечі рівень даного ферменту зростав (98,9±4,13 при нормі 61,4±6,22)(р<0,05). Аналіз результатів дослідження доводить, що характерною особливістю хронічного запалення ниркової паренхіми є підвищення в сечі активності ХЕ. Так, активність цього ферменту в сечі найвища у хворих з НС, тобто при найактивнішому перебігу ХГН. Про пошкодження гломерулярного фільтру свідчить той факт, що поряд із зростанням активності ХЕ в сечі у пацієнтів з НС знижується його рівень в крові так, як ХЕ в нирковій тканині в нормі відсутня. У хворих з НС активність ГГТП сечі значно зростає поряд із зниженням її в крові.
ГГТП приймає участь у глутатіоновій системі знешкодження токсичних продуктів вільнорадикального окислення, а також в метаболізмі біогенних амінів. Зниження активності цього ферменту в крові спричиняє патологічні зміни (зниження синтезу глутатіону), що у даному випадку, очевидно, провокують зниження функції глутатіон-залежної ланки антиоксидантної системи захисту організму.
З аналізу виявлених результатів дослідження видно, що рівень ГГТП у хворих на ХГН залежав не тільки від активності імунозапального процесу в нирках, але і від вікової категорії хворих (спостерігалося його зниження в крові хворих раннього періоду старості 20,5±4,78 проти 48,9±6,11 Од/л у хворих активного віку). Активність ХЕ у меншій мірі залежить від віку хворих, а, в основному, є показником активності ХГН та глибини ураження нирок при даній патології. Таким чином, комплексне вивчення активності ГГТП та ХЕ в сечі і крові хворих на ХГН з НС можна використовувати для виявлення активності патологічного процесу та глибини ураження нирок.
Внаслідок лікування із застосуванням імуносупресантів вміст показників антиоксидантного захисту (АОЗ) у порівнянні з вихідним рівнем практично не підвищувався, навіть у пацієнтів, які досягли ПКЛР (р>0,05). При дослідженні пацієнтів на ХГН, у яких протягом 1 року не було рецидиву НС, вірогідні зміни відбулися тільки з боку ПОЛ сечі (МДА сечі – 23,57±0,03 Од/ммоль проти 28,86±0,02 Од/ммоль до лікування)(р<0,05).
Таким чином, зміни, що відбулися в сечі пацієнтів з ПКЛР свідчать про позитивну динаміку перебігу захворювання у даної категорії хворих. Це підтверджує виявлення кореляції між зниженням добової протеїнурії та вмістом ПОЛ сечі у пацієнтів, що досягли ПКЛР внаслідок проведеного лікування. Відповідно знижувалися показники вмісту проміжних та кінцевих продуктів ПОЛ в сечі даної групи хворих. Високі показники кореляції між динамікою протеїнурії та ДК (r=0,96; р<0,05) і МДА сечі (r=0,97; р<0,05) вказують на те, що дані показники можуть виступати у якості діагностичних критеріїв активності ХГН та швидкості його прогресування. Позитивні зрушення корекції імунного дисбалансу, що вказують на відновлення імунного гомеостазу у пацієнтів з настанням ПКЛР та готовність до адекватної відповіді на ушкодження, підтверджуються даними досліджень ПОЛ сечі (зменшення вмісту продуктів ПОЛ в сечі) та даними аналізу досліджуваних ферментів (зменшення виділення ХЕ та ГГТП з сечею), що корелювали з динамікою добової протеїнурії.
При розподілі хворих на проліферативні та непроліферативні морфологічні форми ХГН, що було доцільним внаслідок встановленого нами у попередніх дослідженнях перерозподілу імунних показників, а також даних літератури, виявлено, що показники хворих, у яких зареєстровано стійку ПКЛР значно відрізняються в залежності від морфологічної форми ХГН. Так, проаналізовано результати досліджень вмісту лімфоцитів з відповідними CD-маркерами периферичної крові та цитокінів у пацієнтів з проліферативними морфологічними формами ХГН в залежності від ефективності терапії, як до призначення імуносупресивної терапії, так і у процесі лікування.
Результати дослідження CD-маркерів лімфоцитів крові хворих з проліферативними морфологічними формами ХГН представлено у таблиці 3.
З таблиці видно, що у пацієнтів з проліферативними ХГН, у яких настала ПКЛР, після 3 місяців лікування спостерігалося значне зниження рівня CD4+-клітин (22,12±0,43%) у порівнянні з вихідним рівнем (26,05±0,62%) (р<0,05), яке при подальшому дослідженні хворих з збереженням стійкої ПКЛР стабілізувалося (8 міс. – 1 рік). У пацієнтів з відсутнім результатом терапії вихідний рівень CD4+-лімфоцитів був дуже низьким відносно вихідного рівня (16,34±0,12%) (р<0,05).
Таблиця 3
Характеристика показників клітинного імунітету у хворих з проліферативними морфологічними формами ХГН з НС в залежності від результатів лікування у процесі 3-місячної активної терапії
| Показники | Здорові (n=100) | Хворі на ХГН до лікування (n=59) | Хворі на ХГН в процесі лікування | ||
| ПКЛР (n=23) | ЧКЛР (n=25) | Відсутній результат (n=25) | |||
| CD4 (%) | 30,18±0,43 | 26,05±0,62 | 22,12±0,43* | 20,08±0,61^ | 16,34±0,12** |
| CD8 (%) | 19,31±0,50 | 23,93±0,16 | 16,32±0,22* | 19,95±0,45^ | 24,67±0,14** |
| CD54(%) | 18,53±0,85 | 25,12±1,38 | 16,89±0,88* | 28,54±0,87^ | 30,21±0,32* |
| CD95(%) | 11,3±0,61 | 20,22±0,15 | 18,54±0,14* | 19,2±0,25 | 24,65±0,33** |
* - р < 0,05 у порівнянні з показниками хворих групи до лікування
** - р < 0,05 у порівнянні з показниками хворих з ПКЛР та ЧКЛР
^ - р < 0,05 у порівнянні з показниками хворих з ПКЛР
При проведенні індивідуального аналізу результатів хворих, терапія яких була неефективною, виявлено, що вихідні дані CD4+ цих пацієнтів були значно нижчими (15,32±0,45%) за норму (30,18±0,43%) (р<0,05) та значно відрізнялися від показників CD4+ у хворих з настанням ПКЛР (22,12±0,43%) (р<0,05).
Отже, необхідно враховувати вихідні показники CD4+ при плануванні комплексної терапії хворим на ХГН з НС.
Результати динаміки вмісту CD8+-клітин виявили значне їх зниження (16,32±0,22%) у порівнянні з вихідним рівнем (23,93±0,16%) у хворих з настанням ПКЛР (р<0,05). У пацієнтів з ЧКЛР та відсутнім результатом терапії результати були значно вищими (р<0,05). Рівень лімфоцитів з маркерами CD54+ був значно зниженим у пацієнтів з ПКЛР (16,89±0,88%) проти вихідних даних (25,12±1,38%) (р<0,05). Проапоптотичний CD95 знижувався у пацієнтів з проліферативними ХГН з настанням ПКЛР (18,54±0,14%) проти вихідного рівня (20,22±0,15%), що вірогідно відрізнялося від його рівнів у хворих з відстунім ефектом терапії (24,65±0,33%) (р<0,05).
У хворих з непроліферативними морфологічними формами ХГН аналіз результатів дослідження CD-маркерів показав відмінності значень показників Т-клітинного імунітету у пацієнтів з негативними ефектами терапії імуносупресантами від значень такої ж групи хворих з проліферативними ХГН (таблиця 4).
З таблиці видно, що пацієнти, у яких наступила ПКЛР зовсім не відповідають по якісним змінам показників тим даним, яких досягли хворі з проліферативними морфологічними варіантами ХГН.
Таблиця 4
Характеристика показників клітинного імунітету у хворих з непроліферативними морфологічними формами ХГН з НС в залежності від результатів лікування у процесі 3-місячної активної терапії
| Показники | Здорові (n=100) | Хворі на ХГН до лікування (n=45) | Хворі на ХГН в процесі лікування | ||
| ПКЛР (n=22) | ЧКЛР (n=27) | Відсутній результат (n=35) | |||
| CD4 (%) | 30,18±0,43 | 28,69±0,52 | 26,12±0,16* | 27,08±0,72 | 25,34±0,34* |
| CD8 (%) | 19,31±0,50 | 22,95±0,17 | 18,98±0,16 | 19,27±0,33 | 27,52±0,10** |
| CD54(%) | 18,53±0,85 | 14,22±1,38 | 16,12±0,67* | 10,48±0,90^ | 13,11±0,69** |
| CD95(%) | 11,3±0,61 | 16,82±0,49 | 18,54±0,54 | 19,44±0,85 | 27,69±0,55** |
* - р < 0,05 у порівнянні з показниками хворих групи до лікування
** - р < 0,05 у порівнянні з показниками хворих з ПКЛР та ЧКЛР
^ - р < 0,05 у порівнянні з показниками хворих з ПКЛР
Так, вміст CD4+-клітин характеризувався зниженим у порівнянні з вихідними даними рівнем (26,12±0,16%), але у пацієнтів, які мали відсутній результат на терапії імуносупресантами рівень CD4+ (25,34±0,34%) не відрізнявся вірогідно від показників групи з ПКЛР (р>0,05). Тобто, у хворих з непроліферативними морфологічними формами ХГН вміст СD4+-клітин не відіграє значущої ролі у прогресуванні захворювання.
З боку CD8+ зміни були інакшими, Так, у хворих, що досягли ПКЛР рівень цього показника значно знижувався (18,98±0,16%) у порівнянні з вихідними даними (22,95±0,17%) (р<0,05), а у хворих з відсутнім результатом терапії значення CD8+ залишалися високими, або ще більше зростали (27,52±0,10%) (р<0,05) .
Рівень лімфоцитів з маркерами CD54+ був різко зниженим у всіх хворих з непроліферативними морфологічними формами ХГН, що найбільше проявлялося у пацієнтів з ЧКЛР та відсутнім результатом лікування. Ці результати підтверджують дані наших попередніх досліджень про негативне значення низьких рівнів CD54+-клітин для подальшого перебігу ХГН. Але у цьому випадку, враховуючи високі цифри CD4+ та CD8+, можливо, зниження рівня лімфоцитів з маркерами CD54+ не відіграє такого важливого значення.
Рівень проапоптотичного фактора CD95 у хворих з непроліферативними морфологічними формами ХГН, що досягли ПКЛР, був вірогідно вищим за вихідні значення (18,54±0,54%), але значно нижчим проти значень CD95+ хворих з відсутнім результатом терапії імуносупресантами (27,69±0,55%) (р<0,05).
Отже, у пацієнтів з непроліферативними морфологічними формами ХГН відсутність ефекту активної терапії характеризується високими рівнями CD4+-, CD8+-, CD95+-клітин та низьким рівнем CD54+-клітин, що не співпадає з відповідними даними хворих з проліферативними морфологічними формами ХГН. Це вказує на різні шляхи прогресування хвороби у даних хворих та на необхідність диференційованого підходу до лікування хворих з проліферативними та непроліферативними нефропатіями.
При дослідженні цитокінового профілю у даних груп хворих виявлено, що у пацієнтів обох розподілених за морфологічними ознаками груп відсутній результат лікування супроводжувався високими значеннями ТФР-в.
У пацієнтів з проліферативними морфологічними формами ХГН при відсутності результатів лікування відмічалося виражене зниження вмісту ІЛ-10 у порівнянні з показниками при настанні ПКЛР, а зниження рівня ІФН-г, як уже вище показано було неінтенсивним. Для спрощення оцінки прогнозу перебігу ХГН з НС у хворих з проліферативними морфологічними формами ХГН нами виведено коефіцієнт К співвідношення ІФН-г до IL-10. При визначенні К у всіх 3-х групах спостерігалося, що у пацієнтів з ПКЛР та ЧКЛР визначався К<1, а у хворих з відсутнім ефектом терапії - К>1 (табл. 5).
Таблиця 5
Характеристика показників цитокінового профілю у хворих з проліферативними морфологічними формами ХГН з НС в залежності від результатів лікування
| Показники | Здорові (n=50) | Хворі на ХГН до лікування (n=59) | Хворі на ХГН в процесі лікування | ||
| ПКЛР (n=23) | ЧКЛР (n=25) | Відсутній Результат (n=25) | |||
| ІФН-г (пг/мл) | 20,20+1,10 | 99,80 +1,17 | 72,12±1,33* | 85,31±1,36*^ | 99,55±1,17** |
| ІЛ-10 (пг/мл) | 200,1+3,40 | 65,43+1,68 | 102,1±2,11* | 92,1±2,85*^ | 71,7±1,91** |
| ФНП-б (пг/мл) | 47,50+8,40 | 164,41+9,12 | 93,45±8,63* | 99,15±9,22* | 112,18±9,13 |
| ТФР-в (пг/мл) | 56,50+7,81 | 129,12+9,22 | 133,18±9,54 | 138,11±8,82* | 141,37±8,75 |
| К = ІФН-г ІЛ-10 | К<1 | К>1 | К<1 | К<1 | К>1 |
* - р < 0,05 у порівнянні з показниками хворих групи до лікування
** - р < 0,05 у порівнянні з показниками хворих з ПКЛР та ЧКЛР
^ - р < 0,05 у порівнянні з показниками хворих з ПКЛР
Таким чином, проведений аналіз імунних показників в результаті дослідження хворих на ХГН з НС в динаміці активної терапії виявив можливість прогнозування перебігу ХГН. Так, вірогідне зниження рівнів ІФН-г та CD54+-клітин у порівнянні з вихідними даними та відповідне підвищення вмісту ІЛ-10 в динаміці лікування передбачає позитивний прогноз з урахуванням значення К<1. Негативна динаміка досліджуваних показників спонукатиме до перегляду імуносупресивної терапії. Це дозволить уникнути ускладнень довготривалої та неефективної імуносупресії.
При непроліферативних морфологічних формах таких співвідношень та закономірностей не спостерігалося, а також у хворих з відсутнім ефектом лікування вміст ФНП-б та ІФН-г не були підвищеними. Це доводить правильність нашого припущення про те, що у хворих з непроліферативними морфологічними формами ХГН, особливо це стосується МН, прогресування ХГН не супроводжується процесами імунного запалення.
Тому, терапія із застосуванням імуносупресантів у таких пацієнтів проявляє не виражений агресивний вплив на Т-систему імунітету даних пацієнтів і, можливо, тому у багатьох випадках вона є малоефективною.
Все вищевказане зумовлює необхідність аналізу з метою різного підходу до терапевтичної тактики у пацієнтів з проліферативними та непроліферативними морфологічними формами ХГН.
Ідентифікована нами різниця імунних механізмів при ураженні нирок при ХГН з проліферативними та непроліферативними морфологічними формами визначає ефективність терапії даної патології.
Нами було оцінено ефективність ведення міжударного (міжпульсового) періоду (періоду між проведенням «пульсових» доз ЦФ) у хворих на ХГН з НС з використанням інгібіторів АПФ (іАПФ) та антагоністів рецепторів до ангіотензину ІІ (А ІІ) та статинів. Результати оцінено через 6 місяців від початку лікування.
Результати дослідження виявили, що включення у комплексну терапію іАПФ та антагоністів рецепторів до А ІІ, в основному, не впливають на динаміку імунних показників у хворих, яким застосовано «пульсові» дози ЦФ. Включення у міжударний період статинів показало їх імунокорегуючу дію. Враховуючи виявлену нами динаміку ІФН-г та ТФР-в, можна стверджувати про сприяння гальмуванню склеротичних процесів під дією статинів. Рівень ТФР-в при застосуванні статинів у пацієнтів з непроліферативними морфологічними формами ХГН (95,6±6,45 пг/мл) був вірогідно нижчим проти вихідного (123,7±8,33 пг/мл) (р<0,05) та пацієнтів, які не приймали статини (112,36±7,32 пг/мл) (р<0,05). Враховуючи літературні дані про високу просклеротичну активність ТФР-в, результати даного дослідження доводять високу ефективність статинів саме у хворих з непроліферативними формами ХГН.
Нами проведено аналіз ефективності лікування хворих з різними морфологічними формами ХГН з НС.
Отже, як видно з рис. 1, найвищою ефективність преднізолону була у пацієнтів з МЗ (74,1% позитивних результатів - ПКЛР+ЧКЛР). Непогано відреагували на монотерапію преднізолоном хворі з ФСГС (48,2% ПКЛР+ЧКЛР). Решта пацієнтів мали низьку ефективність від преднізолону.
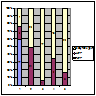
Примітка: 1 – МЗ; 2 – ФСГС; 3 – МН; 4 – МПГН; 5 – МезПГН
Рисунок 1. Ефективність застосування преднізолону у хворих на ХГН з НС.
Імунотерапія із застосуванням «пульсових» доз ЦФ найбільш ефективною виявилася у пацієнтів з проліферативними морфологічними формами ХГН з НС (МПГН – 38,4% ПКЛР+ЧКЛР; МезПГН – 61,1% ПКЛР+ЧКЛР). У всіх хворих з непроліферативними ХГН терапія ЦФ була малоефективною (рис. 2).
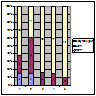
Примітка: 1 – МПГН; 2 – МезПГН; 3 – МЗ; 4 – ФСГС; 5 – МН.
Рисунок 2. Ефективність застосування ЦФ у хворих на ХГН з НС.
Хворим, яким було застосовано поєднаний метод імунотерапії (П+ЦФ) відреагували на дану імунотерапію подібно, але кращі результати відзначалися у пацієнтів з проліферативними морфологічними формами ХГН, особливо в групі хворих з МезПГН (ПКЛР+ЧКЛР становило більш як 60%). У хворих з МПГН (більш, як 50% ПКЛР+ЧКЛР). На дану терапію хворі з непроліферативними морфологічними формами ХГН відреагували таким чином: МЗ(18% ЧКЛР), МН (19% ЧКЛР), ФСГС (18,2% ЧКЛР), а ПКЛР не спостерігалося у цих пацієнтів(рис. 3).
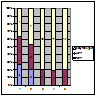
Примітка: 1 – МезПГН; 2 – МПГН; 3 – МЗ; 4 – ФСГС; 5 – МН.
Рисунок 3. Ефективність комбінованого застосування ЦФ та преднізолону у хворих на ХГН з НС.
Під впливом циклоспорину відмічено наявність позитивних результатів з МЗ (ПКЛР+ЧКЛР – 79,5%), у пацієнтів з МН (56,5% ПКЛР+ЧКЛР)(рис.4).
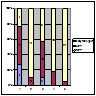
Примітка: 1 – МЗ; 2 – ФСГС; 3 – МН; 4 – МПГН; 5 – МезПГН.
Рисунок 4. Ефективність застосування циклоспорину у хворих на ХГН з НС.
У пацієнтів, яким було застосовано комбіноване застосування циклоспорину та преднізолону кількість випадків ПКЛР збільшилася у хворих з МЗ та у хворих з МН. У пацієнтів з проліферативними морфологічними формами ХГН результати були подібними до попередніх (рис. 5).
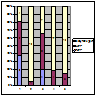
Примітка: 1 – МЗ; 2 – ФСГС; 3 – МН; 4 – МезПГН; 5 – МПГН.
Рисунок 5. Ефективність комбінованого застосування циклоспорину та преднізолону у хворих на ХГН з НС.
Застосування ММФ було ефективним у пацієнтів з ФСГС (41,2% - ЧКЛР); МН (44,4% - ЧКЛР); МезПГН (більш як 59% ЧКЛР); МПГН (38,3% ЧКЛР) (рис. 6).
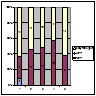
Примітка: 1 – МЗ; 2 – ФСГС; 3 – МН; 4 – МезПГН; 5 – МПГН.
Рисунок 6. Ефективність застосування ММФ у хворих на ХГН з НС.
Пацієнти з комбінованим застосуванням ММФ та преднізолону відреагували краще на дану терапію (рис.7). Так, у пацієнтів з ФСГС 58,2%. Результати решти пацієнтів були подібними до попередніх.
Отже, ідентифікована нами різниця імунних механізмів при ураженні нирок при ХГН з проліферативними та непроліферативними морфологічними варіантами визначає ефективність терапії даної патології.
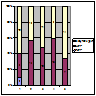
Примітка: 1 – МЗ; 2 – ФСГС; 3 – МН; 4 – МезПГН; 5 – МПГН.
Рисунок 7. Ефективність комбінованого застосування ММФ та преднізолону у хворих на ХГН з НС.
З метою визначення значущості клініко-лабораторних та імунних параметрів для прогнозування ефективності активної терапії ХГН нами проведено роздільну оцінку вірогідності та сили зв’язку між вивченими показниками при первинному обстеженні в клініці та відсотком випадків позитивних наслідків терапії. Вибіркові коефіцієнти та величина ч2 обчислювалась на підставі частот з таблиць спільного розподілу досліджуваних ознак.
Безпосередня ефективність лікування у хворих на ХГН суттєво не залежала від рівнів гематурії, загального холестерину сироватки крові, ферментів сечі, ПОЛ сечі (ч2 відповідно складав 0,88; 0,95; 0,48; 0,78; 0,96; 0,59 и 0,91, для всіх значень ч2 – р > 0,05). Виявлено вірогідний зв’язок ефективності терапії ХГН з рівнями протеїнурії (ч2=15,22, р < 0,05), САТ (ч2=19,12, р < 0,05) и ДАТ (ч2=18,87, р < 0,05), характером АГ (зростання, зниження) – ч2=18,68, р < 0,05, зростанням CD4 (ч2=27,56, р < 0,05) (проліферативні), CD54 (ч2=18,33, р < 0,05) (проліферативні), ІФН-г (ч2=15,57, р <0,05) (непроліферативні), зниженням CD95 (ч2=16,34, р < 0,05) (проліферативні), ТФР-в (ч2=18,22, р <0,05) (непроліферативні), значенням К (ІФН-г/ІЛ-10) (проліферативні), з призначенням «пульс-доз» циклофосфану з малими дозами преднізолону, Селл-Септу (проліферативні),(ч2=27,32, р < 0,05 та ч2=21,58, р < 0,05 відповідно), з призначенням преднізолону, сандимуну, Селл-Септу (непроліферативні) (ч2=18,67, р < 0,05; ч2=16,43, р < 0,05 та ч2=19,12, р < 0,05 відповідно), включенням у терапію статинів (ч2=22,59, р <0,05), а також віком (ч2=11,13, р < 0,05).
Для оцінки факторів, що визначають ефективність лікування, використовували покроковий множинний лінійний регресійний аналіз. У якості залежної змінної використовували відсоток випадків позитивних клінічних ефектів терапії, у якості незалежних змінних – вік, рівні протеїнурії, гематурії, циліндрурії, ліпоїдурії, загального холестерину, САТ, ДАТ, дефіцит CD4, CD54, зростання CD8, CD95, рівні ІФН-г, ІЛ-10, ТФР-в, ФНП-б, значення К (ІФН-г/ІЛ-10), методи імуносупресії, включення у комплексну терапію статинів, стать, вік хворих.
При проведенні покрокового множинного лінійного регресійного аналізу даних пацієнтів з проліферативними морфологічними формами ХГН відмічено вірогідний зв’язок між кількістю випадків позитивних клінічних результатів імуносупресивної терапії з одного боку та рівнями протеїнурії САТ и ДАТ, методами імуносупресії, дефіцитом CD4+- та CD54+-клітин, значенням коефіцієнта К (ІФН-г/ІЛ-10) та віком – з іншого боку (табл. 6).
Таблиця 6
Фактори, що визначають ефективність імуносупресивної терапії проліферативних морфологічних форм ХГН з НС та збереженою функцією нирок (покроковий множинний лінійний регресійний аналіз).
| Незалежні змінні | R2 (%) | Р |
| Рівень протеїнурії | 0,28 | p < 0,001 |
| Рівень протеїнурії, рівні САТ | 0,34 | p < 0,001 |
| Рівень протеїнурії, рівні САТ, ДАТ | 0,38 | p < 0,001 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії | 0,42 | p < 0,002 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, дефіцит CD4 | 0,48 | p < 0,004 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, дефіцит CD4, дефіцит CD54 | 0,54 | p < 0,004 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, дефіцит CD4, дефіцит CD54, ступінь зростання CD95 | 0,58 | р < 0,005 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, дефіцит CD4, дефіцит CD54, ступінь зростання CD95, значення К (ІФН-г/ІЛ-10) | 0,75 | р < 0,005 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, дефіцит CD4, дефіцит CD54, ступінь зростання CD95, значення К (ІФН-г/ІЛ-10), вік | 0,78 | р < 0,006 |
Примітка:
САТ – систолічний артеріальний тиск;
ДАТ – діастолічний артеріальний тиск;
При проведенні покрокового множинного лінійного регресійного аналізу даних пацієнтів з непроліферативними морфологічними формами ХГН відмічено вірогідний зв’язок між кількістю випадків позитивних клінічних результатів імуносупресивної терапії з одного боку та рівнями протеїнурії САТ и ДАТ, методами імуносупресії, рівнями ТФР-в, ІФН-г та віком – з іншого боку (табл. 7).
Таблиця 7
Фактори, що визначають ефективність імуносупресивної терапії непроліферативних морфологічних форм ХГН з НС та збереженою функцією нирок (покроковий множинний лінійний регресійний аналіз).
| Незалежні змінні | R2 (%) | Р |
| Рівень протеїнурії | 0,32 | p < 0,001 |
| Рівень протеїнурії, рівні САТ | 0,38 | p < 0,002 |
| Рівень протеїнурії, рівні САТ, ДАТ | 0,42 | p < 0,002 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії | 0,58 | p < 0,002 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, рівень ТФР-в | 0,72 | p < 0,004 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, рівень ТФР-в, рівень ІФН-г | 0,78 | p < 0,004 |
| Рівень протеїнурії, рівні САТ, ДАТ, методи імуносупресії, рівень ТФР-в, рівень ІФН-г, вік | 0,82 | р < 0,005 |
Примітка:
САТ – систолічний артеріальний тиск;
ДАТ – діастолічний артеріальний тиск;
Виявлені результати дослідження підтверджують та обгрунтовують найефективніший корегуючий вплив на імунний дисбаланс при ХГН з МЗ та МН глюкокортикоїдів та циклоспорину.
Позитивну дію преднізолон виявив у пацієнтів з ФСГС, але негативним ефектом тут являється виражене зростання ТФР-в, що володіє просклеротичною дією. Позитивна динаміка клінічного перебігу та імунних показників виявлена у пацієнтів з МН під дією циклоспорину. Під впливом преднізолону у даних хворих з МН також відбувалося зростання рівня ТФР-в.
Аналіз проведених досліджень виявив позитивну дію ЦФ, або комбінацію ЦФ+преднізолон у пацієнтів з проліферативними морфологічними формами ХГН при умові мінімальних явищ дефіциту та дисбалансу в системі Т-клітинного імунітету. При наявності вираженого дефіциту та дисбалансу Т-клітинної ланки імунітету у пацієнтів з проліферативними морфологічними формами ХГН позитивну дію виявив ММФ. ММФ може з успіхом використовуватись для імуносупресивної терапії хворих з МН. У хворих з ФСГС позитивні зміни були менш значними в результаті прийому ММФ, але враховуючи повну відсутність нефротоксичності, відсутність інших ускладнень та побічних ефектів у нашому дослідженні від прийому даного препарату та наявність опосередкованого протисклеротичного ефекту у нього, ММФ можна рекомендувати як препарат вибору при даній морфологічній формі ХГН. Зниження АТ під дією ММФ дозволяє з ефективністю призначати його пацієнтам з наявністю АГ.
ВИСНОВКИ
В дисертації наведено теоретичне обгрунтування і нове вирішення актуальної проблеми нефрології – диференційованого підходу до імунотерапії у хворих на ХГН з НС на підставі вивчення патогенетичних механізмів прогресування ХГН, розробки прогнозування ефективності лікування даної патології.
1. Дисбаланс в системі Т-клітинного імунітету є характерною патологічною ознакою ХГН, що має різний ступінь вираженості та різну направленість залежно від морфологічної форми ХГН, віку хворих. Найвагоміше пригнічення CD4+-лімфоцитів відмічене у хворих на проліферативні форми ХГН з НС, що найбільше проявилося у пацієнтів раннього періоду старості порівняно з іншими віковими групами (р<0,05).
2. При первинному обстеженні виявлено відмінності співвідношення показників Т-клітинного імунітету у хворих з проліферативними та непроліферативними морфологічними формами ХГН, що проявилося вірогідним зниженням рівнів CD4+-, CD54+-клітин (р<0,05) та вірогідним підвищенням вмісту CD8+-, CD95+-клітин у пацієнтів з проліферативними формами ХГН. У хворих з непроліферативними морфологічними формами ХГН вірогідних змін з боку CD4+ (р>0,05) не спостерігалося, а порушення співвідношень вмісту інших CD-маркерів було подібним.
3. У всіх хворих на ХГН з НС зареєстровано підвищення вихідного рівня прозапальних цитокінів ІФН-г, ФНП-б та зниження вмісту протизапального ІЛ-10 (р<0,05). У хворих з непроліферативними морфологічними формами ХГН з НС виявлено виражене зростання вмісту ТФР-в крові, що вірогідно відрізняється від значень цього цитокіну у пацієнтів з проліферативними морфологічними формами ХГН (p<0,05) та найбільш виражене у хворих з ФСГС. Виявлена кореляційна залежність між рівнем ФНП-б та віком хворих (r = - 0,47); між рівнем ІФН-г та віком хворих (r = - 0,57) (р < 0,05); між рівнем ТФР-в та зростанням добової протеїнурії (r= 0,58; р<0,05), ступенем вираженості гіпертензивного синдрому і рівнем ТФР-в ( r= 0,45; р<0,05), а також обернену кореляційну залежність з рівнем ШКФ (r= - 0,82; р<0,05).
4. Наявність НС у хворих на ХГН супроводжується значним підвищенням рівня продуктів ПОЛ в крові та сечі і зниженням вмісту показників АОС, що найінтенсивніше проявляється у хворих з непроліферативними морфологічними формами ХГН з НС. Виявлено кореляційну залежність МДА сечі з добовою протеїнурією (r=0,85; р<0,05); з ДК сечі (r= 0,92; р<0,05).
5. Підвищення вмісту ХЕ в сечі та зниження його у крові характеризує активність патологічного процесу в нирках у хворих на ХГН з НС, що найінтенсивніше проявляється у хворих з непроліферативними морфологічними формами ХГН. Виявлено кореляційну залежність ХЕ сечі від рівня ТФР-в крові хворих (r=0,75) і обернену залежність ХЕ крові від рівня ТФР-в крові (r=-0,48). Виявлено кореляційну залежність між рівнями протеїнурії та ХЕ сечі (r= 0,62; р <0,05), а також між вмістом ГГТП крові та рівнем Гл-SH крові хворих на ХГН з НС (r= 0,49; р<0,05). Оцінка рівнів ХЕ сечі та ГГТП крові у хворих на ХГН з НС може бути використана для виявлення активності патологічного процесу в нирках.
6. Висока ефективність глюкокортикоїдної монотерапії виявлена тільки у хворих з МЗ (74,1% позитивних результатів - ПКЛР+ЧКЛР), у хворих з ФСГС (48,2% ПКЛР+ЧКЛР). При застосуванні преднізолону у вигляді комбінованого прийому, позитивний ефект спостерігався при поєднанні: ЦФ+преднізолон - у хворих з МезПГН (ПКЛР + ЧКЛР 62%) та у хворих з МПГН (51% ЧКЛР); циклоспорин +преднізолон – у хворих з МН (61% ПКЛР+ЧКЛР) та ММФ+преднізолон – у хворих з ФСГС (58,2% ЧКЛР.
7. Застосування «пульсових» доз ЦФ у пацієнтів з проліферативними морфологічними формами ХГН було ефективним: у хворих з МПГН -38,4% ПКЛР + ЧКЛР; МезПГН – 61,1% ПКЛР + ЧКЛР. При дуже низьких вихідних значеннях CD4+ (нижче 18%) ефективність терапії була низькою.
0 комментариев