Навигация
Алкалоиды каллусных тканей мака прицветникового
3.4 Алкалоиды каллусных тканей мака прицветникового
Мак прицветниковый (Papaver bracteatum) может быть использован c целью получения тебаина – морфинового алкалоида, являющегося предшественником кодеина и морфина. Тебаин составляет до 98% от суммы алкалоидов P.bracteatum и в лабораторных условиях легко может быть переведён в кодеин наиболее широко распространённое в мире противокашлевое средство.
Литературные данные свидетельствуют о том, что в культуре клеток растений рода Papaver доминируют алкалоиды протопионового, бензафенантридинового и тетрагидропротоберберинового типов, берущих начало от (+)-ретикулина и отсутствуют, либо присутствуют в следовых количествах алкалоиды морфинановой группы, характерные для растений это рода. При повышении уровня дифференцировки может проявляться тенденция к восстановлению спектра алкалоидов, характерного для целого растения.
Целью настоящей работы являлось получение каллусных тканей P.bracteatum, регенерантов из них и сравнение спектров алкалоидов в культуре тканей и в онтогенезе целых растений.
Штамм Р11 был способен к регенерации при культивировании по следующей схеме: каллусная ткань, выращиваемая в темноте, пересаживалась на среду, отличающуюся от исходной отсутствием гормонов, и выдерживалась в течение 30 дней в темноте. При этом в примыкающем к среде слое каллуса образовывались очаги дифференциации, которые затем пересаживали на свежую питательную среду того же состава и выставляли на свет. Через 2-3 недели внутри и на поверхности каллуса наблюдалось появление зачатков зелёных листочков, иногда образовывались корни. По мере формирования листочков регенеранты высаживали на среду Стрита для активации образования корней. При достижении корнями длины 5-10 мм регенеранты высаживали в вазоны со стерильной почвой и переносили в теплицу.
Присутствие в растительных образцах сангвинарина или тебаина определялось с помощью хроматографии хлороформного экстракта лиофилизированной ткани в тонком слое силикагеля, содержащего и не содержащего люминесцентную добавку, для раздельного определение флуоресцирующих и поглощающих зон.
Количественное определение сангвинарина в культуре тканей рассчитывали по экстинкции при 340 нм вытяжки 10%-ной H2SO4 из хлороформного экстракта лиофилизированной ткани. О количестве алкалоида, переходящего в сангвинарин, судили по разности в содержании сангвинарина в подкисленном муравьиной кислотой хлороформном экстракте до и после облучения его светом лампы ДРШ-250 в течение 1 минуты.
От различных частей двулетних растений мака прицветникового кавказской популяции и популяции Arya 11 были получены каллусные ткани. При качественном изучении спектра алкалоидов в каллусных культурах тебаин обнаружен не был, в то время как в тканях всех штаммов присутствовал сангвинарин, не характерный для целого растения. Содержание сангвинарина в тканях колебалось от 0,5 до 1,7%, а в штамме, полученном из цветоноса растения популяции Arya 11, оно составляло 2,7±0,4%. Наряду с сангвинарином в тканях был обнаружен алкалоид, который на свету переходил в сангвинарин. Содержание его в каллусных тканях по отношению к общему содержанию сангвинарина составляло от 11 до 40%.
Изучение спектров целых растений показало, что они способны к синтезу не только тебаина, но и сангвинарина. Тебаин присутствовал во всех частях растений на протяжении всего времени наблюдения за ними, в то время как сангвинарин был обнаружен в листьях растений только первого года жизни, при чём содержание его с возрастом снижалось. В растениях, выращенных в естественных условиях, в пределах своего ареала, сангвинарин обнаружен не был, и биосинтез его является, по-видимому, явлением, не характерным для сформировавшихся растений.
Из этого факта, что растения мака прицветникового способны в определённых условиях продуцировать сангвинарин, следует, что проявление способности к его биосинтезу в культуре тканей данного растения не является случайным. Исследование спектра алкалоидов регенерантов, полученных из каллусной культуры штамма Р11, показало, что они были способны к биосинтезу сангвинарина, а тебаин был обнаружен в листьях растений-регенерантов лишь спустя 5 месяцев после выращивания их теплице.
Таким образом, способность к биосинтезу алкалоидов тебаина и сангвинарина позволяет выделить две противоположные ситуации: культура тканей способна к биосинтезу только сангвинарина, а выращиваемые в природных условиях растения – к биосинтезу одного тебаина. Кроме того, имеются и промежуточные переходные положения, когда биосинтез обоих алкалоидов одновременно идёт в растениях-регенерантах и в ювенильных растениях.
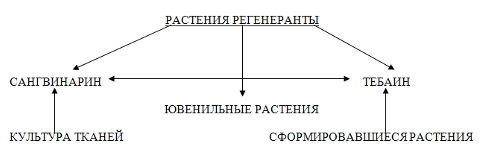
По-видимому, биосинтез сангвинарина связан с ювенильной стадией развития растения и его появление в системе с низким уровнем дифференцировки является, следовательно, закономерным для растений рода Papaver.
3.5 Образование вторичных метаболитов в культуре тканей растений семейства Rutaceae
Многие растения семейства рутовых известны как продуценты физиологически активных соединений. Интерес к этому семейству особенно возрос после обнаружения у некоторых метаболитов Rutaceae противоопухолевой активности. Лечебные свойства руты обыкновенной и близкого, но менее известного вида Boenninghausenia albiflora обусловлены наличием в них кумаринов, фурохиналиновых и акридоновых алкалоидов. Спектры кумаринов и алкалоидов обоих видов в значительной мере подобны, однако в B.albiflora обнаружен неизвестный до сих пор для Ruta акридоновый алкалоид норакроницин, который легко преобразуется in vitro в акроницин, обладающий широким спектром противоопухолевой активности.
Из стерильных проростков семян B.albiflora были получены каллусные культуры, которые проявили различные морфологические признаки при выращивании на среде Мурасиге и Скуга. При длительных пересевах были отобраны штаммы: В1 –гомогенная ткань, В2 –ткань с ризогенезом и В3 –ткань с элементами стеблевого органогенеза.
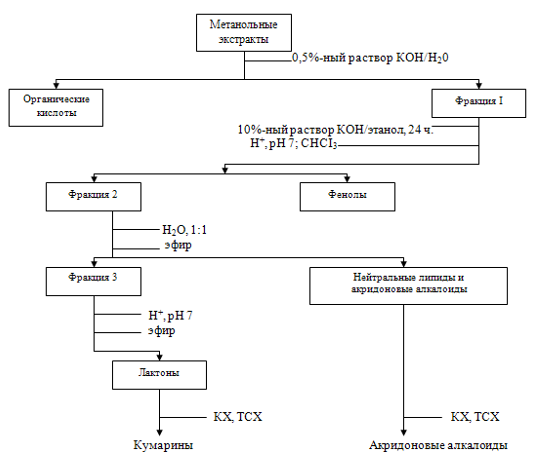
Для изучения состава вторичных метаболитов, синтезируемых в клетках B.albiflora in vitro, лиофилизированные ткани В1, В2 и В3 экстрагировали метанолом.
Предварительная тонкослойная хроматография (ТСХ) метанольных экстрактов показало наличие множества зон с флуоресценцией, типичной для кумаринов. Из суммы метанол-растворимых веществ были выделены фракции органических кислот, фенольных соединений и лактонов, мешающих обнаружению пренилированных акридонов (рутокредон, норакроницин).
Фракционирование метанольных экстрактов тканей В1, В2, В3
С помощью препаративной ТСХ из фракций выделяли индивидуальные соединения и затем идентифицировали их сравнением с чистыми веществами по хроматографическому поведению и УФ-спектром.
Анализ фракций лактонов показал наличие во всех трех штаммах (в качестве преобладающих компонентов) кумаринов: рутомарина, рутакультина, бергаптена, ксантотоксина, хелиеттина, дафноретина и умбеллиферона. Следует отметить, что кумариновый состав штаммов В1, В2, В3 в значительно большей мере соответствует составу В.japonica (наличие бергаптена, ксантотоксина, рутомарина, умбеллиферона и дафноретина), чем состава В.albiflora, в котором ранее были обнаружены лишь бергаптен, дафноретин, и следы рутомарина. Рутакультин и хелиеттин (дезацитилрутамарин) обнаружены в роде Boenninghusenia впервые.
Из остатков метанольных сумм, обогащенных липидными компонентами и имеющими характерный желтый цвет, были выделены и идентифицированы алкалоиды рутакридон и его водорастворимое производное – глюкозит гравакридондиола. Норакроницин ни в одном из штаммов не был обнаружен.
Штаммы В1 и В3 (гомогенные не дифференцированная ткань и ткань с элементами стеблевого органогенеза) по составу кумаринов и пренилированных акридонов практически не различались, тогда как ткань с выраженным ризогенезом – штамм B2 – характеризовалась значительно большим рутакультина и рутакридона. Содержание рутакридона и глюкозида гравакридондиола, определено методами ТСХ и УФ-спектрометрии, составляло для штаммов В1 и В2 – следы и 0,01; 0,01 и 0,03% соответственно.
Известно, что в культурах клеток Rutaceae в большинстве случаев не теряется способность к синтезу вторичных метаболитов, но их концентрация бывает значительно ниже, чем в органах интактных растений. В некоторых случаях в культуре обнаруживается также изменение в спектре метаболитов, вплоть до появления веществ, не типичных для целого растения. Изменения в спектре вторичных метаболитов в культуре ткани и снижение их концентрации объясняется физиологическими особенностями растительных клеток, не достигающих в культуре in vitro уровня дифференциации, соответствующего уровню специализированных клеток целого растения.
Отсутствие в исследованных штаммах ткани В.albiflora норакроницина, возможно, объясняется именно низким уровнем организации культивируемых клеток. Взаимосвязь физиологической и биохимической дифференциации в культуре клеток В.albiflora доказывается так же тем, что при исследовании ее с помощью люминесцентного микроскопа ярко-оранжевая флуоресценция, характерная для акридоновых алкалоидов, была обнаружена только в резогенном штамме В2. Причем флуоресценция была локализована в корневых трихомах и в некоторых поверхностных клетках корней. Количественное определение акридоновых алкалоидов В1 и В2 также подтверждает это положение.
Таким образом, в штаммах тканях В.albiflora, не содержащих типичного для целого растения алкалоида норакроницина, обнаружены наряду с рутакридоном и глюкозидом гравакридондиола, кумарины и фурокумарины, характерные для растений рода Boenninghusenia, а также новые для рода кумарины – рутакультин и хелиеттин. Количество акридоновых алкалоидов в штаммах зависит от уровня дифференциации ткани.
Заключение
В заключении хочется отметить, что эта тема является очень перспективной для фармацевтической промышленности, так как продуктивность культуры тканей можно регулировать, а значит количество необходимого соединения будет гарантировано. Кроме того культуры защищены от внешних неблагоприятных факторов, способных снизить качество сырья. Процесс сбора и обработки такого сырья значительно упрощается за счёт культивирования только нужной ткани растения в стерильных условиях. Проблемой является трудоёмкий процесс отбора необходимой ткани и разработки среды для получения оптимального результата. Работы которые представлены в данной курсовой – это лишь малая часть, которая не отображает всего масштаба этой темы.
Литература
1. Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. М.: Наука, 1964. 272 с.
2. Бутенко Р.Г. Культура клеток растений и биотехнология. М.: Наука, 1986. 286 с.
3. Бутенко Р.Г. Биология культивируемых клеток и биотехнология растений. М.: Наука, 1991. 280 с.
4. Бутенко Р.Г. Клеточные технологии для получения экономически важных веществ растительного происхождения. М.: 1986. с.3-20.
5. Воллосович А.Г.//Культура изолированных тканей и клеток растений. М.: Наука, 1970. с.234-235.
6. Действие кинетина на дифференциацию и образование фенольных соединений в каллусной культуре чайного растения / М.Н. Запрометов и др. // Физиол. растений, 1986. T. 33. № 2. С. 356-364.
7. Запрометов М.Н. Вторичный метаболизм и его регуляция в культурах клеток и тканей растений // Культура клеток растений. М.: Наука, 1981. С. 37-50.
8. Кунах В.А. Изменчивость растительного генома в процессе дедифференцировки и каллусообразования in vitro // Физиол. растений, 1999. Т. 46. № 6. С. 919-929.
9. Лекарственное сырьё растительного и животного происхождения. Фармакогнозия: учебное пособие/ под ред. Г.П.Яковлева. СПб.: СпецЛит, 2006. 845 с.
Похожие работы
... процесс разделения нестабильных веществ можно проводить в холодильной камере. Выделенное соединение подвергают структурному химическому исследованию, а затем изучают его фармакологическое действие. Получение лекарственных веществ методом культуры тканей высших растений В нашей стране заготавливаются десятки тысяч тонн ЛРС. Однако потребность в БАВ, содержащихся в растениях, с каждым годом ...
... использования экстрактивных веществ хмеля разработана технология производства молотого брикетированного хмеля, позволяющая уменьшить расход хмеля на 15%. Применяют так же и хмелевые экстракты в соотношении 1:1. (В.М. Бондаренко, 1959). 3 Выделение чистой культуры дрожжевых грибов В зависимости от программы исследований выбирают тот или иной метод отбора образцов, позволяющий либо только ...
... с агрессивным поведением иммунной системы. 21 Медицинская биотехнология, ее задачи и достижения. Биотехнология представляет собой область знаний, которая возникла и оформилась на стыке микробиологии, молекулярной биологии, генетической инженерии, химической технологии и ряда других наук. Рождение биотехнологии обусловлено потребностями общества в новых, более дешевых продуктах для ...
... частности, биогенного происхождения: поли-b-оксибутирата, полиамилозы) и поиск новых активных микроорганизмов-разрушителей полимеров (полиэтилена, полипропилена, полихлорвинила). Усилия биотехнологов направлены также на борьбу с пестицидными загрязнениями — следствием неумеренного и нерационального применения ядохимикатов. Биотехнологические разработки играют важную роль в добыче и переработке ...

0 комментариев