Навигация
Мембранозалежні процеси в тканині міокарда морських свинок за умов гострої гіперімунокомплексної патології
Міністерство охорони здоров’я України
Державний вищий навчальний заклад
Тернопільський державний медичний університет
імені І.Я. Горбачевського
ПОРОХОВСЬКА НАТАЛІЯ ВАСИЛІВНА
УДК: 616-056.3-036.11:616.127]-092.9:599.324.7
МЕМБРАНОЗАЛЕЖНІ ПРОЦЕСИ В ТКАНИНІ МІОКАРДА МОРСЬКИХ СВИНОК ЗА УМОВ ГОСТРОЇ ГІПЕРІМУНОКОМПЛЕКСНОЇ ПАТОЛОГІЇ
14.03.04 – патологічна фізіологія
АВТОРЕФЕРАТ дисертації на здобуття наукового ступенякандидата медичних наук
Тернопіль – 2008
Дисертацією є рукопис.
Робота виконана у Львівському національному медичному університеті
імені Данила Галицького МОЗ України
Науковий керівник:доктор медичних наук, професор Бідюк Мартин Миколайович.
Офіційні опоненти:доктор медичних наук, професор Мисула Ігор Романович, Державний вищий навчальний заклад «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», завідувач кафедри медичної реабілітації та спортивної медицини;
доктор медичних наук, професор Казімірко Ніла Казімірівна, Луганський державний медичний університет МОЗ України, завідувач кафедри патологічної фізіології.
Захист відбудеться 18 квітня 2008 р. о 12 годині на засіданні спеціалізованої вченої ради Д 58.601.01 у Державному вищому навчальному закладі «Тернопільському державному медичному університеті імені І.Я. Горбачевського» МОЗ України (46001, м. Тернопіль, Майдан Волі, 1).
З дисертацією можна ознайомитися у бібліотеці Державного вищого навчального закладу «Тернопільського державного медичного університету імені І.Я. Горбачевського» МОЗ України (46001, м. Тернопіль, вул. Січових Стрільців, 8).
Автореферат розісланий 12 березня 2008 р.
Вчений секретар спеціалізованої вченої ради
доктор медичних наук, професор Я.Я. Боднар.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Аналіз даних ВООЗ доводить, що алергічні захворювання залишаються найважливішою медико-соціальною проблемою (Чучалин А.Г., 2000), оскільки за останні 10 років кількість хворих на алергію і аутоімунні захворювання збільшилися з 10–15% до 20–30%. Це пов’язано з тим, що імунна система не завжди може адекватно прореагувати на постійне зростання антигенного навантаження (хімічні, синтетичні, фізичні та біологічні чинники, медикаменти, вакцини та ін.) та динамічну зміну складу антигенів. Сьогодні важко знайти нозологічну одиницю, в розвитку якої не була б зацікавлена імунна система. Однією з таких патологій є імунокомплексна хвороба, розвиток якої спричинений імунними комплексами. Вона включає велику кількість нозологій: ревматоїдний артрит, системний червоний вовчак, гломерулонефрит і тубулоінтерстиціальний нефрит, системні васкуліти, хвороба Рейно, велика група інфекційних захворювань, параонкологічні захворювання, ускладнення трансплантації нирок тощо (Аванесов А.М., 1999, Кузнецов С.А., 2000, Волосянко А.Б., 2000, Сааб Халед Зейн-Эддин, 1995, Чоп’як В.В., 1998, Kawana S., 1998). Вони характеризуються запальними ураженнями судин, нирок, серця, суглобів (Аванесов А.М., 1999; Сааб Халед Зейн-Эддин, 1995; Чоп’як В.В., 1998; Kawana S., 1998). Однак зусилля більшості дослідників проблеми імунокомплексної патології зосередженні на вивченні змін у нирках, суглобах та судинах і лише поодинокі роботи присвячені дослідженню змін у серці (Мойбенко А.А., 1992; Сааб Халед Зейн-Эддин, 1995; Bachetti T., 1998). А саме, Мойбенко О.О. зі співавт. досліджували імуногенні порушення скоротливої функції серця при різних типах алергічних реакцій.
Вивчення різноманітних сторін патогенезу захворювань серцево-судинної системи є не менш актуальною проблемою медицини, оскільки смертність від них невпинно зростає (Гуревич М.А., 1998; Мойбенко О.О., 2002; Angelini A., 2000; Hufnagel G., 2000).
Проте, на сьогодні залишаються не з’ясованими структурно-метаболічні зміни у міокарді. Невирішеними залишаються питання корекції можливих змін у кардіоміоцитах при імунокомплексних захворюваннях. Тому питання про мембранозалежні процеси у кардіоміоцитах за умов гострої гіперімунокомплексемії та пошук можливої їх корекції є відкритим, що свідчить про актуальність нашого дослідження і заслуговує експериментальних розробок з метою подальших методичних рекомендацій для використання їх у терапії імунокомплексної патології.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота є складовою частиною планової наукової кафедральної теми «Імуно-ендотеліально-залежні механізми в розвитку гіперімунокомплексного синдрому в експерименті та клініці», яку виконує кафедра патологічної фізіології Львівського національного медичного університету імені Данила Галицького (№ держреєстрації 0101U009233). Автор був відповідальним виконавцем зазначеної науково-дослідної роботи. Тема дисертації затверджена Проблемною комісією МОЗ та АМН «Патологічна фізіологія та імунологія» (протокол № 16 від 5 березня 2002 року).
Мета дослідження. З’ясувати вплив гострої імунокомплексної патології на морфо-функціональний стан мембран кардіоміоцитів, дати їм патофізіологічну оцінку і з’ясувати можливість корекції виявлених змін мембранопротекторами тіотріазоліном і корвітином з метою подальших розробок методичних рекомендацій для використання їх у терапії імунокомплексної патології.
Завдання дослідження.
1. На моделі гострого імунокомплексного процесу дослідити рівень циркулюючих імунних комплексів та загальну комплементарну активність сироватки крові.
2. З’ясувати вплив циркулюючих імунних комплексів на систему пероксидне окиснення ліпідів – антиоксидантний захист при гострій сироватковій хворобі.
3. Дослідити ступінь метаболічних змін у міокарді за даної патології.
4. З’ясувати можливі зміни в системі енергопостачання клітин серця за умов гострої сироваткової хвороби.
5. Дослідити структурні зміни у міокарді за умов гострої сироваткової хвороби.
6. З’ясувати можливість фармакокорекції виявлених метаболічних та структурних змін у міокарді тіотріазоліном та корвітином.
Об’єкт дослідження – гіперімунокомплексний процес, відтворений у морських свинок з використанням моделі гострої сироваткової хвороби.
Предмет дослідження – прямі та опосередковані показники процесів у мембранах кардіоміоцитів морських свинок за умов гострої сироваткової хвороби та при введенні цим тваринам тіотріазоліну і корвітину.
Методи дослідження:
– імунологічні: визначення циркулюючих імунних комплексів різних розмірів та гемолітичної активності комплементу сироватки;
– біохімічні: визначення у сироватці крові концентрації органоспецифічних ферментів (лактатдегідрогеназа, креатинфосфокіназа, аспартатамінотрансфераза), дослідження активності пероксидного окиснення ліпідів (ПОЛ) за вмістом у сироватці крові малонового діальдегіду, дослідження антиоксидантної активності за вмістом у сироватці крові супероксиддисмутази та каталази, визначення кількості сульфгідрильних груп в ендокарді, міокарді та сироватці, визначення пероксидного гемолізу еритроцитів; визначення активності гліколізу за вмістом у сироватці лактату та пірувату;
– морфологічні: загальна світлова та електронна мікроскопія;
– математичні: обробка цифрових даних методом варіаційної статистики з використанням критерію Стьюдента.
Наукова новизна отриманих результатів. Вперше на сучасному методичному рівні вивчено структурні та метаболічні зміни в мембранах кардіоміоцитів за умов гострого імунокомплексного процесу у морських свинок. Вперше досліджено активність мембранних ферментів та органоспецифічних ферментів ураженого міокарда в аналогічних умовах. Вперше досліджено структуру міокарда при імунокомплексній патології і виявлено морфологічні зміни. Виявлені зміни корелюють з прямими та непрямими показниками пошкодження міокарда. Вперше вивчено вплив на ці зміни корвітину та тіотріазоліну. Доведена виражена коригуюча дія обох препаратів на метаболічні та структурні порушення, що виникли за умов гострої сироваткової хвороби (знижується рівень циркулюючих імунних комплексів малих та середніх розмірів, нормалізується гемолітична активність комплементу, знижується активність пероксидного окиснення ліпідів, підвищується антиоксидантна активність, що призводить до стабілізації мембран і активності мембранозалежних ферментів).
Практичне значення отриманих результатів. Результати виконаних досліджень розширюють існуючі уявлення про патогенез імунокомплексних уражень, а також роль у цих механізмах циркулюючих імунних комплексів та продуктів пероксидного окиснення ліпідів, глибину та серйозність метаболічних та морфологічних змін у серці і вплив на ці процеси корвітину та тіотріазоліну. Виражена імуномодулююча, антиоксидантна та мембранопротекторна дія корвітину вказує на доцільність його подальшого вивчення з метою корекції цих порушень за умов патології імунокомплексного ґенезу і розробки методичних рекомендацій.
Результати дослідження впроваджені у навчальний процес на кафедрах патологічної фізіології Львівського національного медичного університету імені Данила Галицького, Державного вищого навчального закладу «Тернопільського державного медичного університету імені І.Я. Горбачевського», Харківського державного медичного університету, Луганського державного медичного університету, на кафедрах патологічної анатомії Львівського національного медичного університету імені Данила Галицького та Державного вищого навчального закладу «Тернопільського державного медичного університету імені І.Я. Горбачевського», а також у практичну медицину у Львівському обласному патанатомічному бюро дитячій патанатомічній лабораторії, що підтверджено відповідними актами впровадження.
Особистий внесок здобувача. За пропозицією нині покійного д.м.н., професора Бідюка М.М. нами проведено дослідження морфо-метаболічних змін у міокарді морських свинок за умов гострої сироваткової хвороби. Наукова робота зроблена та написана, завдячуючи постійній увазі професора Бідюка М.М., його цінним порадам та науковому керівництву. Дисертаційна робота є особистою науковою працею здобувача. Проведено інформаційний і патентний пошук. На основі проведеного літературного огляду автор оцінила сучасний стан проблеми, обґрунтувала актуальність роботи, мету і завдання, вибрала обсяг і методи дослідження, експериментальних тварин, підібрала та опрацювала адекватні моделі і методики. Самостійно виконала всю експериментальну частину роботи. Підготувала матеріал для морфологічних досліджень. Статистично обробила, проаналізувала і узагальнила отримані результати, а також оформила їх у вигляді таблиць та рисунків, сформулювала висновки. В опублікованих зі співавторами наукових працях здобувачу належать основні ідеї, практичний матеріал та їх узагальнення. У тій частині актів впровадження, що стосується науково-практичної новизни, викладено фактичні дані отримані дисертантом.
Апробація результатів дисертації. Основні результати роботи були оприлюднені і обговорені на Пленумі патофізіологів України (Одеса, 2002); Міжнародній науково-практичній конференції присвяченій пам’яті професора І.В. Шостаковської (Львів, 2002); IV Українській науково-практичній конференції з клінічної фармакології (Вінниця, 2004); студентській науково-практичній конференції (Львів, 2005); науково-практичній конференції студентів та молодих вчених (Івано-Франківськ, 2006).
Публікації. Результати дисертації викладено у 10 друкованих працях, з них 5 – у наукових фахових виданнях та 5 – у матеріалах і збірниках конференцій та конгресів.
Обсяг і структура дисертації. Дисертаційна робота викладена на 160 сторінках машинописного тексту і складається зі вступу, 6 розділів, висновків, списку використаних джерел, що нараховує 323 найменування, а також 8 додатків. Робота ілюстрована 20 таблицями, 23 рисунками. Бібліографічний опис літературних джерел та додатки викладені на 42 сторінках.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали та методи дослідження. Досліди виконані на 120 статевозрілих морських свинках-самцях, масою 380–400 г, яких утримували на стандартному раціоні віварію, у зимову пору року. Досліди на тваринах виконувалися з дотриманням ухвали Першого національного конгресу з біоетики про захист хребетних тварин, які використовуються для експериментальних та наукових цілей (Київ, 2001). Комісією з біоетики Львівського національного медичного університету імені Данила Галицького (протокол № 4 від 23 квітня 2007 року) порушень морально-етичних норм при проведенні науково-дослідної роботи не виявлено. Усіх тварин поділили на групи по 20 тварин у кожній: 1 група – інтактні тварини; 2 група – інтактні тварини, які отримували розчин корвітину; 3 група – інтактні тварини, які отримували розчин тіотріазоліну; 4 група – тварини з викликаною гострою сироватковою хворобою; 5 група – тварини з викликаною гострою сироватковою хворобою, які отримували розчин корвітину; 6 група – тварини з викликаною гострою сироватковою хворобою, які отримували розчин тіотріазоліну.
Гострий імунокомплексний процес відтворювали на моделі гострої сироваткової хвороби, яка викликається одноразовим введенням у гомілкову вену задньої лапи морської свинки великої дози бичачого сироваткового альбуміну з розрахунку 500 мг/кг маси (Dixon F.J., Feldman I.D., 1961). Лабораторними критеріями гострої сироваткової хвороби було збільшення вмісту у сироватці крові циркулюючих імунних комплексів малих і середніх розмірів.
Імунологічні зміни оцінювали за кількістю у сироватці крові циркулюючих імунних комплексів різних розмірів (Haљkova V., 1977) та гемолітичною активністю комплементу (Вавилова М.М., 1984).
Особливості метаболічних процесів у міокарді аналізували за прямими та опосередкованими показниками. До прямих показників ураження міокарда належать органоспецифічні ферменти серця (лактатдегідрогеназа, креатинфосфокіназа, аспартатамінотрансфераза, які визначали за загальноприйнятими методами). Опосередкованими показниками змін у міокарді були: активність пероксидного окиснення ліпідів – вміст у сироватці крові малонового діальдегіду (Тимирбулатов Р.А., Селезнев Е.И, 1981), антиоксидантна активність – вміст у сироватці крові супероксиддисмутази (Костюк В.А., 1990) та каталази (Королюк М.А., 1988); індекс антиокисної активності біологічного матеріалу (Мартинюк В.Б., Ковальчук С.Н., 1991); кількість сульфгідрильних груп в ендокарді, міокарді та сироватці (Фоломеев В.Ф., 1981); стан клітинних мембран оцінювали за відсотком гемолізованих еритроцитів (Гжегоцький М.Р., Ковальчук С.М., 2002); показники активності гліколізу – вміст у сироватці лактату та пірувату (Horost H.J., 1965).
Ступінь структурних змін оцінювали за результатами світлової та електронної мікроскопії (за загальноприйнятими методами).
Виявлені зміни коригували тіотріазоліном і корвітином. Обидва препарати вводили доочеревинно 1 раз на добу, протягом 10 днів: корвітин вводився в разовій дозі 40 мг/кг (Максютина Н.П., Мойбенко О.О., 2000), а тіотріазолін – в разовій дозі 50 мг/кг (Піняжко О.Р., Кайдашев І.П., 1997).
Досліджуваний середник тіотріазолін (Т) виробляється АТ «Галичфарм» у місті Львові. Він є гепато- і кардіопротектором. Його фармакологічна дія зумовлена: антиішемічними, мембраностабілізуючими, антиоксидантними і імуномодулюючими властивостями (Визир А.Д., 1993; Піняжко О.Р., 1997; Нейко Е.М., 1998; Визир А.Д., 2002).
Препарат корвітин – натуральний екстракт із класу біофлавоноїдів з: антигістамінною дією (блокує вироблення гістаміну, серотоніну та лейкотрієнів); протизапальною та протинабряковою дією; антиоксидантною дією (блокує вільні радикали як ендогенного так і екзогенного походження); стабілізує клітинні мембрани, знижує проникність капілярів; (Визир В.А., 1999; Калиман П.Л., 2001, Мойбенко А.А., 1995; Марков А.Г., 2002). Ми використовували парентеральну форму «Корвітин»®, що випускає Борщагівський хімфармзавод.
Статистичний аналіз отриманих результатів проводився за допомогою методу варіаційної статистики (Минцер О.П., Угаров Б.Н., 1991) використовуючи t‑критерій Стьюдента для оцінки достовірності відмінностей груп даних. Статистично достовірними вважалися результати, для яких Р ≤ 0,05.
Основні результати досліджень та їх обговорення. При вивченні особливостей розвитку гострого імунокомплексного процесу (ГІКП) було виявлено достовірне зростання показників циркулюючих імунних комплексів малих розмірів на 21% (Р < 0,001) та середніх на 39% (Р < 0,001). Одночасно з цим, знизилися показники гемолітичної активності комплементу (ГАК) на 23% (Р < 0,001), що свідчить про залучення його у патологічний процес.
Розвиток гострої сироваткової хвороби викликав дисбаланс у системі пероксидне окиснення ліпідів – антиоксидантний захист. Як видно з табл. 1 достовірно зріс рівень малонового діальдегіду (МДА) на 44% (Р < 0,02), зросли індекс антиоксидантної активності (ІАОА) на 60% (Р < 0,001) та активність каталази (Кат) на 11% (Р < 0,001), одночасно з цим, активність супероксиддисмутази (СОД) у крові знизилася на 29% (Р < 0,01). Кількість сульфгідрильних груп (-SH-груп) у тварин з гострою сироватковою хворобою зменшилася на 55% як в ендокарді (Р < 0,001), так і в міокарді (Р < 0,001), проте їх кількість у сироватці крові зросла на 25% (Р < 0,001).
Підвищений рівень патогенних циркулюючих імунних комплексів, компоненти комплементу та розбалансованість між процесами ліпопероксидації і антиоксидантною активністю викликали зміни у структурі мембран кардіоміоцитів, що супроводжується достовірним збільшенням у сироватці крові показників активності органоспецифічних ферментів. А саме активність креатинфосфокінази зросла в 1,9 разів (Р < 0,01), активність аспартатамінотрансферази – в 1,3 рази (Р < 0,01), і активність лактатдегідрогенази – у 1,5 рази (Р < 0,01).
Таблиця 1
Характеристика опосередкованих показників пошкодження клітинних мембран кардіоміоцитів у морських свинок за умов гострої сироваткової хвороби (М ± m; n = 20)
| Показник | Контроль | Дослід | Р |
| МДА, мкмоль/мл | 70,67 ± 0,74 | 102,0 ± 12,1 | 0,02 |
| ІАОА | 2,85 ± 0,04 | 4,57 ± 0,35 | 0,001 |
| СОД, од.акт./млЧхв | 458,47 ± 21,69 | 326,29 ± 12,90 | 0,001 |
| Каталаза, нмоль Н2О2/млЧгод. | 0,036 ± 0,001 | 0,040 ± 0,001 | 0,001 |
| SH-cироватка, мкмоль | 0,109 ± 0,005 | 0,136 ± 0,005 | 0,001 |
| SH-ендокард, мкмоль | 26,26 ± 1,33 | 11,72 ± 1,16 | 0,001 |
| SH-міокард, мкмоль | 10,57 ± 0,44 | 4,72 ± 0,72 | 0,001 |
| ПГЕ, % гемолізу | 8,82 ± 0,25 | 12,08 ± 0,29 | 0,001 |
| Примітка: Р – достовірність змін у порівнянні з контролем. | |||
Враховуючи, що еритроцитарні мембрани розглядаються як прототип плазматичних мембран всіх клітин організму, то зміна їх проникності може відображати зміни проникності мембран кардіоміоцитів. Стан мембран оцінювали за відсотком гемолізованих еритроцитів (ПГЕ) і було виявлено, що в дослідній групі цей показник зростає на 37% (Р < 0,001), отже проникність мембран кардіоміоцитів збільшилася.
Розвиток гострої сироваткової хвороби супроводжувався змінами в енергопостачанні кардіоміоцитів. Вміст у сироватці крові молочної кислоти зріс на 13% (Р < 0,05), а концентрація піровиноградної кислоти збільшилася на 70% (Р < 0,001) у порівнянні з інтактною групою тварин.
При морфологічному дослідженні тканин серця було виявлено нерівномірну за поширеністю дистрофію паренхіматозних структур. Переважно субендокардіально та в папілярних м’язах визначалися дистрофічно трансформовані кардіоміоцити аж до вакуолізації цитоплазми частини з них. Міжм’язові проміжки нерівномірно поширені за рахунок набряку інтерстицію та крововиливів.
При вивченні ультратонких зрізів тканини міокарда були виявлені наступні зміни (див. рис. 1).
Мітохондрії кардіоміоцитів з дещо підвищеною електронною щільністю, дезорганізовані, а саме, розпушені кристи внутрішньої мембрани. Частина мітохондрій містить значні ділянки електронно-світлих гомогенних мас. Саркоплазма має знижену електронну щільність внаслідок підвищеного вмісту рідини. Кількість рибосом та полісом знижена, у значній кількості наявні краплі ліпопротеїдів низької щільності. У саркомерах міофібрил Z-смуги не чіткі, а також порушена структурна орієнтація волокон актину та міозину. Сарколема, переважно, згладжена, а в окремих ділянках її електронна щільність підвищена. Каріотека ядер кардіоміоцитів на більшості ділянок дезорганізована, особливо тих, що прилягають до гіпертрофованого апарату Гольджі. Останній містить збільшену кількість розширених цистерн, мікроміхурців, первинних лізосом, мультивезикулярних тілець.
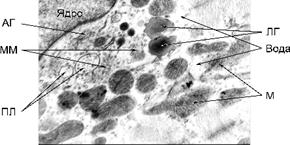
Рис. 1. Будова кардіоміоцита у морських свинок за умов гострої сироваткової хвороби (набряк мітохондрій та саркоплазми, релаксовані міофібрили): М – мітохондрії; ПЛ – первинні лізосоми; АГ – апарат Гольджі; ЛГ – ліпопротеїнові гранули; ММ – мікроміхурці; Зб. – Ч 21000
Отже, патогенний вплив на серце імунні комплекси здійснюють декількома шляхами. По-перше: активують систему комплементу, а по-друге звільняють численні біологічно активні речовини, які індукують надмірне пероксидне окиснення ліпідів. Недостатня активність антиоксидантного захисту призводить не лише до пригнічення окислювального фосфорилювання та гліколізу, а й до порушення структури і функції плазматичних та цитоплазматичних мембран, що в свою чергу спричинює порушення функції клітин, а можливо і їх загибель.
Питання терапії гострого імунокомплексного процесу є досить складним і суперечливим. Ми в експерименті намагалися оцінити вплив на цей процес тіотріазоліну (Т) та корвітину (К), попередньо дослідивши вплив цих препаратів на інтактний організм, щоб виключити можливий дисрегуляторний ефект на механізм імунної відповіді.
Було встановлено, що лише корвітин проявив імуномодулюючі властивості, достовірно знизивши кількість імунних комплексів середніх та малих розмірів, а також підвищивши активність комплементу.
При дослідженні впливу тіотріазоліну і корвітину на метаболізм у кардіоміоцитах було виявлено, що обидва препарати проявляють антиоксидантну дію, достовірно знижуючи в сироватці крові рівень малонового діальдегіду. Також вони є інгібіторами антиоксидантної системи. Так тіотріазолін підвищує активність каталази та кількість сульфгідрильних груп у міокарді. У корвітина цей вплив виражений дещо більше. Він збільшує активність каталази та супероксиддисмутази, також зростає індекс антиоксидантної активності та кількість сульфгідрильних груп у ендокарді. Відсоток гемолізованих еритроцитів був у межах норми на фоні введення обох препаратів. На процеси гліколізу жоден з препаратів не вплинув.
Наступним етапом дослідження було з’ясувати можливість корекції тіотріазоліном та корвітином виявлених структурно-метаболічних змін у кардіоміоцитах за умов гострої сироваткової хвороби.
Вплив препаратів на імунну систему представлений у табл. 2.
Таблиця 2
Характеристика показників ЦІК та гемолітичної активності комплементу сироватки крові у морських свинок з гострою сироватковою хворобою, які отримували розчин тіотріазоліну та корвітину (М ± m; n = 20)
| Показник | Контроль | Дослід | Дослід + Т | Дослід + К |
| ЦІК великі, од. опт. густ. | 61,00 ± 5,00 | 53,00 ± 5,00 | 60,00 ± 5,00 | 69,00 ± 3,00* |
| ЦІК середні, од. опт. густ. | 206,00 ± 13,00 | 287,00 ± 12,00 | 264,00 ± 10,00° | 228,00 ± 4,00* |
| ЦІК малі, од. опт. густ. | 354,00 ± 9,00 | 430,00 ± 19,00 | 459,00 ± 15,00° | 350,00 ± 15,00* |
| ГАК, гемол.од.СН50 | 83,70 ± 4,26 | 64,13 ± 3,33 | 76,10 ± 4,55* | 80,48 ± 4,26* |
| Примітка: * – достовірність різниці показників у порівнянні з дослідними тваринами; ° – достовірність різниці показників у порівнянні з контролем. | ||||
У тварин з гострою сироватковою хворобою, які отримували розчин тіотріазоліну достовірно збільшився лише показник гемолітичної активності комплементу (ГАК) на 19% (Р < 0,05). У групі тварин, які отримували розчин корвітину достовірно знизилися показники ЦІК середніх та малих розмірів на 21% (Р < 0,001) і 19% (Р < 0,005) відповідно, хоча показник ЦІК великих розмірів зріс на 30% (Р < 0,01). Показник гемолітичної активності комплементу стабілізувався до контрольних цифр (Р < 0,005).
На фоні введення тіотріазоліну тваринам з гострою сироватковою хворобою змін зі сторони ПОЛ не спостерігалося (див. табл. 3). Проте була позитивна динаміка в антиоксидантній системі. При цьому індекс антиоксидантної активності знизився на 14% порівняно з дослідними тваринами, але не наблизився до контрольних цифр. Достовірно підвищилися показники активності СОД на 56% (Р < 0,01) та каталази на 62% (Р < 0,001).
Таблиця 3
Характеристика опосередкованих показників пошкодження клітинних мембран міокарда у морських свинок з гострою сироватковою хворобою після введення розчинів тіотріазоліну та корвітину (М ± m; n = 20)
| Показник | Контроль | Дослід | Дослід + Т | Дослід + К |
| МДА, мкмоль/мл | 70,67 ± 0,74 | 102,0 ± 12,1 | 99,36 ± 10,74° | 81,40 ± 5,39° |
| ІАОА | 2,85 ± 0,04 | 4,57 ± 0,35 | 3,94 ± 0,43° | 2,53 ± 0,09* |
| СОД, од.акт./млЧхв | 458,47 ± 21,69 | 326,29 ± 12,9 | 509,37 ± 60,68* | 513,56 ± 14,65*° |
| Кат.ммольН2О2/ млЧгод | 0,036 ± 0,001 | 0,040 ± 0,001 | 0,065 ± 0,002*° | 0,035 ± 0,001* |
| SH-сироватка, мкмоль | 0,109 ± 0,005 | 0,136 ± 0,005 | 0,066 ± 0,003*° | 0,063 ± 0,003*° |
| SH-ендокард, мкмоль | 26,26 ± 1,33 | 11,72 ± 1,16 | 16,85 ± 1,36*° | 19,01 ± 0,82*° |
| SH-міокард, мкмоль | 10,57 ± 0,44 | 4,72 ± 0,72 | 14,91 ± 1,03*° | 12,25 ± 0,56*° |
| ПГЕ, % | 8,82 ± 0,25 | 12,08 ± 0,29 | 5,26 ± 0,40*° | 7,55 ± 0,31*° |
| Примітка: * – достовірність різниці показників у порівнянні з дослідними тваринами; ° – достовірність різниці показників у порівнянні з контролем. | ||||
Введення корвітину тваринам з гострою сироватковою хворобою викликало деяке пригнічення ПОЛ та активувало антиоксидантний захист. Як видно з табл. 3, кількість МДА мав тенденцію до зниження на 20%. Одночасно знижується індекс антиоксидантної активності на 45% (Р < 0,001) та активність каталази – на 13% (Р < 0,001). Проте, активність супероксиддисмутази зростає на 57% (Р < 0,001).
Під впливом як корвітину, так і тіотріазоліну в обох групах дослідних тварин достовірно знизився відсоток гемолізованих еритроцитів (Р < 0,05), (див. табл. 3).
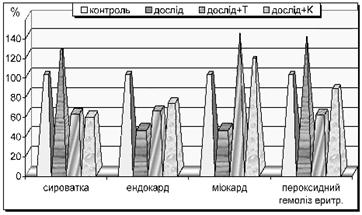
Рис. 2. Зміни вмісту SH-груп у різних середовищах організму та перекисного гемолізу еритроцитів у тварин з гострою сироватковою хворобою під впливом тіотріазоліну і корвітину
Підвищена активність антиоксидантного захисту сприяла окисно-відновним перетворенням -SH-груп (див. табл. 3, рис. 2). Під впливом обидвох препаратів (тіотріазолін і корвітин) достовірно (Р < 0,001) зросла кількість сульфгідрильних груп в ендокарді та міокарді, одночасно з тим, зменшилася їх кількість у сироватці крові.
Як видно з табл. 4, введення як тіотріазоліну, так і корвітину тваринам із гострою сироватковою хворобою призводить до достовірного (Р < 0,05) зниження активності всіх органоспецифічних ферментів міокарда і наближенням цих показників до відповідних у контрольних тварин, що може свідчити про зменшення пошкодження кардіоміоцитів.
Таблиця 4
Характеристика активності органоспецифічних ферментів ураження міокарда у морських свинок з гострою сироватковою хворобою після введення тіотріазоліну і корвітину (М ± m; n = 20)
| Показник | Контроль | Дослід | Дослід + Т | Дослід + К |
| ЛДГ, Од/л | 28,90 ± 2,04 | 45,04 ± 2,79 | 27,77 ± 2,02* | 29,96 ± 2,49* |
| КФК, Од/л | 1,76 ± 0,18 | 3,37 ± 0,24 | 1,79 ± 0,13* | 1,78 ± 0,27* |
| АсАТ, Од/л | 37,99 ± 2,47 | 50,32 ± 3,17 | 39,38 ± 2,10* | 38,25 ± 2,39* |
| Примітка: * – достовірність різниці показників у порівнянні з дослідними тваринами. | ||||
При оцінюванні вмісту продуктів гліколізу у кардіоміоцитах було встановлено (див. табл. 5), що введення тіотріазоліну тваринам з ГСХ спричинило зростання концентрації молочної кислоти в 1,6 рази (Р < 0,001), та зниження концентрації піровиноградної кислоти у 2 рази (Р < 0,001). Після введення корвітину в показниках процесу гліколізу виявлено наступні зміни: кількість молочної кислоти достовірно зменшилася на 18% (Р < 0,001), а кількість піровиноградної кислоти зменшилася на 22% (Р < 0,01).
Таблиця 5
Вміст продуктів гліколізу у сироватці крові морських свинок з гострою сироватковою хворобою після введення тіотріазоліну (М ± m; n = 20)
| Показник | Контроль | Дослід | Дослід + Т | Дослід + К |
| Лактат, ммоль/л | 0,83 ± 0,05 | 0,94 ± 0,02 | 1,50 ± 0,12*° | 0,77 ± 0,03* |
| Піруват, ммоль/л | 0,051 ± 0,008 | 0,087 ± 0,006 | 0,044 ± 0,005* | 0,068 ± 0,004* |
| Примітка: * – достовірність різниці показників у порівнянні з дослідними тваринами; ° – достовірність різниці показників у порівнянні з контролем. | ||||
Для підтвердження позитивної динаміки змін у серці тваринам, яким вводили корвітин та тіотріазолін за умов гострої сироваткової хвороби, було проведено морфологічне дослідження тканин серця. Співвідношення між кардіоміоцитами та пухкою сполучною тканиною збережене. Відсутній спазм артеріальних судин дрібного та середнього калібру. Наявні незначні ділянки пухкої сполучної тканини з інфільтрацією мононуклеарами.
Отже, на основі проведених досліджень встановлено, що у патогенезі імунокомплексних захворювань провідна роль належить циркулюючим імунним комплексам. Патогенний вплив на серце імунні комплекси здійснюють декількома шляхами. По-перше: ініціююча дія імунних комплексів проявляється в активації системи комплементу, а по-друге: під впливом імунних комплексів відбувається активація деяких клітин крові. У процесі активації утворюються чисельні біологічно активні речовини, які зумовлюють пошкодження тканин у зв’язку з посиленням фагоцитозу та лізосомальної активності та спостерігається «респіраторний вибух», який характеризується утворенням надмірної кількості вільних радикалів. Як результат, посилюється перекисне окиснення ліпідів, яке є типовим мембранним механізмом патологічних процесів та хвороб. Експериментальні дослідження і клінічна практика виявили, що пероксидному пошкодженню структур, в основному, запобігає антиоксидантна система. Але за умов гострої сироваткової хвороби її активність недостатня.
Нагромадження в організмі кінцевого продукту пероксидного окиснення ліпідів (малонового діальдегіду), порушення його нейтралізації та утилізації прямо пов’язано з функціонуванням тіодисульфідної окисно-відновної системи, компонентами якої є сульфгідрильні (-SH) групи білків. Відомо, що порушення окисно-відновних перетворень SH-груп призводить до радикальної перебудови режимів життєдіяльності клітини, інтенсивності метаболізму, активації та інактивації багатьох біологічно активних речовин. При гострій сироватковій хворобі значно знижується вміст сульфгідрильних груп у ендокарді та міокарді і одночасно підвищується їх кількість у сироватці. Це свідчить про те, що пероксидні радикали, які утворилися в надмірній кількості: по-перше здійснили пероксидну модифікацію амінокислотних залишків (в першу чергу -SH-груп) мембранних білків, у тому числі і тих, які розташовані в активному центрі ферментів; по-друге здійснили конформаційні зміни у білкових молекулах крові; по-третє знизили компенсаторні можливості систем детоксикації.
Внаслідок розбалансованості між процесами пероксидного окиснення ліпідів та антиоксидантною активністю кількісні зміни переходять у якісні. Порушується структура мембран кардіоміоцитів. Як результат у крові підвищується активність всіх органоспецифічних для серця ферментів (креатинфосфокінази, лактатдегідрогенази, аспартатамінотрансферази).
Зміни метаболізму підтверджуються морфологічними змінами у тканинах серця.
Окиснення кінцевих продуктів розпаду білків, ліпідів, вуглеводів за допомогою кисню, перенесення електронів і трансформація енергії відбувається за допомогою мітохондрій. Тому порушення структури останніх призводить до погіршення енергопостачання клітини, що, у свою чергу, спричинює порушення її функції. Зростання концентрації пірувату свідчить про те, що порушується його утилізація і піруват майже повністю перетворюється на лактат. Зростання концентрації лактату в крові свідчить про переважне використання анаеробних шляхів синтезу енергії – піруват відновлюється до лактату. Лактат це кінцевий продукт гліколізу в анаеробних умовах, який виділяється через ендоплазматичну мембрану. Водночас, тривале виділення лактату призводить до виникнення у клітині лактат-ацидозу, який спричинює порушення функції клітини, зокрема кардіоміоцита.
Порушення, які виникли у міокарді достатньо добре коригувалися як тіотріазоліном, так і корвітином.
Імуномодулюючу та антиоксидантну дію за умов гострої сироваткової хвороби проявив лише корвітин. Проте обидва препарати проявили індукторні властивості, щодо антиоксидантної системи. Посиливши активність антиоксидантних ферментів і тіодисульфідної окисно-відновної системи вони сприяли нормалізації метаболізму у кардіоміоцитах та захистили структури мембран від дії продуктів ліпопероксидації. Це підтверджується показниками активності органоспецифічних ферментів, які були в межах норми. Завдяки своїй мембранопротекторній дії корвітин і тіотріазолін зменшили відсоток гемолізованих еритроцитів. Це все сприяло покращенню енергопостачання клітин і перехід з анаеробного типу енергозабезпечення на аеробний, який спостерігається за нормальних умов.
Результати морфологічних досліджень підтвердили позитивну динаміку у перебігу гострої сироваткової хвороби.
Отже, при імунокомплексних захворюваннях є доцільним використовувати препарати з антиоксидантними та мембранопротекторними властивостями, оскільки вони позитивно впливають на перебіг імунокомплексної патології і зменшують структурні зміни в уражених органах, зокрема у серці.
ВИСНОВКИ
У дисертаційній роботі теоретично узагальнено і по новому вирішено наукове завдання, яке відображене у встановленні змін в мембранах клітин, зокрема кардіоміоцитів за умов гострого імунокомплексного процесу, а також механізми і наслідки впливу циркулюючих імунних комплексів на клітини серця та морфологічні зміни в серці за даної патології.
Запропоновані нові підходи до корекції порушень, зумовлених імунокомплексною патологією, за допомогою тіотріазоліну та корвітину.
У результаті вирішення наукового завдання встановлено такі наукові і прикладні висновки:
1. За умов експериментальної гострої сироваткової хвороби зросли показники циркулюючих імунних комплексів середніх та малих розмірів на 39% (Р < 0,001) та 21% (Р < 0,001) відповідно, що підтверджує імунокомплексне походження пошкоджень. Одночасно з цим, знизилися показники гемолітичної активності комплементу на 23% (Р < 0,001), що свідчить про його участь у патологічному процесі.
2. Розвиток гострої сироваткової хвороби супроводжується наростанням активності пероксидного окиснення ліпідів, та зниженням антиоксидантного захисту, що призводить до зниженням кількості сульфгідрильних груп в міокарді та ендокарді, це свідчить про порушення окисно-відновних перетворень у цих органах. Також зріс відсоток гемолізованих еритроцитів (Р < 0,001), це свідчить про підвищення проникливості клітинних мембран, зокрема, кардіоміоцитів.
3. Достовірно у сироватці крові тварин із гострою сироватковою хворобою зросла активність органоспецифічних ферментів серця: креатинфосфокінази в 1,9 разів (Р < 0,01), аспартатамінотрансферази – в 1,3 рази (Р < 0,01) і лактатдегідрогенази – в 1,5 рази (Р < 0,01), що свідчить про порушення структури та підвищення проникності клітинних мембран.
4. Патоморфологічні зміни в серці за умов гострої сироваткової хвороби характеризуються альтеративно-ексудативними явищами, які супроводжуються порушенням структури плазматичних та цитоплазматичних мембран і мають гострий характер.
5. У інтактному організмі морських свинок тіотріазолін проявляє антиоксидантну дію, достовірно знижуючи активність процесів пероксидного окиснення ліпідів (Р < 0,05) та є індуктором антиоксидантної системи, достовірно підвищуючи її активність (Р < 0,05).
6. Корвітин у інтактних тварин проявляє імуномодулюючу дію, достовірно знижуючи кількість циркулюючих імунних комплексів середніх та малих розмірів (Р < 0,05) і активуючи систему комплементу. Виявляє антиоксидантну активність, знижуючи активність процесів ліпопероксидації (Р < 0,05) та посилює активність ферментів антиоксидантної системи (Р < 0,05).
7. Тіотріазолін у тварин з гострою сироватковою хворобою проявив позитивний вплив на структурно-метаболічні зміни у міокарді завдяки своїм мембранопротекторним властивостям та здатності активувати антиоксидантні ферменти.
8. Корвітин також мав позитивний вплив на виявлені зміни за умов гострої сироваткової хвороби завдяки своїм імуномодулюючим, антиоксидантним та мембранопротекторним властивостям, а також здатності активувати антиоксидантний захист.
9. При введенні тваринам з гострою сироватковою хворобою розчинів корвітину та тіотріазоліну зафіксовано позитивну динаміку змін у серці: відсутність альтеративно-ексудативних змін і поява продуктивної тканинної реакції.
СПИСОК ОПУБЛІКОВАНИХ НАУКОВИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Пороховська Н.В., Бідюк М.М., Казановська Н.Ф. Стан перекисного окислення ліпідів та антиоксидантного захисту при імунокомплексному ураженні серця // Експериментальна та клінічна фізіологія і біохімія. – 2002. – № 4. – С. 77–81. (Здійснила моделювання гострої сироваткової хвороби, провела забір досліджуваного матеріалу, провела імунологічні та біохімічні дослідження, статистичну обробку отриманих результатів, сформувала висновки, підготувала статтю до друку).
2. Пороховська Н.В., Бідюк М.М., Найда Л.Я. Патоморфологічні зміни в серці морських свинок при гострій та хронічній сироватковій хворобі // Вісник наукових досліджень. – 2004. – № 1. – С. 97–98. (Здійснила моделювання гострої сироваткової хвороби, провела забір досліджуваного матеріалу, брала участь у морфологічних дослідженнях, сформувала висновки, підготувала статтю до друку).
0 комментариев