Навигация
Молекулярні механізми перенесення сигналів регуляторів функції кори надниркових залоз
ІНСТИТУТ ЕНДОКРИНОЛОГІЇ ТА ОБМІНУ РЕЧОВИН
ІМ. В.П.КОМІСАРЕНКА АМН УКРАЇНИ
Ковзун Олена Ігорівна
УДК 612.453-092.9:576.32/.36
МОЛЕКУЛЯРНІ МЕХАНІЗМИ ПЕРЕНЕСЕННЯ СИГНАЛІВ РЕГУЛЯТОРІВ ФУНКЦІЇ КОРИ НАДНИРКОВИХ ЗАЛОЗ
14.01.14 – ендокринологія
Автореферат
дисертації на здобуття наукового ступеня доктора
біологічних наук
Київ – 2008
Дисертацією є рукопис.
Робота виконана у відділі патофізіології ендокринної системи Інституту ендокринології та обміну речовин ім. В.П. Комісаренка АМН України.
Науковий консультант – доктор медичних наук, професор,
член-кореспондент НАН та АМН України
ТРОНЬКО Микола Дмитрович, Інститут ендокринології та
обміну речовин ім. В.П. Комісаренка АМН України,
завідувач відділу патофізіології ендокринної системи.
Офіційні опоненти:
доктор медичних наук, професор,
член-кореспондент НАН та АМН України
РЕЗНІКОВ Олександр Григорович, Інститут ендокринології та
обміну речовин ім. В.П. Комісаренка АМН України,
завідувач відділу ендокринології репродукції та адаптації;
доктор біологічних наук, професор
ДРОБОТ Людмила Борисівна, Інститут біохімії
ім. О.В. Палладіна НАН України,
завідувач лабораторії сигнальних механізмів клітини;
доктор медичних наук, старший науковий співробітник
ХИЖНЯК Оксана Олегівна, Державна установа Інститут проблем ендокринної патології ім. В.Я. Данилевського АМН України,
завідувач відділу клінічної ендокринології.
Захист відбудеться 25.03. 2008 р. о 13 год. на засіданні
спеціалізованої вченої ради Д 26.558.01 з ендокринології в Інституті
ендокринології та обміну речовин ім. В.П. Комісаренка АМН України
(04114, м. Київ-114, вул. Вишгородська, 69).
З дисертацією можна ознайомитись у бібліотеці Інституту ендокринології та обміну речовин ім. В.П. Комісаренка АМН України (04114, м. Київ-114, вул. Вишгородська, 69).
Автореферат розісланий 21.02.2008 р.
Вчений секретар
спеціалізованої вченої ради,
доктор біологічних наук Калинська Л.М.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. При розгляді дистантних хімічних сигналів, що сприймаються клітиною, віднесення гормонів до особливої категорії поступово втрачає сенс. По-перше, встановлено, що деякі класичні гормони, можливо значна їх частина, продукуються в багатьох тканинах організму, а не тільки в спеціалізованих залозах. По-друге, з’ясувалося, що низка біорегуляторів не мають різниці за механізмами дії на клітину порівняно з гормонами і навіть володіють еволюційною спорідненістю з ними. Мова йде в першу чергу про ростові чинники, цитокіни і нейропептиди, що також здійснюють свою дію через специфічні клітинні рецептори. Базисна парадигма клітинної ендокринології у зв’язку з цим істотно розширилася. Так, зараз вважається, що класична ендокринна регуляція клітинних функцій є лише одним з її різновидів. Існують також, як мінімум, паракринний і аутокринний типи регуляції. Перегляд зазначених теоретичних постулатів, з одного боку, привів базисні уявлення в більшу відповідність з реальністю, з іншого боку, розділи, присвячені молекулярній біології клітини, ендокринології, імунології, нейробіології і експериментальній онкології, зараз важко відокремити. Ще більшу спільність процесів, що вивчаються цими розділами науки, виявлено завдяки бурхливому прогресу в з’ясуванні внутрішньоклітинних механізмів дії біорегуляторів. Спільність ця базується на тому, що процес перенесення інформації від рецепторів на внутрішньоклітинні ланки не залежить від того, чи йде мова про рецептор гормону або іншого біорегулятора. Всі вони використовують спільні сигнальні каскади шляхом активації одного або декількох з безлічі неймовірно складних внутрішньоклітинних механізмів обробки і перенесення регуляторної інформації.
Протягом багатьох років вважалося, що регуляція функції надниркових залоз здійснюється за допомогою двох факторів: АКТГ, який головним чином контролює глюкокортикоїдну функцію, та ангіотензину II, який є основним регулятором мінералокортикоїдної функції. Але функція надниркових залоз може регулюватися не тільки через вплив на швидкість стероїдогенезу, але й шляхом зміни маси функціонуючої залози. У зв’язку з цим регуляція мітогенезу та апоптозу також може робити свій внесок до загальної функціональної відповіді надниркових залоз. Цей аспект привернув увагу дослідників лише в останні роки. Тривалий час внутрішньоклітинний механізм дії основних стероїдогенних регуляторів здавався досить чітким: ефекти АКТГ опосередковуються через cAMP-залежний каскад протеїнкінази А, а ангіотензину ІІ – через фосфоінозитидний цикл із залученням протеїнкінази С, а також шляхом регуляції транспорту Са2+[Gallo-Payet et al., 2003; Vinson et al., 1992]. Проте дослідження останніх років показали, що cAMP-залежна система перенесення сигналу АКТГ взаємно регулюється сигнальним каскадом, залежним від протеїнкінази С. В той же час зміни активності протеїнкінази С при різних патологіях надниркових залоз, участь окремих ізоформ протеїнкінази С у перенесенні сигналу АКТГ, їх розподіл у різних клітинних компартментах залишаються нез’ясованими.
До факторів регуляції адренокортикальної функції відносяться також естрогени. Естрогени здатні безпосередньо впливати на кору надниркових залоз, а також змінювати чутливість гіпофіза до КРФ та інших нейропептидів гіпоталамуса. Про прямий вплив естрогенів на кору надниркових залоз свідчить наявність рецепторів естрогенів у клітинах кори надниркових залоз щурів, а також стимуляція секреції кортизолу адренокортикоцитами людини за умов відсутності АКТГ [Caticha et al., 1993]. До останнього часу аналіз механізмів впливу естрогенів на клітини різних типів здебільшого був сконцентрований на геномних ефектах. Між тим, участь систем вторинних месенджерів у цих процесах не аналізувалась. Зараз розглядається можливість участі як cAMP-залежної системи перенесення сигналу естрогенними гормонами, так і МАР-кіназної в різних типах клітин, зокрема тих, що не відносяться до репродуктивної сфери [Aronica et al., 1994; Vivacqua et al., 2006; Ronda et al., 2007]. Водночас месенджерні механізми, що опосередковують дію естрогенів у надниркових залозах, залишаються невідомими.
Як ймовірні модулятори адренокортикальної функції зараз привертають увагу N-ацильовані похідні етаноламіну (NАЕ) [Гула та ін., 2000; Pagotto et al., 2006]. Дослідження розподілу мічених [14C]-NAE в організмі експериментальних тварин продемонструвало переважне включення мітки до надниркових залоз. Оскільки в мозку виявлено незначну кількість міченого N-пальмітоїлетаноламіну, малоймовірно, щоб ця сполука впливала на стимуляцію утворення АКТГ. Внутрішньоклітинні механізми впливу NАЕ на кору надниркових залоз потребують подальшого дослідження. З’ясування основних етапів перенесення сигналу похідних етаноламінів є важливим для визначення їх місця та значення в системі регуляції функції кори надниркових залоз.
В регуляції адренокортикальної функції значну роль відіграють іони калію. Відомо, що К+ здатний активувати гормонопоез при підвищенні його вмісту в крові або інкубаційному середовищі. Крім того, він є необхідним компонентом модулювання ефектів інших регуляторів, в першу чергу ангіотензину II та кортикотропіну. Основною ланкою в опосередкуванні ефектів калію в клітинах клубочкової зони кори надниркових залоз вважається каскад, пов’язаний з Са2+/кальмодулін-залежною протеїнкіназою [Ganguly et al., 1992; Condon et al., 2002]. Проте істотна кількість накопичених фактів не відповідає класичній схемі регуляції кортикостероїдогенезу, що свідчить про необхідність поглибленого дослідження регуляції стероїдогенних процесів в адренокортикоцитах, зокрема іонами калію.
Таким чином, перелік модуляторів адренокортикальної функції постійно зростає і регуляція функції кори надниркових залоз в організмі на сьогодні виглядає значно складнішою, ніж це уявлялося раніше. Поліморфність протеїнкіназних каскадів, їх взаємодія, включення внутрішньоядерних механізмів забезпечують адекватну регуляцію функції адренокортикоцитів. У зв’язку з цим стає зрозумілим, що з’ясування місця кожного з регуляторів адренокортикальної функції у комплексному механізмі регуляції функції надниркових залоз та простеження поетапної передачі сигналу первинних месенджерів за участю клітинних протеїнкіназ є важливим питанням молекулярної ендокринології.
Зв’язок роботи з науковими програмами, планами, темами. Робота проводилась в рамках наукової тематики лабораторії гормональної регуляції обміну речовин відділу патофізіології Інституту ендокринології ім. В.П. Комісаренка АМН України (№ держреєстрації UА 01003067 Р, тема “Розробка підходів до підвищення ефективності лікування хвороби Іценка-Кушинга, пухлин надниркових залоз людини, а також раку молочної залози та простати” 1992-1994 рр.; № держреєстрації 0198U001283, тема “Роль метаболізму фосфоліпідів в перенесенні сигналів агоністів та модуляторів в клітинах кори надниркових залоз” 1998-2000 рр.; № держреєстрації 0101U000618, тема “Аналіз біохімічних механізмів перенесення регуляторних сигналів у клітинах кори надниркових залоз тварин та пухлин надниркових залоз людини” 2001-2004 рр.; № держреєстрації 0105U000732, тема “Пострецепторна регуляція функції надниркових залоз різними модуляторами в умовах норми та патології” 2005-2007 рр.).
Мета дослідження. З’ясувати основні етапи внутрішньоклітинного перенесення сигналів регуляторів та модуляторів адренокортикальної функції – АКТГ, естрадіолу, іонів калію, N-ацильованих похідних етаноламіну для визначення їх впливу на систему функціональної відповіді кори надниркових залоз.
Для реалізації поставленої мети необхідно було вирішити такі завдання:
1. Вивчити внутрішньоклітинні механізми передачі сигналу АКТГ у адренокортикоцитах:
- шлях, пов’язаний з активацією cAMP-залежної протеїнкінази А в тканинах кори надниркових залоз людини;
- процеси активації протеїнкінази С в різних клітинних компартментах адренокортикоцитів та розподіл різних ізоформ протеїнкінази С за субклітинними фракціями у клітинах пухлин надниркових залоз людини;
- рівень експресії рецепторних тирозинкіназ у пухлинах надниркових залоз людини;
- можливість реалізації ефектів кортикотропіну через МАР-кіназний сигнальний каскад;
- значення ядерних факторів транскрипції jun та fos в реалізації ефектів АКТГ;
- участь АКТГ в реалізації апоптичної відповіді в адренокортикальній тканині.
2. З’ясувати можливість перенесення сигналу естрадіолу негеномним шляхом:
- участь циклічних нуклеотидів, протеїнкіназ А та С, МАР-кіназ та ядерних факторів транскрипції в перенесенні сигналу естрадіолу в клітинах кори надниркових залоз;
- зміни рівня нуклеїнових кислот в основних ланках гіпоталамо-гіпофізарно-адренокортикальної системи – гіпоталамусі, гіпофізі та корі надниркових залоз.
3. Дослідити участь в регуляції стероїдогенезу N-ацильованих похідних етаноламіну (NAE) як активаторів внутрішньоклітинних систем перенесення сигналу у корі надниркових залоз:
- вплив NAE на включення міченого холестерину до de novo синтезованих адренокортикоцитами кортикостероїдів;
- вплив різних NAE на процеси стероїдогенезу в корі надниркових залоз за присутності дофаміну;
- роль циклічних нуклеотидів у внутрішньоклітинному перенесенні сигналу NAE;
- зміни активності протеїнкіназ А та С у корі надниркових залоз під впливом NAE;
- участь NAE у регуляції апоптозу в адренокортикальній тканині.
4. Охарактеризувати сигнальні механізми, які можуть відігравати суттєву роль в опосередкуванні ефектів іонів калію:
- участь циклічних нуклеотидів в перенесенні сигналу K+;
- зміни активності протеїнкіназ A та С у корі надниркових залоз під впливом іонів калію.
Об’єкт дослідження. Внутрішньоклітинні сигнальні системи, залучені до перенесення сигналів регуляторів та модуляторів функції кори надниркових залоз. Регуляція синтезу кортикостероїдів в корі надниркових залоз модуляторами адренокортикальної функції: кортикотропіном, естрогенами, дофаміном, N-ацильованими похідними етаноламінів, іонами калію.
Предмет дослідження. Системи пострецепторного перенесення сигналів в адренокортикоциті: cAMP-залежної протеїнкінази А, протеїнкінази С, протеїнкіназ, що активуються мітогенами, тирозинкіназ, ядерні транскрипційні фактори.
Методи дослідження. Для досягнення мети та виконання завдань, поставлених у роботі, було використано такі методи: тонкошарову хроматографію, визначення активності ферментів із використанням специфічних субстратів, електрофорез білків у поліакриламідному гелі, імуноблот-аналіз, екстракцію нуклеїнових кислот, полімеразну ланцюгову реакцію, електpофорез ДНК та білків в агарозному гелі, радіоізотопні методи, статистичні методи аналізу.
Наукова новизна одержаних результатів. В дисертації досліджені молекулярні механізми залучення месенджерних каскадів різних протеїнкіназ, їх ізоформ у мультифакторному контролі функції кори надниркових за участю кортикотропіну, естрадіолу, іонів калію та N-ацильованих похідних етаноламіну.
Показано, що регуляторна дія АКТГ в корі надниркових залоз людини забезпечується, крім cAMP-залежної протеїнкінази А, месенджерним каскадом протеїнкінази С. Важливою ефекторною ланкою перенесення сигналу кортикотропіну є ядерна протеїнкіназа С, вміст α-ізоформи якої значно збільшується внаслідок дії АКТГ in vitro. Встановлено суттєву роль у трансдукції сигналу АКТГ в адренокортикоцитах сигнального каскаду протеїнкіназ, що активуються мітогенами, а саме кінази JNK, та ядерного фактора транскрипції с-jun, що активується цією кіназою. Під впливом АКТГ виявлені антиапоптичні зміни в клітинах надниркових залоз, на що вказує зниження вмісту каспази-3 і ступеня фрагментації ДНК, значною мірою обумовлені активацією протеїнкінази С.
Доведено можливість прямої дії естрадіолу на функцію кори надниркових залоз. Встановлено факт участі cAMP-залежної протеїнкінази А, протеїнкінази С, протеїнкіназ, що активуються мітогенами (ERK1/2), та ядерного фактора транскрипції с-fos у внутрішньоклітинному перенесенні регуляторного сигналу естрадіолу в адренокортикоцитах.
Встановлено стероїдогенний ефект N-ацильованих етаноламінів у корі надниркових залоз, що дозволяє віднести їх до нового класу адреномодуляторів.
Підтверджена участь протеїнкінази С у К+-залежній стимуляції стероїдогенезу в адренокортикоцитах.
Встановлено, що процес транслокації основної ізоформи протеїнкінази С, α-ізоформи, з цитозольної до мікросомної фракції адренокортикоцитів значно посилюється в пухлинах кори надниркових залоз. Вперше встановлено особливості експресії всіх відомих Са2+-незалежних ізоформ протеїнкінази С в субклітинних фракціях адренокортикоцитів людини, а також експресію рецепторної тирозинкінази RET в карциномах кори надниркових залоз людини.
Практичне значення одержаних результатів. Результати проведеної роботи доводять участь низки первинних месенджерів в регуляції стероїдогенезу, процесів росту та трансформації в клітинах кори надниркових залоз. Отримані дані можуть бути використані в розробці нових підходів до корекції трофічних та функціональних процесів в надниркових залозах за умов патології. Встановлене посилення апоптозу в адренокортикальній тканині під впливом інгібітору протеїнкінази С – хелеритрину, відкриває нові можливості пошуку і розробки засобів для лікування новоутворень надниркових залоз, скеровані на конкретні сигнальні мішені. Встановлене посилення транслокації α-ізоформи протеїнкінази С до мікросомної фракції адренокортикальних клітин пухлин та надекспресія рецепторних тирозинкіназ в карциномах кори надниркових залоз може використовуватись для розробки додаткових методів діагностики та прогнозування перебігу патологічних станів кори надниркових залоз людини.
Особистий внесок здобувача. Всі результати отримано здобувачем особисто або за безпосередньої участі. Робота виконана автором відповідно до програми наукових досліджень, спланованих, проведених і узагальнених протягом 1991-2007 рр. в лабораторії гормональної регуляції обміну речовин Інституту ендокринології та обміну речовин ім. В.П. Комісаренка АМН України. Дисертантом особисто обґрунтовано концепцію роботи, здійснено пошук та аналіз літературних джерел, розроблено методичні підходи. Текст дисертаційної роботи написано здобувачем особисто. Головні завдання роботи, а також основні наукові положення дисертації і висновки сформульовано разом з науковим консультантом – членом-кореспондентом НАН та АМН України, д.мед.н., проф. М.Д. Троньком. Співучасть співробітників відділу патофізіології у виконанні роботи відображено у спільних публікаціях.
Апробація результатів дисертації. Головні положення дисертаційної роботи було представлено на І науково-практичній конференції молодих вчених-ендокринологів в Інституті ендокринології та обміну речовин ім. В.П. Комісаренка АМН України (Київ, 2001), VI, VIІ З’їздах ендокринологів України (Київ, 2001; 2007), VIІ, VIІІ, IX Українських біохімічних з’їздах (Київ, 1997; Чернівці, 2002; Харків, 2006), V, VI конференціях імені Я. Парнаса (Київ, 2005; Краків, Польща, 2007), ІV Національному конгресі патофізіологів України (Чернівці, 2004), міжнародній науково-практичній конференції “Сучасний стан і проблеми експериментальної і клінічної медицини” (Тернопіль, 2004), V Всеросійському конгресі ендокринологів (Москва, Російська Федерація, 2006), 2-му з’їзді Українського товариства клітинної біології (Київ, 2007), засіданні Наукової ради з теоретичної та профілактичної медицини при Президії АМН України (Київ, 27 вересня 2007).
Публікації. За матеріалами дисертації опубліковано 36 робіт, з яких 1 колективна монографія, 21 стаття у фахових наукових журналах, 14 тез доповідей у матеріалах наукових з’їздів та конференцій.
Структура та обсяг дисертації. Дисертацію викладено на 299 сторінках друкованого тексту. Робота складається із вступу, аналітичного огляду літератури, опису матеріалів та методів досліджень, 4 розділів результатів власних досліджень, аналізу та узагальнення результатів досліджень, висновків, списку використаних джерел, який налічує 534 посилання. Текст дисертації проілюстровано 51 рисунком та 13 таблицями.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Огляд літератури. В огляді літератури висвітлено і проаналізовано сучасні дані стосовно механізмів регуляції стероїдогенезу кортикотропіном та ангіотензином II, іншими потенційними модуляторами адренокортикальної функції. Зроблено акцент на фактах, які свідчать про існування нових механізмів контролю гормонопоезу агоністами, таких що доповнюють загальноприйняту схему регуляції або суперечать їй.
Матеріали і методи досліджень. Більшість досліджень проведено на тканинах пухлин надниркових залоз хворих з такою патологією: аденома кори надниркових залоз (гормонально-неактивна (28 зразків), гормонально-активна: кортикостерома (29 зразків), альдостерома (12 зразків), андростерома (3 зразки)), карцинома кори надниркових залоз (11 зразків), хвороба Іценка-Кушинга (24 зразки). Були досліджені також ділянки візуально незміненої тканини кори надниркових залоз (умовно нормальна тканина), всього 71 зразок. В дослідах використовували післяопераційні тканини надниркових залоз хворих, прооперованих у клініці Інституту ендокринології та обміну речовин ім. В.П. Комісаренка АМН України. В роботі також були використані експериментальні тварини (всього 305) – самки та самці (інтактні та орхіектомовані) щурів лінії Вістар масою 200-250 г, самці морських свинок масою 350-550 г, тканина надниркових залоз новонароджених поросят.
Для вивчення стероїдогенезу зрізи кори надниркових залоз щурів інкубували з 3Н-холестерином ("Ізотоп", Російська Федерація). Екстраговані стероїди розділяли методом двомірної тонкошарової хроматографії на силікагелі КСК [Челнакова и др., 1990], визначали радіоактивність продуктів мічення.
Для характеристики метаболізму фосфатидилхоліну до контрольних та дослідних суспензій клітин кори надниркових залоз морських свинок додавали 3Н-холін ("Amersham", Велика Британія). Екстракцію ліпідів проводили за методом [Bligh, Dyer, 1959]. Фосфоліпіди розділяли мікротонкошаровоїю хроматографією в системі розчинників: хлороформ : метанол : 28 % аміак (65 : 35 : 5) (1-й напрямок) та хлороформ : ацетон : метанол : оцтова кислота : вода (30 : 40 : 10 : 10 : 5) (2-й напрямок). Водорозчинні метаболіти фосфатидилхоліну розділяли тонкошаровою хроматографією на силікагелі Н ("Merck", Німеччина) в системі розчинників: метанол : 2,4 % NaCl : вода : 28 % аміак (50 : 12,5 : 37,5 : 5). Перед хроматографією до проб додавали аутентичні немічені свідки ("Sigma", США).
АКТГ та пролактин йодували хлораміновим методом [Чард, 1981]. Як ліганд для вивчення зв’язування АКТГ використовували також (3-[125I]йодотирозил23)АКТГ(1-39) ("Amersham", Велика Британія). Стандартна проба для вивчення рецепції містила мічений гормон (100 000 імп./хв), 50-100 мкг білка мікросом або 105-106 клітин. Для визначення неспецифічного зв’язування до проби додатково вносили по 10 мкг/мл неміченого АКТГ або пролактину, а для визначення загального зв’язування – тільки мічений гормон.
Субклітинні фракції адренокортикоцитів отримували методом диференційного ультрацентрифугування з додатковою очисткою ядерної фракції у градієнті щільності сахарози [Buckley et al., 1988].
Визначення активності протеїнкінази С (ПКС) у субклітинних фракціях клітин кори надниркових залоз людини або щурів проводили з використанням нейрограніну – високоспецифічного лужного пептидного субстрату ПКС, який внаслідок фосфорилювання ПКС змінює заряд та рухається в агарозному гелі до аноду [Uchida et al., 2000], а нефосфорильований нейрогранін, використаний як негативний контроль, мігрує до катоду. Інкубаційне середовище для визначення активності ПКС містило трис-HCl буфер, Mg-ацетат, АТР, а також специфічні активатори ферменту (Са2+, фосфатидилсерин), нейрогранін та білки досліджуваних субклітинних фракцій.
Специфічну активність протеїнкінази А (ПКА) визначали за методикою, що базується на зміні напрямку руху в агарозному гелі пептидного субстрату кемптиду внаслідок його фосфорилювання ПКА [Kemp et al., 1977]. Інкубаційне середовище для визначення активності ПКА містило трис-HCl буфер, АТР, активатори ферменту (Mg2+, cAMP), кемптид та білки субклітинних фракцій.
Рівень cAMP та cGMP визначали, використовуючи радіоімунологічні набори TRK-432 та -500 відповідно ("Amersham", Велика Британія).
Детекцію ізоформ ПКС, каспази-3, протеїнкіназ, що активуються мітогенами, факторів транскрипції проводили імуноблот-аналізом із використанням моноклональних антитіл [Kurien, Scofield, 2006]. Розділені методом електрофорезу у поліакриламідному гелі за присутності додецилсульфату натрію білки [Laemmli, 1970] переносили на нітроцелюлозну мембрану напівсухим способом. Після інкубації з первинними і вторинними антитілами імунні комплекси візуалізували за допомогою реагенту ECL. Після денситометричного визначення інтенсивності засвічення плівки Hyperfilm ECL результати обробляли у програмі "PhotoCaptMw".
Екстракцію ДНК із зрізів проводили, послідовно інкубуючи адренокортикальну тканину з протеїназою К та рибонуклеазою А [Kostyuchenko et al., 2005]. Депротеїнізацію проводили сумішшю хлороформ : ізоаміловий спирт (24 : 1). ДНК осаджували з водної фази етанолом. Екстракцію РНК проводили, використовуючи реагент TRIzol LS ("Invitrogen", США).
Реакцію зворотної транскрипції проводили в реакційній суміші, що містила: стандартний буфер для полімеразної ланцюгової реакції (ПЛР), хлористий магній, суміш дНТФ, а саме АТФ, ТТФ, ГТФ, ЦТФ, інгібітор РНКази, зворотну транскриптазу, суміш випадкових гексамерів та 1 мкг екстрагованої РНК. Інкубація в термоциклері проводилась за таких умов: 22 0С – 10 хв, 42 0С – 15 хв, 99 0С – 5 хв, 4 0С – 5 хв.
Реакцію ПЛР проводили в суміші, що містила: стандартний буфер для ПЛР, хлористий магній, дНТФ, полімеразу red hot taq, прямий та зворотній праймери до RET тирозинкінази (РТК), комплементарну ДНК, одержану в результаті реакції зворотної транскрипції. Умови інкубації: 95 оС – 30 сек, 50 оС – 30 сек, 72 оС – 1 хв, а потім температуру знижували до 4 оС. Кількість циклів становила 30. Продукти ПЛР аналізували в 1,7 % агарозному гелі.
Впродовж всієї роботи використовували кортикотропін А ("Sigma", США),17b-естрадіол, естрадіол бензоат ("Кoch-Ligth", Велика Британія), пролактин великої рогатої худоби (Каунаський завод ендокринних препаратів, Литва). NAE (суміш N-ацилетаноламінів, N-стеароїлетаноламін) було синтезовано в Інституті біології моря (Владивосток, Російська Федерація). о,п’-ДДД було синтезовано в лабораторії оргсинтезу та хімреактивів Інституту ендокринології та обміну речовин ім. В.П. Комісаренка АМН України.
У роботі були використані моноклональні антитіла до ізоформ протеїнкінази С-α, -β1, -β2, -γ, -δ, -ε, -η, -θ, -µ -ζ; οротеїнкіназ, що активуються мітогенами – ERK1/2, JNK, p38; факторів транскрипції – с-jun, с-fos; каспази-3 ("Cell Signaling Technology" або "Sigma", США); IgG, кон’юговані з пероксидазою хрону ("Sigma", США), субстрати нейрогранін та кемптид (Ala-Ala-Lys-Ile-Gln-Ala-Ser-Phe-Arg-Gly-His-Met-Ala-Arg-Lys-Lys та Leu-Arg-Arg-Ala-Ser-Leu-Gly відповідно, "Sigma", США) нітроцелюлозна мембрана Hybond C та реагенти для посиленої хемілюмінесценції ("Amersham Life Science", Велика Британія), набори для проведення полімеразної ланцюгової реакції ("Roche", Франція), агароза, трис, протеїназа К, рибонуклеаза А ("Sigma", США), колагеназа ("Fluka", Швейцарія), усі солі, NaOH, HCl ("Merck", Німеччина).
Для характеристики генеральної сукупності вираховували середнє значення М та середню похибку m, які представлено у ілюстративному матеріалі. Різницю між двома вибірками визначали за параметричним t-критерієм Стьюдента, непараметричним U-критерієм Вілкоксона-Манна-Уїтні та дисперсійним аналізом за F-критерієм Фішера.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ
Дослідження месенджерних систем, що опосередковують сигнали актг в адренокортикальних клітинах. Регуляція кортикотропіном адренокортикальної функції забезпечується здебільшого за рахунок прямого фосфорилювання cAMP-залежною ПКА специфічних білків, а також стероїдогенних факторів, що беруть участь в реакціях стероїдогенезу, змінюючи його швидкість. Не викликає сумнівів, що cAMP/ПКА-залежна месенджерна система не є єдиною системою опосередкування дії АКТГ в клітині. Гормон здатний активувати різні протеїнкінази, проте інші сигнальні каскади, залучені до перенесення сигналів АКТГ, досліджені значно менше, ніж cAMP/ПКА-залежний. Особливу увагу дослідників в цьому аспекті привернула протеїнкіназа С. Відомо, що деякі протеїни можуть одночасно бути субстратами для кількох кіназ, що є важливим загальним принципом інтеграції пострецепторних сигналів в клітині. Це істотно ускладнює розуміння механізмів опосередкування регуляторних сигналів АКТГ та можливої взаємодії між різними месенджерними системами. Потрібно також зазначити, що механізми дії АКТГ досліджувались раніше здебільшого на лініях пухлинних клітин надниркових залоз, спробу оцінки дії гормону на умовно нормальних тканинах надниркових залоз людини ми провели вперше.
Участь цAMФ-залежної ПКА та серин/треонінової протеїнкінази С в реалізації ефектів АКТГ. На початку досліджень необхідним було з’ясування специфіки механізмів перенесення регуляторного сигналу АКТГ в корі надниркових залоз людини із залученням цAMФ-залежної ПКА та серин/треонінової ПКС. В дослідах використовували післяопераційні умовно нормальні тканини надниркових залоз хворих, прооперованих у клініці Інституту. АКТГ in vitro у концентрації 0,2 од./100 мг тканини не призводить до активації ПКА та ПКС ні в мембранній, ні в цитозольній фракціях. При збільшенні концентрації кортикотропіну до 2 од./100 мг тканини протеїнкіназна активність у мікросомній фракції зростає у 4,5 рази порівняно з контрольними пробами у випадку ПКА та у 1,4 рази у випадку ПКС. Визначення розподілу ізоформи ПКС-a в субклітинних фракціях клітин після інкубації у середовищі з різним вмістом АКТГ за допомогою імуноблот-аналізу показало, що із збільшенням концентрації кортикотропінукількість ферменту зростала в ядерній фракції (рис. 1), не змінюючись ні в мікросомній, ні в цитозольній фракціях адренокортикоцитів. Отже, суттєва роль у трансдукції сигналу кортикотропіну в адренокортикальних клітинах людини може належати не тільки мембранозв’язаній формі ПКС, але і ядерній ПКС.
 | |||||
 | |||||
![]()
|
| |
| |
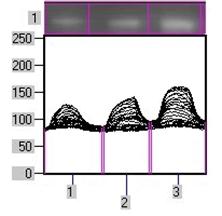
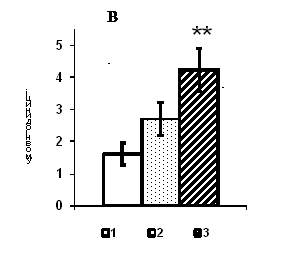
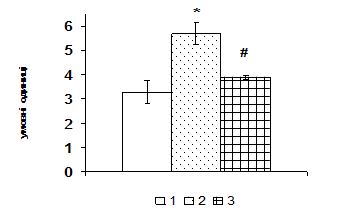
Рис. 1. Вміст a-ізоформи ПКС в ядерній фракції адренокортикоцитів умовно нормальної тканини кори надниркових залоз людини при різних концентраціях АКТГ.
А - Вестерн-блот аналіз. Б - сканограма плівки. В - узагальнені результати п’яти дослідів. 1 – контроль, 2 – АКТГ 0,2 од./100 мг тканини, 3 – АКТГ 2 од./100 мг тканини.** - вірогідний вплив АКТГ, p < 0,05; критерій Стьюдента.
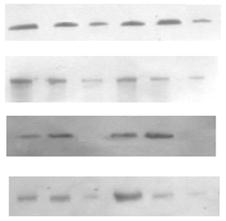
Субклітинний розподіл ПКС та експресія рецепторних тирозинкіназ в пухлинах надниркових залоз людини. Відомо, що у проліферативних процесах важливу роль відіграє ПКС, яка є важливою ланкою внутрішньоклітинних сигнальних механізмів, порушення яких призводить до ініціації та прогресії онкогенезу. Зміни рівня експресії ізоферментів ПКС та їхньої активності мають значний вплив на процеси проліферації та можуть бути залучені до процесів пухлинної трансформації у корі надниркових залоз. Тому доцільним було визначити загальну активність протеїнкінази С і розподіл ізоформ ПКС у субклітинних фракціях клітин адренокортикальних тканин надниркових залоз людини за умов норми і різноманітних патологічних станів. Визначення активності ПКС здійснювалось у цитозольній, мікросомній та ядерній фракціях пухлин та умовно нормальних тканин. Статистично вірогідна різниця спостерігається між активністю ПКС у мікросомній фракції клітин умовно нормальної та пухлинної тканин і не спостерігається у цитозолі та ядрах. В препаратах ядерної, цитозольної та мікросомної фракцій клітин кори надниркових залоз людини було проаналізовано експресію десяти ізоферментних форм ПКС. Найвищий рівень експресії спостерігався у випадку ПКС-α. На отриманих знімках чітко виявляються смуги білка у діапазоні молекулярної маси 80 кДа, що відповідає молекулярній масі α-ізоформи ПКС (рис. 2).
|
|
Експресії немає
ц м я ц м я
умовно аденома
нормальна
тканина
Рис. 2. Розподіл різних ізоформ протеїнкінази С в цитозольній (ц), мікросомній (м) та ядерній (я) субклітинних фракціях адренокортикоцитів в умовно нормальній і пухлинній тканинах надниркових залоз людини.
Ці дані узгоджуються з результатами інших авторів, які також визначали найвищий рівень експресії для α-ізоформи ПКС в адренокортикоцитах порівняно з досить незначним для інших ізоформ [Shigematsu et al., 1992].
Розподіл ПКС-a між цитозольною та мікросомальною фракціями визначається походженням тканини: в умовно нормальній тканині фермент рівномірно розподіляється між фракціями, а в аденомах (група, утворена об’єднанням всіх досліджених випадків доброякісних новоутворень) ПКС-a транслокується з цитозолю до мікросомної фракції. Найістотніша відмінність від контролю спостерігалась у випадках карцином. Для ядерної фракції не вдалося знайти певної закономірності між відносною кількістю ПКС-α та типом тканини (табл. 1). Виявлена транслокація ПКС-a розглядається нами як активація ферменту за умов дослідженої патології. Очевидно, саме ПКС-α бере активну участь у формуванні пухлин та підтримці пухлинного росту. Можливо, надекспресія цього ферменту, тривала активація ПКС внаслідок дії канцерогенних чинників або порушення метаболізму фосфоліпідних активаторів призводить до патологічної відповіді – порушення клітинного циклу та розвитку пухлин.
Отримані дані свідчать, що пухлини кори надниркових залоз характеризуються транслокацією основної ізоформи ПКС – Са2+/фосфоліпід-залежної a-ізоформи до мікросомної фракції адренокортикоцитів і збільшенням загальної активності ПКС в мікросомній фракції пухлин. На разі можна стверджувати, що α-ізоформа ПКС в надниркових залозах може брати участь у онкогенезі і слугувати маркером малігнізації.
Таблиця 1
Розподіл a-ізоформи ПКС у цитозольній, мікросомній та ядерній фракціях клітин кори та пухлин надниркових залоз людини, %
| Тип тканини | Цитозольна фракція | Мікросомна фракція | Ядерна фракція |
| Умовно нормальна (8) | 46,19 ± 2,18 | 41,26 ± 1,97 | 13,62 ± 1,21 |
| Аденома (4) | 29,35 ± 3,61 | 50,40 ± 2,0 * | 17,40 ± 1,58 |
| Карцинома (4) | 26,09 ± 8,16 | 73,91 ± 8,16* | - |
Примітка. * - вірогідна різниця між цитозольною та мікросомною фракціями, р<0,05; критерій Стьюдента, кількість спостережень вказано в дужках.
Крім α-ізоформи ПКС позитивні результати було отримано для -ε, -δ, -η, -θ, -μ, -ζ ³зоформ. Розподіл ізоформ ПКС-α, -ε, -δ, -ζ μіж субклітинними фракціями наведено на рис. 2. ПКС-ε, -δ, -η, -θ, -μ βідносяться до родини нових, а ПКС-ζ до нетипових протеїнкіназ. Всі вищезгадані форми є Са2+-незалежними, їх визначення в корі надниркових залоз було проведено вперше. Рівень експресії цих ізоферментів в корі надниркових залоз людини є досить високим, хоча меншим порівняно з Са2+/фосфоліпід-залежною ПКС-α. За винятком δ-ізоформи, вони виявляються в усіх досліджуваних субклітинних фракціях – цитозольній, мікросомній та ядерній (рис. 2).
Розподіл ізоформ ПКС-ε, -δ, -ζ μіж цитозольною, мікросомальною та ядерною фракціями наведено у таблиці 2. У випадку ПКС-ε усереднені дані за всіма дослідженими групами демонструють переважний вміст ε-ізоформи ПКС у цитозольній фракції (табл. 2). Отже, розподіл протеїнкінази С-e не залежить від типу тканини і характеризується зсувом до цитозольної фракції. Транслокація ПКС-δ до мембранної фракції спостерігалась у випадку аденом. Розподіл ПКС-ζ є подібним до ПКС-e в аденомах. В умовно нормальній тканині різниця між цитозольною та мікросомною фракціями ставить менше 10 %. У аденомах відносний розподіл протеїнкінази С-ζ характеризується зсувом до цитозольної фракції. Частка ядерної фракції становить в досліджених групах 14-18 % (табл. 2).
Таблиця 2
Субклітинний розподіл ε, δ, ζ ізоформ ПКС у фракціях клітин кори та пухлин надниркових залоз людини, %
| Ізоформа | Тип тканини | Цитозольна фракція | Мікросомна фракція | Ядерна фракція |
| ПКС-ε | Умовно нормальна (8) | 46,54 ± 2,77 | 36,31 ± 1,96 * | 17,14 ± 1,74 |
| Аденома (4) | 48,90 ± 4,64 | 33,13 ± 2,72 * | 17,98 ± 2,54 | |
| ПКС-δ | Умовно нормальна (8) | 50,49 ± 1,34 | 49,90 ± 1,34 | - |
| Аденома (4) | 36,65 ± 2,78 | 63,35 ± 2,78 * | - | |
| ПКС-ζ | Умовно нормальна (8) | 43,98 ± 2,69 | 42,00 ± 2,20 | 14,01 ± 1,26 |
| Аденома (4) | 51,98 ± 8,81 | 31,07 ± 6,62 * | 16,92 ± 2,97 |
Примітка. * - вірогідна різниця між цитозолем та мікросомною фракцією, р<0,05; критерій Стьюдента, кількість спостережень вказано в дужках.
Таким чином, отримані дані свідчать про участь ферментів родини ПКС у формуванні пухлинних патологій, оскільки процес транслокації до мембран є дуже суттєвим для активації ферменту та взагалі для існування пухлинних клітин.
Крім серин/треонінових протеїнкіназ, до яких відноситься ПКС, широко представлені в клітинах рецепторні і цитоплазматичні фосфотирозинові протеїнкінази. Зараз активно обговорюються факти щодо фенотипічного зв’язку експресії РТК в клітині зі злоякісною трансформацією і метастатичним потенціалом тканини. Ми провели оцінку експресії мРНК РТК за рахунок використання зворотної транскрипції – полімеразної ланцюгової реакції, яка свідчить про вірогідні відміни у експресії мРНК РТК між нормальною та пухлинною тканинами у карциномах кори надниркових залоз. Експресія в злоякісних пухлинах є найбільш вираженою і відрізняється від експресії мРНК РТК в доброякісних пухлинах надниркових залоз, які досліджувались (експресія спостерігалась тільки в одному випадку гормонально-активної аденоми – альдостероми). Визначення експресії РТК за допомогою зворотної транскрипції – полімеразної ланцюгової реакції може вважатись, з нашої точки зору, методом диференційної діагностики злоякісності пухлин надниркових залоз. Використання цього методу може бути перспективним для діагностики карцином адренокортикальної тканини.
Залучення МАР-кіназної системи до перенесення сигналу АКТГ. Пострецепторні етапи дії АКТГ, які полягають в перенесенні сигналу з активованого рецептора на внутрішньоклітинні процеси, що контролюються гормоном, пов’язують з системою cAMP-залежної ПКА, а також ПКС. Крім цих кіназ, кортикотропін викликає швидку активацію протеїнкіназ, що активуються мітогенами (МАР) – ERK1/2 і JNK в клітинах Y1, отриманих з адренокортикальної пухлини мишей. Трактування таких даних потребує уваги щодо пухлинного походження клітин лінії Y1, на яких здебільшого проводили дослідження дії АКТГ на систему МАР-кіназ, – регуляція функції і поділу цих клітин може суттєво відрізнятись від процесів у нормальних клітинах. Тому метою наступного етапу роботи було з’ясування участі МАР-кіназної сигнальної системи, а також факторів транскрипції c-jun та c-fos в трансдукції регуляторного сигналу АКТГ in vivo в корі надниркових залоз щурів. Досліди проведені на тлі істотного збільшення синтезу сумарних 11-гідроксикортикостероїдів (11-ОКС) корою надниркових залоз після введення щурам кортикотропіну в дозі 2 од./100 г маси тіла. Через 1 год після введення АКТГ рівень сумарних 11-ОКС у плазмі крові збільшувався з 1824±156 нмоль/л в контролі до 3220±168 нмоль/л (р<0,05). Через 6 год після введення АКТГ рівень 11-ОКС збільшився в порівнянні з контролем в 3,2 рази і становив 5845±489 нмоль/л в плазмі крові тварин (р<0,01).
Згідно одержаних даних, через 1 год після введення щурам АКТГ вміст ERK1/2 в адренокортикальній тканині зростає в 1,6 рази, а через 6 год починає знижуватись. За даними літератури проліферативна дія кортикотропіну реалізується в клітинах кори надниркових залоз в першу чергу за рахунок активації ERK1/2 кіназ (р42/44), які відносяться до родини серин/треонінових протеїнкіназ, що активуються мітогенами. До родини МАР-кіназ відносять також JNK (c-Jun NH2-термінальна кіназа або SAPK – протеїнкіназа, що активується стресом) та р38 кіназу. Ці серин/треонінові кінази в свою чергу є активаторами транскрипційних факторів, які регулюють експресію генів ферментів стероїдогенезу. За отриманими нами даними, найвиразніший вплив АКТГ чинить на рівень JNK кінази. Через 1 год після введення АКТГ її вміст зростає більш ніж вдвічі, через 6 год вірогідно знижується, проте залишається істотно вищим, ніж у контролі (рис. 3). На клітинах Y1 показали, що АКТГ здатний індукувати швидке зростання активності ERK1/2 та стимулювати входження клітин у S-фазу клітинного циклу [Forti, 2006; Lotfi, Armelin, 1998]. Важливим елементом трансдукції та ампліфікації різних регуляторних сигналів в ядрі є транскрипційний фактор АР-1, який складається з двох субодиниць, транскрипційних факторів с-jun і с-fos. Вміст білка с-jun в адренокортикальній тканині зростає майже в 1,7 рази через 1 год після введення АКТГ (рис. 3). Звертає на себе увагу значне збільшення з часом вмісту білка с-fos, який вірогідно зростає в 1,7 рази тільки через 6 год після введення кортикотропіну.
Дослідження ролі АКТГ в апоптичних процесах в надниркових залозах. Кортикотропін, як головний регулятор адренокортикальної функції, забезпечує не тільки диференціювання, проліферацію адренокортикоцитів, а також їх генетично запрограмовану загибель шляхом апоптозу. Існує припущення, що шлях перенесення сигналу cAMP-залежною ПКА може водночас приводити до інгібування росту адренокортикальної пухлини [Keegan, Hammer, 2002; Kirschner, 2002], а інактивація рецепторів АКТГ може спровокувати формування пухлини [Kirschner, 2006]. Здебільшого дослідження механізмів апоптозу проводять як на клітинному, так і молекулярному рівнях, використовуючи як експериментальні моделі клітинні лінії.
Не існує жодної роботи, яка була б проведена на постопераційних тканинах надниркових залоз людини, що позбавляє можливості екстраполяції експериментальних даних на людський організм. Зважаючи на повну відсутність даних участі апоптичних процесів в патогенезі навіть найпоширеніших захворювань надниркових залоз, ми провели дослідження на гіперплазованій адренокортикальній тканині людини. Дослідження ролі АКТГ у регуляції апоптозу адренокортикальних клітин проводили за допомогою двох методичних підходів: визначення вмісту каспази-3 методом імуноблот-аналізу та за фрагментацією ДНК, яка є свідченням завершальних етапів апоптозу. Утворення характерної для апоптозу чіткої "драбинки" здійснюється ендонуклеазами, які розщеплюють ДНК хроматину на відрізки фіксованого розміру.
| ||||||||
| ||||||||
| ||||||||
| ||||||||
| ||||||||
|
![]()
|
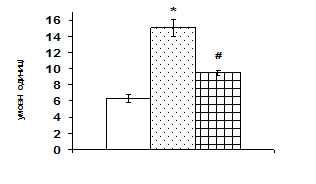
Рис. 3. Вплив АКТГ in vivo на вміст JNK-кінази і транскрипційного фактора c-jun у корі надниркових залоз щурів.
А – типові результати імуноблот-аналізу одного досліду з 3-х, Б – усереднені дані. 1 – контроль, 2 – АКТГ 1 год, 3 – АКТГ 6 год. * – різниця з контролем є вірогідною, # – різниця з групою АКТГ 1 год є вірогідною, р < 0,05; непараметричний U-критерій Вілкоксона-Манна-Уїтні.
Внесення до середовища інкубації АКТГ викликає вірогідні зміни вмісту каспази-3 в адренокортикоцитах (рис. 4).
Рівень каспази-3 за присутності кортикотропіну знижується як в абсолютних величинах (в 1,7 рази), так і у відсотках по відношенню до контролю (на 40 %). Хелеритрину хлорид (ХХ), який здатний інгібувати активність ПКС, виявляє протилежну дію: вміст каспази-3 збільшується на 22 %. При сумісному додаванні АКТГ і ХХ в більшій мірі спостерігається ефект, характерний для ХХ. Подібна закономірність спостерігається при дослідженні фрагментації ДНК. Під впливом АКТГ спостерігається зниження рівня фрагментації ДНК на 13 %, ці зміни є вірогідними. Тенденція до збільшення фрагментації ДНК спостерігається як при додаванні до середовища інкубації інгібітору ПКС ХХ, так і його комбінації з кортикотропіном. Отримані нами результати свідчать про те, що кортикотропін здійснює антиапоптичний вплив на кору надниркових залоз людини. Виявлені під дією АКТГ антиапоптичні зміни в клітинах надниркових залоз, оцінювані за вмістом каспази-3 і ступенем фрагментації ДНК.
Наш час відзначається інтенсивними спробами залучити до кола протипухлинних засобів препарати, що діють саме на ланки сигнальних шляхів, залучених до трансформації клітин. Інгібування ПКС, зокрема хелеритрином, може стати допоміжним заходом для посилення апоптичної загибелі клітин під впливом канцеростатичних препаратів або іонізуючої радіації. Крім ПКС-залежного впливу хелеритрину, що може викликати апоптоз, ймовірною є його пряма дія на ДНК. Виходячи з цього, посилення фрагментації ДНК під впливом хелеритрину хлориду може пояснюватись його цитотоксичною дією, високим ступенем спорідненості до ДНК та здатності цього алкалоїда до інтеркаляції [Осип та ін., 2004; Kaminskyy et al., 2005]. Конформація молекул хелеритрину зумовлює його енергетично вигідне розміщення між парами азотистих основ у спіралі ДНК, що призводить до стабілізації спіралі (підвищення температури плавлення) ДНК і, як наслідок, до гальмування процесів реплікації.
Таким чином, можна стверджувати, що вплив кортикотропіну на функцію кори надниркових залоз є значно складнішим, ніж вважалось до цього часу. Ефекти АКТГ здебільшого пов’язані з регуляцією стероїдогенезу в адренокортикальній тканині. Однак отримані нами дані щодо впливу кортикотропіну на зміни рівня каспази-3 та фрагментації ДНК дозволяють віднести його до чинників, що регулюють одночасно апоптичні процеси в адренокортикоцитах.
Зв’язування 125І-АКТГ та 125І-ПРЛ в корі надниркових залоз за умов адренокортикальної патології. Відомо, що апоптоз не тільки відіграє важливу роль у елімінації пухлинних клітин, але й посилюється в останніх за дії деяких протипухлинних препаратів. Застосування хлодитану (о,п’-ДДД, 2-о-хлорфеніл-2-п-хлорфеніл-1,1-дихлоретан) при хворобі та синдромі Іценка-Кушинга та при лікуванні певних випадків злоякісних перетворень у надниркових залозах значно підвищило ефективність терапії цих патологій [Комиссаренко, Резников, 1972; Schteingart, 2007].
![]()
![]()
|
|
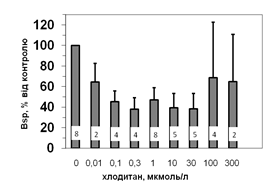
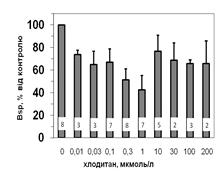
Рис. 5. Вплив хлодитану на специфічне зв’язування 125І-АКТГ (А) та 125І-ПРЛ (Б) мікросомами адренокортикоцитів людини.
Вплив хлодитану є вірогідним, p<0,001; критерій Фішера.
Кількість спостережень вказано всередині стовпчиків.
Вивчення відхилень гормональної рецепції в корі надниркових залоз під впливом хлодитану в певній мірі заповнює прогалину в розумінні механізму його дії, розвитку резистентності до нього та може стати підґрунтям для використання більш ефективної схеми лікування хвороби Іценка-Кушинга. Зважаючи на практично повну відсутність аналізу як рецепторної ланки в патогенезі захворювань надниркових залоз, так і зміни рецепції тропних гормонів гіпофіза при адренокортикальних патологіях та за умов їх терапії, ми провели дослідження впливу хлодитану на зміни рецепції 125І-АКТГ та 125І-ПРЛ. Для вивчення дії хлодитану на зв’язування 125І-АКТГ та 125І-ПРЛ використані мікросомні фракції клітин кори надниркових залоз пацієнтів з різними діагнозами: хвороба Іценка-Кушинга на різних стадіях, кортикостерома, альдостерома. Розглянувши наявний матеріал ми не помітили істотних відмін між ними в характері впливу хлодитану в залежності від типу патології. Тому всі дані охарактеризовано як одна вибірка.
Для вивчення зв’язування використано АКТГ, мічений за Tyr23, а Tyr2, який бере участь у формуванні центру, відповідального за гормон-рецепторну взаємодію, залишається нейодованим. Такий ліганд повністю зберігає біологічну активність, зокрема, здатність взаємодіяти з рецепторами та активувати стероїдогенез.
Параметри зв’язування 125І-ПРЛ в мікросомній фракції кори надниркових залоз людини свідчать про наявність тільки одного типу сайту зв’язування ПРЛ, який за своїми характеристиками є типовим представником рецепторів високої афінності та низької ємності: Bmax=1,2±0,08 х 10-10 М; Ka=0,14±0,02 х 109 М-1. Оцінка параметрів зв’язування 125І-ПРЛ ізольованими адренокортикальними клітинами свідчить, що афінність рецепторів у цьому випадку є подібною до мембран мікросом. Цей факт може бути додатковим свідченням того, що диспергування і очищення адренокортикоцитів істотно не впливає на нативність клітин та їх здатність до відтворення нормальних фізіологічних процесів. Більш низьку абсолютну зв’язувальну ємність плазматичних мембран адренокортикоцитів порівняно до мембран мікросом можна пояснити тим, що на поверхні клітини є доступною лише незначна частка тих рецепторів, які містять мікросоми. Специфічне зв’язування (Bsp) як 125І-АКТГ, так і 125І-ПРЛ знижується у мікросомах кори надниркових залоз людини за присутності хлодитану (рис. 5).
Зв’язування починає зменшуватись, починаючи з концентрації 0,01 мкмоль/л, та сягає мінімуму за присутності 0,3 мкмоль/л хлодитану (рецепція 125І-ПРЛ) або 1,0 мкмоль/л хлодитану (рецепція 125І-АКТГ). Подальше збільшення концентрації хлодитану нівелювало його інгібувальний ефект на зв’язування досліджуваних лігандів (рис. 5). Факт встановлення залежності зниження специфічного зв’язування 125І-АКТГ та 125І-ПРЛ від концентрації хлодитану у мікросомній фракції адренокортикоцитів може стати підставою для пошуків способів подолання резистентності деяких типів пухлин до цього препарату та збільшення ефективності його використання.
Шляхи внутрішньоклітинного перенесення регуляторних сигналів естрадіолу в корі надниркових залоз
Продукція cAMP та cGMP, активність ПКА та ПКС в корі надниркових залоз людини під впливом естрадіолу. Дослідження молекулярних механізмів дії естрогенів призвело до появи нових теорій, більш чітко окреслило етапи реалізації ефектів стероїдних гормонів. До останнього часу вплив естрогенів на клітини-мішені пов’язували виключно з геномними ефектами, що не потребують залучення вторинних посередників для внутрішньоклітинного перенесення регуляторних сигналів. Зараз розглядається участь в цих процесах декількох месенджерних систем, серед яких важливе місце відводять cAMP-залежному каскаду.
При визначенні вмісту сумарних 11-ОКС у середовищі інкубації ми показали дозозалежне збільшення продукції стероїдів зрізами кори надниркових залоз людини під впливом естрадіолу. Максимальний рівень синтезу кортикостероїдних гормонів спостерігається через 4 год інкубації при концентрації естрадіолу 100 мкМ і становить 6212 ± 841 нмоль/л у порівнянні з 2363 ± 271 нмоль/л у контрольних пробах (р < 0,01; n=10; критерій Фішера). Наші дослідження показали, що культивування адренокортикальних клітин новонарождених поросят в середовищі з 17b-естрадіолом також призводить до суттєвого збільшення продукції 11-ОКС.
Утворення cAMP тканиною кори надниркових залоз людини вірогідно збільшується через 3 год інкубації.
Ці зміни стають ще істотнішими через 4 год інкубації, коли спостерігається 7-разове збільшення продукції cAMP. Рівень cGMP не змінювався ні за умов використання різних концентрацій естрадіолу, ні за умов різних термінів інкубації.
Дослідження впливу естрадіолу на активність ПКА та ПКС в субклітинних фракціях кори надниркових залоз людини дозволило продемонструвати, що інкубація з естрадіолом-17β протягом 4 год у концентрації 10 мкМ не призводить до активації ПКА ні в мембранній, ні в цитозольній фракціях (табл. 3). При збільшенні концентрації до 100 мкМ протеїнкіназна активність у мікросомній фракції зростає більш ніж на 50 % порівняно з контролем. Визначення активності ПКС в мікросомній фракції показало, що естрадіол активує цю кіназу. Активність ПКС збільшується на 50 % у мікросомній фракції зрізів кори надниркових залоз за умов дії естрадіолу (100 мкМ) (табл. 3).
Таблиця 3
Вплив 17b-естрадіолу in vitro на активність ПКА і ПКС (нмоль субстрату х хв-1 х мг-1білка) у субклітинних фракціях зрізів умовно нормальної тканини кори надниркових залоз людини
| Фермент | Цитозольна фракція | Мікросомна фракція | |||||
| Е2, мкМ | Е2, мкМ | ||||||
| Контроль | 10 | 100 | Контроль | 10 | 100 | ||
| ПКА | 6,81 ± 1,24 | 7,62 ± 0,87 | 9,11 ± 2,10 | 11,78±1,55 | 14,80 ± 1,53 | 17,87 ± 1,31* | |
| ПКС | 8,64 ± 1,77 | 8,04 ± 0,18 | 11,18 ± 0,73 | 9,90 ± 0,68 | 11,68 ± 1,07 | 15,10 ± 1,31* | |
Примітка. * – різниця з контролем є вірогідною, р < 0,05; критерій Стьюдента; n = 5.
Продемонстровані шляхи пострецепторної передачі регуляторних сигналів естрадіолу за умовах in vitro на первинній культурі клітин надниркових залоз поросят і зрізах кори надниркових залоз людини залишають відкритим питання щодо тотожності цих шляхів на рівні цілісного організму. Відомо, що природні та синтетичні естрогени активно використовуються для лікування раку простати у чоловіків [Tammela, 2004], тому дослідження ефектів естрадіолу на інтактних та кастрованих експериментальних тваринах можуть дозволити певну екстраполяцію на зміни функції надниркових залоз у людини.
Після 3 днів введення естрадіолу спостерігалось істотне зростання рівня сумарних 11-ОКС у плазмі крові як інтактних, так і орхіектомованих щурів (табл. 4). Показано, що введення 50 мкг естрадіолу інтактним тваринам призводить до збільшення рівня кортикостероїдів у 1,5 рази порівняно з інтактними тваринами, що отримували ін’єкції олії. При введенні 100 мкг естрадіолу цей показник зростає більш ніж у 2 рази. Подібний ефект естрадіолу спостерігався і у кастрованих тварин. У контрольних орхіектомованих щурів рівень 11-ОКС був нижчим, ніж у інтактних (яким вводили сливову олію). Збільшення концентрації кортикостероїдних гормонів під впливом естрадіолу було подібним в обох експериментальних групах. Виходячи з цих даних можна стверджувати, що рівень тестостерону в організмі не має помітного впливу на зміни функції адренокортикальних клітин під впливом естрадіолу. Ні орхіектомія, ні замісне введення тестостерону щурам не призводили до змін концентрації вільного холестерину або його ефірів, які є попередниками синтезу кортикостероїдів [Duda et al., 1985].
Таблиця 4
Вплив естрадіолу бензоату (Е2) in vivo на вміст сумарних 11-гідроксикортикостероїдів у плазмі крові самців щурів (нмоль/л)
| Групи тварин | Е2, мкг | ||
| Контроль | 50 | 100 | |
| Інтактні | 1132 ± 140 n = 14 | 1756 ± 171* n = 16 | 2351 ± 230** n = 17 |
| Орхіектомовані | 781 ± 55+ n = 9 | 1235 ± 96*,+ n = 8 | 1848 ± 190** n = 8 |
Примітки:
*, ** – різниця з контролем є вірогідною, відповідно р < 0,05 і р < 0,01;
+ – різниця між інтактними і орхіектомованими тваринами є вірогідною, р < 0,05; критерій Стьюдента.
Оскільки найважливішими етапами переносу сигналу основного регулятора функції кори надниркових залоз – АКТГ є активація аденілатциклази та cAMP-залежної протеїнкінази А, ми досліджували вплив естрадіолу in vivo на активність ПКA у субклітинних фракціях кори надниркових залоз. Відомо, що ПКА відіграє суттєву роль у найважливіших етапах стероїдогенезу: відщепленні бокового ланцюга холестерину цитохромом Р450scc, активації білка StAR, транспорті вільного холестерину до внутрішнього шару мембрани мітохондрій [Gallo-Payet et al., 2003; Richards, 2001]. Визначення активності ПКА в субклітинних фракціях показало, що триденне введення естрадіолу призводить до істотного зростання активності ПКА як у цитозольній, так і у мікросомній фракціях кори надниркових залоз інтактних та орхіектомованих щурів (табл. 5). Вірогідність змін була вищою у мікросомній фракції. Ми визначали також активність ПКС, яка може брати участь в опосередкуванні регуляторних сигналів естрогенів (табл. 5). Активність ПКС вірогідно збільшується як в цитозольній фракції адренокортикоцитів, так і, ще в більшому ступені, в мікросомній фракції надниркових залоз інтактних і орхіектомованих щурів, що отримували естрадіол.
Таблиця 5
Вплив естрадіолу бензоату (Е2) in vivo на активність протеїнкіназ А та С у субклітинних фракціях кори надниркових залоз самців щурів (нмоль субстрату х хв-1 х мг-1 білка)
| Групи тварин | Цитозольна фракція | Мікросомальна фракція | ||||
| Е2, мкг | Е2, мкг | |||||
| Контроль | 50 | 100 | Контроль | 50 | 100 | |
| Протеїнкіназа А | ||||||
| Інтактні n = 6 | 3,96 ± 0,81 | 5,23 ± 0,83 | 8,41 ± 1,71* | 8,42 ± 0,85 | 9,79 ± 1,41 | 16,62 ± 0,48** |
| Орхіекто-мовані n = 4 | 6,10 ± 1,31 | 6,93 ± 1,36 | 11,14 ± 1,21* | 11,02 ± 0,31+ | 13,10± 0,43+ | 18,20 ± 0,77** |
| Протеїнкіназа С | ||||||
| Інтактні n = 6 | 6,65 ± 0,81 | 8,90 ± 0,85 | 10,30 ± 1,90* | 5,76 ± 0,75 | 9,56 ± 1,05 | 10,07 ± 1,24** |
| Орхіекто-мовані n = 4 | 3,08 ± 0,40+ | 6,16 ± 0,49+ | 8,65 ± 0,41** | 6,86 ± 0,29 | 10,91 ± 0,20 | 13,84 ± 0,31**,+ |
Примітки:
*, ** – різниця з контролем є вірогідною, відповідно р < 0,05 і р < 0,01; критерій Фішера; + – різниця між інтактними і орхіектомованими тваринами є вірогідною, р < 0,05; критерій Стьюдента.
Естрадіол підвищує активність ПКС в мікросомній фракції кори надниркових залоз у 1,7 рази в групі інтактних тварин та у 2,0 рази в групі орхіектомованих тварин. Зміни рівня кортикостероїдів і активності ПКА та ПКС під впливом естрадіолу бензоату є подібними у інтактних та кастрованих самців щурів, що дозволяє зробити висновок: видалення сім’яників не впливає на відповідь надниркових залоз на естрогени. Таким чином, отримані дані дозволяють вважати, що збільшення синтезу кортикостероїдів та активація ПКА і ПКС у субклітинних фракціях адренокортикоцитів інтактних та орхіектомованих щурів внаслідок дії естрадіолу свідчить про причетність естрогенів до регуляції функції кори надниркових залоз і про залучення протеїнкіназ до перенесення регуляторного сигналу естрадіолу в адренокортикальних клітинах.
Отже, естрадіол in vitro та in vivo посилює продукцію кортикостероїдних гормонів в корі надниркових залоз і збільшує рівень cAMP, який, в свою чергу, є активатором cAMP-залежної ПКА. У субклітинних фракціях клітин збільшується активність ПКА і ПКС, що свідчить про участь цих ферментів в реалізації ефектів естрогенів в корі надниркових залоз. Узагальнюючи наші результати і дані інших дослідників [Aronica et al., 1994; Seval et al., 2006] можна висловити припущення, що регуляція стероїдогенезу естрогенами в корі надниркових залоз зумовлена здебільшого cAMP-залежною системою. Ймовірною є також участь систем, до яких залучена ПКС. Отримані дані дозволяють розширити розуміння сукупності негеномних механізмів, за якими естрогени здатні чинити контроль метаболічних процесів в адренокортикальній тканині.
Участь сигнального каскаду, пов’язаного з протеїнкіназами, що активуються мітогенами, в опосередкуванні сигналу естрадіолу. В опосередкуванні впливу естрогенів на клітини-мішені зараз розглядається участь декількох сигнальних систем, серед яких важливе місце відводять крім протеїнкіназ А і С, месенджерним системам, що використовують як вторинні посередники протеїнкінази, що активуються мітогенами. Каскад MAPK/ERK є одним з провідних шляхів сигнальної трансдукції естрогенів, що залучається до реалізації широкого спектру ефектів, спрямованих на проліферацію клітин-мішеней. Показано, що активована естрогенами форма ERK1/2 здатна до транслокації в ядро і прямої взаємодії з ядерними транскрипційними факторами [Edwards, 2005; Lee, McEwen, 2001].
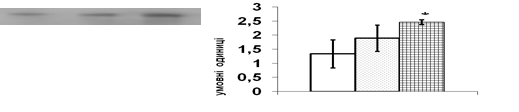
В корі надниркових залоз щурів естрадіол бензоат чинить найбільш виразний вплив на рівень ERK1/2 кінази (рис. 7). За результатом Вестерн-блот аналізу, введення 50 мкг естрадіолу не призводить до змін вмісту ERK1/2 в адренокортикальній тканині порівняно із контрольними тваринами, що отримували ін’єкції олії. Після тридобового введення естрадіолу в дозі 100 мкг цей показник вірогідно зростає в 1,7 рази (рис. 7). Збільшення вмісту JNK кінази спостерігається в адренокортикальній тканині при введенні 100 мкг естрадіолу бензоату. Рівень р38 МАР-кінази при введенні естрадіолу в обох дозах залишається без змін.
В інших типах клітин, зокрема раку молочної залози MCF-7, фосфорилювання р38 кінази і, особливо, ERK1/2 збільшується під впливом 17β-естрадіолу в клітинах [Gutzman et al., 2005].
Потрібно зазначити, що стимульована естрогенами транскрипція полягає в активації експресії низки генів, серед яких протоонкогени c-jun та c-fos [Albanito et al., 2007]. Продукти активації цих генів, білки с-jun і c-fos, утворюючи гомодимерні та гетеродимерні комплекси, входять до складу фактора транскрипції АР-1, який є надзвичайно важливим елементом трансдукції сигналу в ядрі. Ми визначали в адренокортикоцитах щурів рівень білкових факторів транскрипції с-jun та c-fos, які можуть брати участь в опосередкуванні регуляторних сигналів естрогенів в корі надниркових залоз (рис. 7). Максимальний рівень с-fos спостерігається при введенні 100 мкг естрадіолу. В цих умовах рівень білка с-jun в корі надниркових залоз практично не змінюється.
Встановлено, що c-jun та c-fos не єдині ранні протоонкогени|, експресія яких стимулюється естрогенами. 17β-εстрадіол також істотно|суттєво| збільшує рівень експресії мРНК|посилює| протоонкогена| c-myc в ембріональних стовбурових клітинах [Han et al., 2006].
Таким чином, можна зробити висновок, що до перенесення регуляторного сигналу естрадіолу в клітинах кори надниркових залоз можуть бути залучені МАРК ERK1/2 та фактор транскрипції c-fos, який активується цією кіназою.
 | |||
| |||

 | |||

![]()
![]()
Рис. 7. Вплив естрадіолу бензоату (Е2) in vivo на вміст ERK1/2 та c-fos у корі надниркових залоз щурів.
Репрезентативні результати імуноблот-аналізу одного з 3-х дослідів (А) та усереднені дані (Б). 1 – контроль, 2 – Е2 50 мкг/тварину, 3 – Е2 100 мкг/тварину. Різниця з контролем є вірогідною, * – p < 0,05; непараметричний U-критерій Вілкоксона-Манна-Уїтні, критерій Стьюдента.
Дослідження впливу NAE на стероїдогенез в корі надниркових залоз. участь систем вторинних посередників перенесення регуляторних сигналів nae в адренокортикоцитах
Зміна біосинтезу кортикостероїдів під впливом NAE та дофаміну. N-ацилетаноламіни завдяки ліпотропним властивостям добре поглинаються збагаченими на ліпіди тканинами, зокрема адренокортикальною. Розподіл введеного щурам міченого N-пальмітоїлетаноламіну свідчить про переважне його включення саме до надниркових залоз [Жуков та ін., 2000]. Оскільки стероїдогенез є основною функцією цієї залози, NAE можуть відігравати важливу роль в синтезі кортикостероїдних гормонів. Відповідь кори надниркових залоз на введення NAE в організм може бути пов’язана із зміною функції гіпофізу і вищих регуляторних центрів. Тому дослідження кортикостероїдогенезу було проведено на зрізах надниркових залоз в середовищі, що містило NAE, а також дофамін. Дофамін, який є інгібітором секреції альдостерону, є одним з найменш досліджених модуляторів адренокортикальної функції. Як нейромедіатор, дофамін відіграє важливу роль в регуляції секреції пролактину, який, в свою чергу, виконує регуляторну функцію в клітинах кори надниркових залоз.
В дослідах використовували N-стеароїлетаноламін або суміш N-ацилетаноламінів, в якій більше 60 % складають залишки ненасичених жирних кислот: 6,3 % арахідонової, 1,8 % лінолевої, 7,6 % гондової, 18,4 % олеїнової, 6,4 % пальмітоолеїнової, 16,7 % ейкозапентаенової, 2,7 % докозагексаенової; близько 30 % – ацили насичених жирних кислот: 6,4 % міристинової, 22,4 % пальмітинової, 3,0 % стеаринової, 1,0 % арахінової, 1,4 % бегенової.
Додавання до середовища інкубації N-стеароїлетаноламіну у концентраціях 10-7 -10-6 М не викликало суттєвих змін щодо включення мітки в альдостерон та кортикостерон. Однак у присутності N-стеароїлетаноламіну в концентрації 10-5 М мічення гормонів підвищувалось.
Вплив дофаміну на включення мітки холестерину в альдостерон і кортикостерон залежав від його концентрації (рис. 8). В концентрації 10-7 – 10-6 М дофамін не впливав на включення холестеринової мітки в кортикостерон. Мічення альдостерону мало тенденцію до зростання при концентрації дофаміну 10-6 М. Вірогідним пригнічення мічення кортикостерону і альдостерону ставало при концентрації дофаміну 10-5 М. Потрібно зазначити, що це гальмування відбувається лише при досить високій концентрації дофаміну.
Аналіз особливостей сумісної дії дофаміну та NAE проведено з використанням таких концентрацій сполук, котрі самі по собі не змінювали включення мітки в альдостерон і кортикостерон – 10-6 М (рис. 9). Дофамін у використаній концентрації дещо збільшував включення мітки в альдостерон, але не в кортикостерон.
Встановлено, що кожен з препаратів NAE потенціював включення 3Н-холестерину в кортикостероїди за дії дофаміну. При цьому радіоактивність альдостерону та кортикостерону зростала в порівнянні з контролем на 60-80 %. Для альдостерону суттєве підвищення включення 3Н-холестерину досягалось тільки при додаванні суміші ненасичених NAE.
За контроль (100 %) слугували проби, що не містили NAE і дофаміну. Порівняння з контролем: * – р < 0,05, критерій Стьюдента, + – р < 0,05, непараметричний U-критерій Вілкоксона-Манна-Уїтні; n=3.
Не існує чітких односпрямованих результатів, які б характеризували вплив NAE на процеси стероїдогенезу в корі надниркових залоз людини і експериментальних тварин. Проте не викликає сумнівів той факт, що NAE мають адреномодуляторні властивості. Ми показали, що N-ацильовані етаноламіни in vitro суттєво збільшували секрецію 11-ОКС в адренокортикальній тканині самок щурів, проте утворення 11-ОКС зрізами надниркових залоз людини та самців щурів в присутності NAE пригнічувалось (дані не наведені). Питання залежності відповіді на NAE від статі тварин обговорювати вкрай важко, тому що характер впливу статевих гомонів на синтез кортикостероїдів в корі надниркових залоз не досліджено ґрунтовно. Статеві відмінності щільності місць зв’язування каннабіноїдів та зміни їх рецепції під впливом статевих гормонів було знайдено в деяких структурах мозку, але фізіологічна роль цих відмінностей залишається нез’ясованою [De Fonseca et al., 2005].
Слід відзначити, що вплив суміші NAE, яка містила похідні етаноламіну з насиченими і з ненасиченими залишками жирних кислот, на мічення альдостерону був виразнішим, ніж у випадку використання N-стеароїлетаноламіну (рис. 9). Очевидно, властивості залишків жирної кислоти, що входять у склад NAE, мають значення у визначенні реакції адренокортикоцитів. Це, в свою чергу, може свідчити про те, що дія NAE не обмежується впливом на мембрани, а й може впливати на месенджерні механізми або на стероїдогенез безпосередньо. Зростання включення мітки 3H-холестерину до кортикостероїдів під впливом NAE може пояснюватись збільшенням проникнення вільного міченого холестерину до зрізів.
Одним із можливих механізмів впливу NAE може бути зміна транспорту електронів від NADPH на цитохром Р450, який забезпечує реакції гідроксилювання стероїдів. У дослідах in vitro виявлено зниження синтезу 11-ОКС зрізами надниркових залоз самців щурів при додаванні NAE [Гула та ін., 2000]. Перенесення електронів на штучні акцептори, цитохром С та дихлорфеноліндофенол в цих же умовах не змінюється. Це дозволяє вважати, що процес перенесення електронів від NADPH на цитохром Р450 під впливом NAE не змінюється, а гальмування стероїдогенезу у присутності NAE може обумовлюватись зниженням активності аденілатциклази. Пригнічення аденілатциклазної активності і зниження рівня cAMP є найбільш вивченим механізмом переносу сигналів від канабіноїдних рецепторів СВ1 [Felder et al., 1995; Maccarrone et al., 2001]. Встановлено, що активація канабіноїдних рецепторів, сполучених з G(i/0)-cубодиницею GTP-зв’язуючого білка, призводить до інгібування аденілатциклази і пригнічення ефектів, залежних від cAMP-залежної протеїнкінази А.
Роль циклічних нуклеотидів, протеїнкіназ А і С в реалізації ефектів N-ацилетаноламінів в адренокортикоцитах. Дослідження впливу етаноламінів, N-ацильованих сумішшю жирних кислот, на продукцію cAMP корою надниркових залоз людини дозволило показати, що помітне зниження вмісту cAMP в адренокортикальній тканині спостерігається вже при концентрації NAE 0,3 мкг/мл, при збільшенні концентрації NAE вміст cAMP продовжує зменшуватись і становить 0,083 ± 0,005 пмоль/мг тканини при концентрації NAE 33 мкг/мл. В контрольних пробах вміст cAMP становить 0,200 ± 0,012 пмоль/мг тканини. Рівень cGMP за цих умов залишається незмінним.
Для з’ясування можливості модуляції стероїдогенезу за рахунок змін активності ПКА і ПКС ми провели пряме визначення впливу NAE на активність ферментів в субклітинних фракціях. Суміш N-ацильованих похідних етаноламіну змінює активність ПКA у субклітинних фракціях кори надниркових залоз людини, як це видно з табл. 6.
Таблиця 6
Вплив NAE на активність ПКА і ПКС (нмоль субстрату х хв-1 х мг-1 білка) у субклітинних фракціях зрізів умовно нормальної тканини кори надниркових залоз людини
| Фермент | Цитозольна фракція | Мікросомна фракція | |||||
| NAE, мкг/мл | NAE, мкг/мл | ||||||
| Контроль | 3,3 | 33 | Контроль | 3,3 | 33 | ||
| ПКА | 12,18 ± 1,30 | 8,50 ± 0,28* | 8,03 ± 0,89* | 8,68±1,12 | 8,95 ± 1,13 | 7,35 ± 0,56 | |
| ПКС | 9,08 ± 1,28 | 8,33 ± 0,65 | 8,95 ± 1,08 | 7,50 ± 0,43 | 11,13 ± 1,66* | 8,55 ± 1,23 | |
Примітка. * – вірогідно по відношенню до контролю, p < 0,05; критерій Стьдента; n=4.
У цитозольній фракції клітин спостерігається вірогідне зниження активності ферменту, починаючи з концентрації NAE 3,3 мкг/мл. При збільшенні концентрації NAE до 33 мкг/мл протеїнкіназна активність знижується на 34 % у порівнянні з контрольними пробами. У досліджених концентраціях NAE in vitro не впливає на активність ПКА у мембранній фракції адренокортикоцитів.
Внесення суміші NAE до середовища інкубації в жодній з досліджуваних концентрацій не впливає на активність ПКС в цитозольній фракції клітин кори надниркових залоз (табл. 6). У мембранній фракції зростання протеїнкіназної активності спостерігається тільки при одній концентрації NAE - 3,3 мкг/мл.
Виходячи з отриманих даних, виявлені прямі стимулювальні ефекти N-ацилетаноламінів на стероїдогенез в корі надниркових залоз можуть пояснюватись залученням ПКС до перенесення регуляторних сигналів NAE в адренокортикоцитах. Привертає увагу той факт, що для суміші NAE концентрація 3,3 мкг/мл виявилася найбільш біологічно активною в дослідах in vitro як в корі надниркових залоз людини, так і самок щурів. Можливо, ПКС не є єдиною протеїнкіназою, що активується NAE в адренокортикоцитах. Для деяких типів клітин існують дані щодо активації анандамідом, 2-арахідоноїлгіцеролом та D9-тетрагідроканабінолом протеїнкіназ, що активуються мітогенами, а також кінази фокальних контактів [Lepicier et al., 2003].
Вплив NAE на апоптичні процеси в умовно нормальній та пухлинній тканинах надниркових залоз людини. Вважається, що при пошкодженні багатьох тканин і, в першу чергу, нервової тканини та серцевого м’язу утворюються NAE, які виконують захисну функцію щодо пошкодженої тканини. Стабілізаційні ефекти NAE щодо травмованих тканин можуть бути пов’язані з їх протекторним впливом на клітинні мембрани. Нашу увагу NAE привернули такими ефектами, як здатність викликати і посилювати апоптоз та пригнічувати проліферацію у різних типах тканин [Гула та ін., 2006; Maccarrone et al., 2002], в тому числі і в пухлинній тканині надниркових залоз людини [Kostyuchenko et al., 2005]. Проте, незважаючи на проведені дослідження, антипроліферативний та проапоптичний ефекти NAE в різноманітних пухлинах кори надниркових залоз вивчені ще дуже недостатньо.
Тому метою наступного етапу досліджень було визначення залежності ступеня фрагментації ДНК в деяких пухлинних тканинах надниркових залоз людини від вмісту NAE (N-стеароїлетаноламіну та суміші ненасичених NAE) в інкубаційному середовищі (табл. 7). In vitro суміш NAE, що містила похідні етаноламіну здебільшого з ненасиченими залишками жирних кислот, не змінює фрагментацію ДНК в умовно нормальній тканині у випадках альдостером та андростером. Водночас в умовно нормальній тканині у випадку феохромоцитом сумарний об’єм фрагментів ДНК зростає майже в два рази (табл. 7).
Очевидно, реакція тканини надниркових залоз у значній мірі визначається її генетичними особливостями і, відповідно, біохімічними змінами, що відбуваються в тканині внаслідок патологічного перетворення. Слід відзначити, що ступені фрагментації ДНК у пухлинних і умовно нормальних ділянках у межах однієї залози тканин кори надниркових залоз, одержаних від хворих альдостеромою, феохромоцитомою, андростеромою в значній мірі різняться між собою (табл. 7). Різна інтенсивність апоптичних явищ у клітині може пояснюватися перебудовою генетично детермінованих процесів у патологічно змінених клітинах у порівнянні з нормальною тканиною [Bernini et al., 2002].
Таблиця 7
Порівняльна характеристика інтенсивності апоптичних процесів (%) у пухлинних і умовно нормальних ділянках в межах однієї залози під впливом суміші NAE
| Джерело тканини | Суміш NAE (3,3 мкг/мл) | |
| пухлина | умовно нормальна | |
| Альдостерома | 143,6 ± 8,6 ** | 109,8 ± 7,7 |
| Андростерома | 102,4 ± 13,7 | 106,4 ± 9,1 |
| Феохромоцитома | - | 198,0 ± 42,2 ** |
Примітка. За 100 % прийнята фрагментація ДНК за умов інкубації без NAE, ** – вірогідна різниця з контролем без NAE, р < 0,01, критерій Стьюдента; n = 4.
Найбільш чутливими до дії NAE пухлинами виявилися альдостероми, фрагментація ДНК в них збільшується більш ніж на 30 % порівняно з умовно нормальною тканиною. У випадку андростером фрагментація ДНК залишається без змін, у випадку феохромоцитом чутливою до дії NAE є умовно нормальна тканина надниркових залоз. Відомо, що при феохромоцитомі істотно посилюється кортикостероїдогенез в прилеглій адренокортикальній тканин [Wolf et al., 2005]. Цей факт може бути поясненням встановленого нами збільшення фрагментації ДНК під впливом NAE майже на 100 % саме у випадку феохромоцитоми (табл. 7).
Той факт, що N-ацильовані похідні етаноламіну здатні вибірково вражати пухлинну тканину альдостером, помітно не впливаючи і не завдаючи шкоди нормальній, може бути підґрунтям для розробки нових підходів оптимізації хіміотерапії пухлин надниркових залоз.
Дослідження участі протеїнкіназ у перенесенні регуляторного сигналу іонів калію в адренокортикальних клітинах
Іони калію відіграють значну роль в регуляції адренокортикальної функції. Відомо, що К+ здатний активувати гормонопоез при підвищенні його вмісту в крові або інкубаційному середовищі. Крім того, він є тлом, що модулює ефекти інших регуляторів, в першу чергу ангіотензину II та кортикотропіну [Chen et al., 1999; Pratt et al., 1989]. Проте регуляція синтезу мінералокортикоїдів іонами калію є дослідженою значно гірше порівняно з іншими агоністами. Вважається, що основною ланкою в опосередкуванні ефектів калію в клітинах клубочкової зони надниркових залоз є Са2+/кальмодулін-залежна протеїнкіназа [Condon et al., 2002; Ganguly et al., 1992]. В той же час в регуляції найважливіших метаболічних функцій клітини, зокрема в регуляції стероїдогенезу, значну роль відіграють циклічні нуклеотиди. Ми провели дослідження на умовно нормальних та гіперплазованих тканинах кори надниркових залоз людини, які свідчать про участь в трансдукції регуляторних сигналів іонів К+ cAMP, ПКА та ПКС. Для того щоб прослідкувати можливу участь ПКС в опосередкуванні регуляторних сигналів іонів калію в адренокортикоцитах людини, ми вивчали розподіл основної ізоформи ПКС у корі надниркових залоз, ПКС-α, в субклітинних фракціях після інкубації зрізів в середовищі з різним вмістом К+. Встановлено, що кількість ферменту за присутності іонів калію в інкубаційному середовищі є більшою в мікросомах. Таке накопичення ПКС-α в мембранній фракції (її транслокація) свідчить про активацію ферменту. В цитозольній фракції адренокортикоцитів вміст α-ізоформи ПКС залишається без змін.
Ми також вивчали зміни активності ПКС у субклітинних фракціях зрізів адренокортикальної тканини людини під впливом змін концентрації іонів калію. Суттєва активація ПКС спостерігалась в мікросомній фракції: при концентрації калію 8,5 мМ активність ПКС визначалась у мікросомах на рівні 11,09 ± 2,33 нмоль субстрату х хв-1 х мг-1 білка. Цікаво відмітити, що після інкубації зрізів у середовищі без калію активність ПКС в мікросомах дещо знижується, порівняно з кіназною активністю при фізіологічній (3,5 мМ) концентрації К+. Визначення активності ПКС в ізольованих ядрах адренокортикоцитів морських свинок показало значне посилення її активності внаслідок дії К+ [Пушкарьов, 2005]. Натомість, інші протеїнкінази в ядрах не активувались, або їх активність навіть мала тенденцію до зменшення.
Активація ПКС в ядрах, можливо, пов’язана з фосфорилюванням деяких транскрипційних чинників, а через них посиленням експресії генів, продукти яких кодують ферменти стероїдогенезу та білки-регулятори стероїдогенезу (StAR). Таким чином, активація ПКС зі збільшенням концентрації К+ спостерігається в надниркових залозах людини та морських свинок [Пушкарьов, 2005], які є близькими за спектром кортикостероїдних гормонів, що секретуються адренокортикоцитами. Така активація залежить від обміну фосфоінозитидів та мобілізації кальцію з внутрішньоклітинних кальцієвих депо і значною мірою визначає рівень синтезу альдостерону в клубочковій зоні залози. Щоб оцінити можливу роль cAMP-залежної ПКА в опосередкуванні стероїдогенного ефекту К+ в корі надниркових залоз людини, визначали вміст нуклеотиду в залежності від концентрації калію в інкубаційному середовищі.
Аналіз залежності продукції cAMP корою надниркових залоз людини від концентрації іонів калію дозволив продемонструвати, що при збільшенні концентрації іонів калію до 8,5 мМ продукція cAMP зростає в 4 рази і становить 0,62 ± 0,15 пмоль/мг тканини. В умовах відсутності калію вміст cAMP становить 0,14 ± 0,02 пмоль/мг тканини. Зростання кількості cAMP також спостерігалось за умов стимуляції тканини калієм в клітинах кори надниркових залоз морських свинок [Pushkarev, Mikosha, 1991].
Крім того, у присутності інгібітору ПКА фосфорилювання білків при 5,5 мМ К+ в надниркових залозах морських свинок вірогідно зменшувалося [Пушкарьов, 2005]. Ці дані свідчать про можливу участь ПКА у посиленні регуляторного сигналу К+ в адренокортикоцитах морських свинок, як це спостерігається при дії АКТГ. Пряме визначення активності ПКА в мікросомній фракції за інтенсивністю фосфорилювання специфічного субстрату – кемптиду показало, що калій активує цю кіназу, хоча амплітуда активації виявилась нижчою порівняно з ПКС. Як і у випадку ПКС, при концентрації калію в середовищі, нижчій від фізіологічної (3,5 мМ), активність ПКА в мікросомній фракції знижується, при збільшенні концентрації калію до 8,5 мМ активність ПКА також зростає до рівня 4,16 ± 0,83 нмоль субстрату х хв-1 х мг-1 білка. Активність ПКА в цитозольній фракції зростає при збільшенні концентрації калію. У фізіологічних умовах активність ПКА в цитозольній фракції визначалася на рівні 2,11 ± 0,14 нмоль субстрату х хв-1 х мг-1 білка, при збільшенні концентрації калію до 8,5 мМ вона сягала 3,04 ± 0,38 нмоль субстрату х хв-1 х мг-1 білка.
На відміну від цитозолю та мікросом, активність ПКА в ядрах, при визначенні фосфорилювання білків в безклітинній системі, практично не змінюється [Пушкарьов, 2005]. Останній факт може свідчити про те, що основні субстрати цієї кінази знаходяться в цитоплазмі адренокортикоцитів.
Таким чином, базуючись на одержаних нами даних та даних літератури можна стверджувати, що перенесення регуляторних сигналів іонів калію в адренокортикоцитах є значно складнішим процесом, ніж вважалось до цього часу. Ефект підвищених концентрацій іонів калію в адренокортикоцитах реалізується за участю різних месенджерних систем. У перенесенні активуючого сигналу іонів калію в адренокортикальних клітинах можуть брати участь cAMP-залежна протеїнкіназа [Pushkarev, Mikosha, 1991], кальмодулін-залежна протеїнкіназа [Condon et al., 2002], протеїнкіназа С [Betancourt-Calle et al., 2001; Pushkarev et al., 1994]. В результаті активації протеїнкіназ та фосфатаз відбувається фосфорилювання та дефосфорилювання клітинних білків, що обумовлює фізіологічну відповідь клітини.
Отже, можна вважати, що отримані результати обґрунтовують нову концепцію щодо участі регуляторів адренокортикальної функції у формуванні адаптаційних реакцій, які здійснюються безпосередньо наднирковими залозами. Аналіз механізмів взаємодії на молекулярному рівні агоністів, причетних до регуляції адренокортикальної функції і проліферації клітин кори надниркових залоз, переконливо доводить, що ця взаємодія реалізується шляхом низки трансрегуляторних впливів систем внутрішньоклітинних месенджерів, починаючи з першої ланки їхньої дії – рецепції на плазматичній мембрані.
ВИСНОВКИ
1. Обґрунтовано концепцію мультифакторного контролю регуляції гормонопоезу в корі надниркових залоз, взаємодії між різними системами вторинних месенджерів, які опосередковують внутрішньоклітинне перенесення сигналів агоністів, та їх трансрегуляторні впливи. Універсальність мережі месенджерних систем, які запускаються в адренокортикоцитах різними регуляторами – кортикотропіном, естрогенами, пролактином, іонами калію, дофаміном, N-ацильованими похідними етаноламіну, забезпечують реалізацію специфічної функції клітин кори надниркових залоз – синтез кортикостероїдних гормонів.
2. Збільшення активності cAMP-залежної протеїнкінази А, а також протеїнкінази С та її α-ізоформи в клітинах кори надниркових залоз та субклітинних фракціях під впливом АКТГ, естрадіолу, іонів калію свідчить про залучення до забезпечення їхньої регуляторної дії обох кіназних систем.
3. До подальшого перенесення сигналу АКТГ залучено сигнальний каскад протеїнкіназ, що активуються мітогенами, а також ядерні транскрипційні фактори. Серед них найбільш вагома роль у трансдукції сигналу АКТГ в адренокортикоцитах належить МАР-кіназі JNK та ядерному фактору транскрипції с-jun.
4. Виявлені під впливом АКТГ антиапоптичні зміни в клітинах надниркових залоз, оцінювані за зниженням вмісту каспази-3 і ступеня фрагментації ДНК, значною мірою визначаються активацією протеїнкінази С.
5. Встановлено дозозалежність зниження специфічного зв’язування тропних гормонів (АКТГ та пролактину) мембранами адренокортикоцитів за дії адренокортиколітичного препарату хлодитану.
6. В корі надниркових залоз людини основною ізоформою протеїнкінази С є Са2+/фосфоліпід-залежна α-ізоформа. Її експресія в адренокортикальній тканині істотно перевищує експресію інших досліджуваних ізоформ. Транслокація α-ізоформи з цитозольної до мікросомної фракції адренокортикоцитів значно посилюється в пухлинах кори надниркових залоз.
7. В субклітинних фракціях адренокортикоцитів людини експресуються всі Са2+-незалежні ізоформи протеїнкінази С.
8. Збільшення експресії тирозинкінази РТК спостерігається в адренокортикальних карциномах людини. Цей факт може бути теоретичним підґрунтям для використання експресії рецепторних тирозинкіназ як діагностичного маркера злоякісності при адренокортикальній патології.
9. Естрадіол бере участь в регуляції глюкокортикоїдної функції кори надниркових залоз. Дозозалежна стимуляція секреції 11-гідроксикортикостероїдів в дослідах in vitro на первинній культурі надниркових залоз свідчить про пряму дію гормону на адренокортикоцити. Про залучення до опосередкування дії естрадіолу in vivo центральних ланок гіпоталамо-гіпофізарно-адренокортикальної системи свідчить збільшення рівня кортикостероїдів в плазмі крові та нуклеїнових кислот в корі надниркових залоз, гіпофізі та гіпоталамусі.
10. Естрадіол in vitro та in vivo посилює продукцію кортикостероїдів в корі надниркових залоз. До реалізації цих ефектів в адренокортикальних клітинах залучені cAMP-залежна протеїнкіназа А та протеїнкіназа С.
11. Естрадіол викликає збільшення в корі надниркових залоз вмісту МАР-кінази ERK1/2 та ядерного фактора транскрипції с-fos.
12. Адреномодуляторна дія N-ацилетаноламінів in vitro виявляється у стимуляції включення міченого холестерину до синтезованих корою надниркових залоз щурів альдостерону та кортикостерону.
13. Виявлено модулюючий ефект N-ацилетаноламінів in vitro на функцію кори надниркових залоз: підвищення рівня 11-гідроксикортикостероїдів, що синтезуються корою надниркових залоз самок щурів, та зниження вмісту 11-гідроксикортикостероїдів в середовищі інкубації тканини кори надниркових залоз людини та самців щурів. N-ацилетаноламіни здійснюють свій стимулюючий ефект на кору надниркових залоз шляхом активації протеїнкінази С; зменшення стероїдогенезу забезпечується пригніченням утворення cAMP та протеїнкінази А.
Похожие работы
... інфаркт міокарда. Діагноз підтверджує підвищення вмісту в крові креатин-фосфокінази (зокрема її МВ-фракції), міоглобіну, С-реактивного протеїну, фібриногену та продуктів його розпаду. 2.2 Методи обстеження хворих при захворюваннях органів дихання Велике значення в діагностиці захворювання легень має топографічна і порівняльна перкусія та аускультація легень. У діагностиці захворювань ...
... ї системи, бездоганному дотриманні правил асептики і антисептики при проведенні інструментальних урологічних обстежень (цистоскопія, катетеризація тощо). ГЛАВА 2. КОМПЛЕКСНА ФІЗИЧНА РЕАБІЛІТАЦІЯ ПРИ ХРОНІЧНИХ ЗАПАЛЮВАЛЬНИХ ЗАХВОРЮВАННЯХ СЕЧОВИВІДНОЇ СИСТЕМИ (ПІЄЛОНЕФРИТ, ГЛОМЕРУЛОНЕФРИТ) НА ПОЛІКЛІНІЧНОМУ ЕТАПІ ФІЗИЧНОЇ РЕАБІЛІТАЦІЇ 2.1 Загальна характеристика засобів фізичної реабілітації ...



0 комментариев