Навигация
Морфологічні особливості медулобластом мозочка
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
імені О.О. БОГОМОЛЬЦЯ
ЧЕРНЕНКО ОКСАНА ГРИГОРІВНА
УДК 616.831 – 006.482 – 091.8
МОРФОЛОГІЧНІ ОСОБЛИВОСТІ МЕДУЛОБЛАСТОМ МОЗОЧКА
14.03.02 – патологічна анатомія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата медичних наук
Київ – 2008
Дисертацією є рукопис.
Робота виконана в Державній установі “Інститут нейрохірургії ім. акад. А.П. Ромоданова АМН України”.
Науковий керівник
доктор медичних наук, професор Шамаєв Михайло Іванович, ДУ “Інститут нейрохірургії ім. акад. А.П. Ромоданова АМН України”, керівник відділу нейропатоморфології.
Офіційні опоненти:
доктор медичних наук, професор Колесова Надія Арнольдівна, Інститут проблем патології Національного медичного університету імені О.О. Богомольця МОЗ України, завідуюча лабораторією структурного та метаболічного аналізу;
кандидат медичних наук, старший науковий співробітник Мельник Микола Миколайович, Інститут онкології АМН України, керівник групи імуногістохімії та електронної мікроскопії патологоанатомічного відділу.
Захист відбудеться “ _20_ ” __березня__ 2008 р. о 13.30 годині на засіданні спеціалізованої вченої ради Д 26.003.06 при Національному медичному університеті імені О.О. Богомольця МОЗ України (03057,
м. Київ, проспект Перемоги, 34).
З дисертацією можна ознайомитись у бібліотеці Національного медичного університету імені О.О. Богомольця МОЗ України (03057,
м. Київ, вул. Зоологічна, 1).
Автореферат розісланий “ 14 ” _лютого_ 2008 р.
Вчений секретар
спеціалізованої вченої ради О.М. Грабовий
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Медулобластома (МБ) – одна з найбільш злоякісних пухлин головного мозку, що переважно уражує дітей. В 1925 р., коли P. Baily та H. Cushing вперше описали це новоутворення, діагноз “медулобластома”, фактично, був вироком для хворих. З більше ніж 60 пацієнтів, яких спостерігав Кушинг, лише один пережив трирічний рубіж. “Лікування медулобластом задньої черепної ямки є найбільш похмурою сторінкою нейрохірургії”, – писав в 1954 р. D. Matson. За останні десятиріччя були розроблені спеціальні схеми променевої та хіміотерапії МБ, використання яких значно покращило результати лікування цих пухлин. Якщо в 60-ті роки пацієнти з МБ переважно гинули в перший рік-два після встановлення діагнозу, то наприкінці 90-х 55-60% хворих переживали 5-річний проміжок, і це особливо вражає, враховуючи що більшість з них – діти. На сьогоднішній день лікувальна тактика при МБ об’єднує хірургічне видалення пухлини, променеву та хіміотерапію. Опромінення головного та спинного мозку дозволяє знизити ризик метастазування, але з іншого боку призводить до віддалених побічних наслідків, таких як інтелектуальна та фізична недорозвиненість, ендокринні порушення, деформації хребта.
Різниця в темпах рецидивування у хворих з МБ, які отримали лікування за стандартною схемою, наводить на думку про біологічну гетерогенність цих новоутворень. Відомі випадки, коли деякі з хворих, яким не проводилось радикальної променевої терапії, жили довгі роки і навіть десятиріччя без виникнення метастазів. Але частіше буває так, що не зважаючи на призначення комбінованого лікування за сучасними схемами, проведення тотального краніоспінального опромінення та чисельних курсів хіміотерапії, як і раніше, основною причиною загибелі пацієнтів з МБ є розвиток імплантаційних метастазів в межах ЦНС та/чи продовжений ріст пухлини. Тому особливого значення набувають дослідження, які намагаються ідентифікувати прогностичне значення різних структурно-біологічних особливостей МБ, але результати цих робіт досить суперечливі.
Новітні розробки доводять, що впровадження для прогнозування перебігу та наслідків МБ лише клінічних чинників часто є недостатнім, а використання їх неадекватним для визначення ризику продовженого росту та метастазування, тому необхідний пошук нових маркерів на основі поглиблених клініко-морфологічних співставлень. Структурні та біологічні властивості МБ є більш надійними критеріями розподілу пацієнтів з цими пухлинами за групами ризику, що дозволяють раціоналізувати лікування, і, таким чином, збільшити його ефективність та запобігти побічних реакцій та створюють передумови для розробки нових терапевтичних стратегій. Можливо, що при комплексній (інтегральній) оцінці окремих чинників з’явиться можливість прогнозування на основі виявлення та вивчення клінічних, патоморфологічних і цитогенетичних ознак, які дадуть змогу більш чіткого визначення варіанту МБ та розподілу хворих з цими пухлинами за групами ризику.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконувалась у рамках наукової тематики, затвердженої АМН України: “Вивчити структурно-біологічні та клінічні особливості медулобластом мозочка і пухлин стовбуру мозку з метою підвищення ефективності їх комбінованого лікування” № держреєстрації НДР 0104U000410, і “Вивчити морфологічні, генетичні та клінічні особливості вроджених пухлин головного мозку у дітей та розробити методи їх ранньої діагностики, прогнозування та комбінованого лікування” № держреєстрації НДР 0107U001197.
Мета дослідження. Покращення результатів морфологічної діагностики медулобластом мозочка шляхом конкретизації основних диференціально-діагностичних критеріїв та встановлення прогностично-вагомих клініко-морфологічних ознак.
Задачі дослідження:
1. Вивчити топографо-анатомічні особливості росту медулобластом мозочка та встановити їх вплив на перебіг захворювання.
2. Виділити структурні варіанти медулобластом мозочка в залежності від їх здатності до клітинного диференціювання та вивчити особливості перебігу різних варіантів хвороби.
3. Дослідити проліферативну і апоптотичну активність пухлинних клітин в медулобластомах мозочка, співставити отримані результати з їх гістоструктурою та визначити можливий вплив вказаних чинників на прогноз захворювання.
4. На основі порівняння гістологічних та цитологічних показників, морфофункціонального стану ядерцеутворюючих регіонів у співставленні з проліферативною активністю пухлин конкретизувати певні типи медулобластом мозочка.
5. Визначити вплив морфологічних ознак (гістологічних, цитологічних, імуногістохімічних) на показники трирічного безрецидивного виживання, виділити прогностично сприятливі та несприятливі чинники перебігу медулобластом мозочка, а також сформулювати клініко-морфологічні критерії груп ризику.
Об’єкт дослідження – морфологічні особливості медулобластом мозочка та їх зміни при продовженому рості і метастазуванні цих пухлин.
Предмет дослідження – зразки пухлинної тканини медулобластоми мозочка, які отримані під час першої і повторних операціях з приводу продовженого росту та метастатичного ураження цими пухлинами інших відділів ЦНС.
Методи дослідження – за допомогою гістологічних методів були визначені якісні і кількісні морфологічні відмінності серед різних гістологічних підтипів МБ мозочка. Для дослідження проліферативної активності клітин МБ використовували імуногістохімічну реакцію. Цитологічні і цитогенетичні методики дозволили встановити особливості клітинного складу МБ, співвідношення в цих клітинах різних морфофункціональних підтипів ядерець та рівень апоптозу. За допомогою електронно-мікроскопічного методу були вивченні ультраструктурні особливості клітин МБ визначених цитоморфологічних типів. Статистичний аналіз отриманих даних дозволив встановити достовірні відмінності між групами та оцінити вірогідність запропонованих прогностичних критеріїв.
Наукова новизна одержаних результатів. В результаті проведених морфологічних досліджень на основі сукупності цитологічних ознак та їх систематизації виділені три клітинних типи медулобластом мозочка. Встановлено, що найбільш прогностично несприятливим є третій цитоморфологічний тип, який відрізняється наявністю різко поліморфних клітин неправильної форми, розміри котрих коливаються від 9 до 32 мкм, з округлими гіпо- або нормохромними ядрами з 1-5 мікроядерцями, а також клітин з ядрами зміненої конфігурації з ознаками анізотропії та грубодисперсним розподілом хроматину. Наявність третього типу обумовлює показники трирічного безрецидивного виживання лише на рівні 21%, тоді як при інших варіантах клітинного складу медулобластом вони становлять 49%.
Встановлені морфологічні особливості ядерцеутворюючих регіонів в клітинах медулобластом мозочка та їх функціональна активність. Доведено, що відсотковий вміст ядерець в ядрі та їх розподіл відрізняється відповідно до встановлених цитоморфологічних типів цих пухлин. Найвищі показники вмісту активних ядерцевих форм притаманні клітинам пухлин третього цитоморфологічного типу, загальна кількість ядерцевих утворень в яких досягала 5,09±0,69%, компактних та нуклеолонемних – до 2,4±0,1% та 1,94±0,45% відповідно.
Проведені порівняння цитологічних ознак медулобластом з їх патогістологічними і імуногістохімічними характеристиками, результати яких покладені в основу оптимізації діагностики, прогнозування та лікування цих пухлин.
Встановлено, що до несприятливих прогностичних чинників перебігу медулобластом мозочка, які мають безпосередній вплив на показники трирічного безрецидивного виживання пацієнтів цієї категорії, відноситься інфільтрація дна ІV шлуночка (Т3b-Т4 стадії за Chang), наявність мікро- та макрометастазів на момент першої операції, субтотальний або частковий об’єм оперативного видалення пухлини, десмопластичний варіант її будови, переважно у дітей віком після 3 років, значення апоптозного індексу вище 1,5%, а також наявність третього цитоморфологічного типу.
Практичне значення одержаних результатів. На підставі проведених морфологічних досліджень удосконалено діагностику медулобластом мозочка, а також принцип розподілу хворих на групи високого та стандартного ризику. В основу цього розподілу покладено комплекс морфологічних та клінічних ознак: група стандартного ризику – Т1-Т3а, М0 стадії за класифікацією Chang, повне або майже повне видалення пухлини, апоптозний індекс нижчий або рівний 1,5%, І або ІІ цитоморфологічний тип; група високого ризику – Т3b-Т4 стадії за класифікацією Chang, наявність мікро- та макрометастазів на момент першої операції, субтотальний або частковий об’єм хірургічного видалення, апоптозний індекс більший за 1,5%, наявність ІІІ цитоморфологічного типу.
Конкретизовані морфологічні діагностичні та прогностичні критерії різних типів медулобластом, що покращить їх діагностику і дасть можливість в клініці реалізувати диференційовані підходи до комплексного лікування цих новоутворень та індивідуалізувати його схеми.
Цитологічні та цитогенетичні дослідження та розроблені за матеріалами дисертації критерії розподілу МБ за цитоморфологічними типами впроваджено в практику роботи відділу нейропатоморфології Інституту нейрохірургії ім. акад. А.П. Ромоданова АМН України.
Особистий внесок здобувача. Дисертантом особисто обґрунтовано актуальність проведеного дослідження, сформульовані мета і завдання роботи, здійснено аналіз наукової літератури та встановлено об’єм дослідження, згідно з яким проведений відбір тематичних історій хвороби. Автором самостійно опрацьовані методики дослідження, особисто виконано весь обсяг цитоморфологічних і цитогенетичних досліджень різних типів МБ мозочка, проведено аналіз результатів гістологічного та імуногістохімічного дослідження, статистичне опрацювання матеріалу та узагальнення одержаних даних.
Апробація результатів дисертації. Основні положення дисертаційної роботи доповідались на III-му з’їзді нейрохірургів України (Алушта, Крим, 2003 р.), конференції нейрохірургів: Нові технології в нейрохірургії (Ужгород, 2006 р.), ХІ-му з’їзді онкологів України (Судак, АР Крим, 2006 р.), Всеукраїнській науково-практичній конференції, присвяченій 100-річчю з дня народження професора Н.М. Шінкермана (Чернівці, 2007 р.), представлена стендова доповідь на Всеукраїнській науково-практичній конференції з міжнародною участю: Молекулярні основи і клінічні проблеми резистентності до лікарських засобів (Київ, 2006 р.).
Апробація дисертації відбулась на розширеному засідання вченої ради Інституту нейрохірургії ім. акад. А.П. Ромоданова АМН України сумісно з кафедрами нейрохірургії НМАПО ім. П.Л. Шупика та НМУ імені О.О. Богомольця.
Публікації. За темою дисертації опубліковано 8 наукових праць, з них 3 статті у фахових виданнях, рекомендованих ВАК України (в т.ч. 1 одноосібна).
Структура та обсяг дисертації. Дисертація складається зі вступу, огляду літератури, опису матеріалів та методів, двох розділів власних досліджень, аналізу і узагальнення результатів досліджень, висновків, списку використаних джерел та додатку зі списком пацієнтів. Основний текст дисертації викладено на 123 сторінках машинописного тексту, ілюстровано 17 таблицями та 62 рисунком. Бібліографічний перелік містить 342 джерела, з них 95 кирилицею та 247 латиною.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали і методи дослідження. Для вирішення поставлених у роботі завдань були проведені морфологічні дослідження зразків пухлинної тканини у співставленні з клінічними даними 136 пацієнтів, які були прооперовані в Інституті нейрохірургії ім. акад. А.П. Ромоданова АМН України з приводу МБ мозочка з 2000 по 2006 р. У тому числі були включені 11 пацієнтів, які перенесли першу операцію раніше, але в цей період поступили повторно у зв’язку з продовженим ростом пухлини чи появою метастазів. Серед пацієнтів – 86 чоловіків та 50 жінок (співвідношення чоловіків та жінок 1,72 : 1); 97 – у віці від 7 місяців до 17 років (71,3%) та 39 пацієнтів 18-48 років (28,7%). В 97 випадках пухлина локалізувалась в задній черепній ямці по середній лінії (черв’як мозочка, ІV шлуночок), в 39 випадках – вона розташовувалась виключно в одній з півкуль мозочку.
Аналіз клінічних та інструментально-лабораторних показників проводився на підставі записів в медичній документації (історія хвороби та амбулаторна карта пацієнта). Для топографо-анатомічної характеристики росту МБ використовувалась загальновживана в нейроонкологічній практиці класифікація за Chang (1969).
Матеріал біопсій для гістологічного та імуногістохімічного дослідження відразу після доставки фіксувався у нейтральному формаліні. Отримані з парафінових блоків мікротомні зрізи товщиною
5-8 мкм переносились на предметні скельця та фарбувались. Загальна гістоархітектоніка пухлини оцінювалась за оглядовими препаратами забарвленими гематоксиліном та еозином. Відповідно до гістобіологічної класифікації (Б.С. Хомінський, 1962; Ю.П. Зозуля, Т.П. Верхоглядова, М.І. Шамаєв, Т.А. Малишева, 2000) виділяли: МБ “класичної” структури, десмопластичні МБ, МБ з гліальним диференціюванням, МБ з епендимарним диференціюванням, МБ з нейрональним диференціюванням, дрібноклітинні малодиференційовані МБ.
Використовувались наступні спеціальні методи фарбування: забарвлення гематоксиліном та пікрофуксіном (за Ван-Гізоном), сріблення за Гоморі, забарвлення тіоніном за Нісселем. Визначення проліферативної активності пухлинних клітин здійснювалось шляхом виявлення нуклеопротеїну Кі-67 непрямим імуногістохімічним пероксидазним (DAB) методом.
Для цитологічного та цитогенетичного дослідження готувалися препарати-відбитки пухлинної тканини з нефіксованого біоптичного матеріалу. Цитологічні препарати фарбувались за Папенгеймом і паралельно гематоксиліном та еозином. Для виявлення ядерцевих організаторів та клітин в стані апоптозу використовувався метод сріблення за Хоуел-Блеком з додатковим електронно-мікроскопічним дослідженням ультраструктурних особливостей клітин визначених цитоморфологічних типів.
Для кількісної оцінки структурних ознак використовувався апаратно-програмний комплекс для морфологічних досліджень клітин у складі: мікроскоп біологічний, цифрова камера та програмний модуль для обробки і аналізу цифрових зображень клітин виробництва фірми “Leica Microsystems CMS GmbH”, (Німеччина). Дослідження проводилось в 20 репрезентативних полях зору зі стандартною вимірною рамкою при збільшенні 400. Індекс мічення (ІМ) Кі-67 розраховувався як відношення числа позитивно забарвлених ядер на 100 клітин. Апоптозний індекс (АІ) визначався шляхом підрахунку кількості апоптозних тілець та його еквівалентів на 1000 клітин препарату-відбитка срібленого за методом Хоуел-Блека (20 полів зору по 50 клітин). При аналізі ядерцевих організаторів, відповідно до класифікації П.В. Челідзе, О.В. Зацепіна (1988), підраховувались всі зерна срібла, які окремо розпізнавались, як в самих ядерцях, так і в ядрах в 400 клітинах кожного препарату (10 полів зору по 40 клітин),
Статистична обробка проводилась з використанням пакета програм Statistica 5.0.
Результати досліджень. В результаті вивчення топографо-анатомічних характеристик росту МБ мозочка було встановлено, що як у дітей, так і у дорослих, ці пухлини характеризуються інвазивним поширенням. Частка Т3-Т4 стадій за Сhang (1969) становила 92,8%, інфільтрація дна IV шлуночка спостерігалася у 40,5% випадків МБ черв’яка мозочка у дітей та у 66,6% у дорослих пацієнтів. У дитячому віці відмічалось більш поверхневе розташування пухлини у порожнині IV шлуночка з ростом по поверхні епендимарного покриву з наступним розповсюдженням у ділянку центрального каналу, у дорослих пацієнтів спостерігалась більш виразна інфільтрація дна IV шлуночка та частіше мало місце поширення пухлини на вентральну поверхню стовбуру мозку – 15,4%, що майже в два рази перевищує подібні показники у дітей.
Ми встановили, що розподіл МБ за структурними підтипами відрізнявся в різних вікових групах. Виявилось, що у пацієнтів 18-48 років, МБ “класичної” будови значно переважали над іншими підтипами цих пухлин та становили 61,5% від усіх спостережень в цій групі, частка пухлин цього підтипу у пацієнтів віком до 18 років – 33%. Дрібноклітинні малодиференційовані МБ становили другий за чисельністю підтип МБ, як у дорослих, так як і у пацієнтів дитячого віку (12,8% та 25,7% відповідно). Пухлини з варіантами епендимарного та гліального диференціювання у дорослих зустрічались нечасто (7,7% та 2,6% відповідно). На відміну, у дітей ці підтипи були представлені серед більшого числа спостережень (17,5% та 12,4%). Виключення становили лише випадки МБ із здатністю до нейронального визрівання – у старших пацієнтів вони зустрічались частіше (7,7%), чим у дітей (2,1%). Тобто, з перерахованого можна зробити висновки, що тенденція до клітинного диференціювання виразніша в молодшому віці.
Медулобластоми, як відомо, виявляють тенденцію до субарахноідальної дисемінації пухлинних елементів з формуванням імплантаційних метастазів. На момент первинної діагностики дисемінація процесу підтверджується у 22,1% усіх випадків (це 23,7% пацієнтів до 18 років та 18% – дорослих).
У різні строки після першої операції у 30,1% від усіх спостережень виявлялись ознаки продовженого росту МБ та/чи метастатичне ураження (24,7% серед випадків дитячих МБ та 42,6% з групи дорослих пацієнтів). Час від першої операції до моменту виявлення продовженого росту та/чи метастазів у дітей становив від 2,5 місяців до 3,5 років (M±m 16,9±2,3 місяці), а у дорослих пацієнтів від 6 місяців до 14 років (M±m 42±11,7 місяці) відповідно. У пацієнтів дитячого віку частота метастазування (14,4%) була вище ніж відсоток продовженого росту (11,3%), навпаки, в групі дорослих пацієнтів ризик продовженого росту пухлини (38%) значно переважає над часткою метастатичного ураження (17,2%).
Проведені дослідження морфологічних змін у пухлинній тканині метастазів МБ та при продовженому рості, порівняно з матеріалом первинних пухлин, дали змогу виявити певні чіткі закономірності. Насамперед це стосується трансформації типової гістоархітектоніки, внаслідок чого зменшується кількість патогномонічних для МБ “класичної” структури псевдорозеток Хомера-Райта та колонарних структур, вони стають менш чіткими, “змазаними”. Розташування пухлинних елементів втрачає свою періодичність та відносну рівномірність, характерну для первинних МБ, замість цього визначаються вогнищеві густоклітинні скупчення, які межують з більш пухкими ділянками, серед яких розсіяні окремі злоякісні клітини. Вказані зміни виявлялись не лише в “класичних” МБ. В усіх варіантах, які в тій чи іншій мірі були здатні до різних типів клітинного диференціювання, виникала певна тенденція до зменшення ступеня “зрілості”, тобто гістотип МБ, в умовах рецидиву хвороби, наближався до дрібноклітинного малодиференційованого. Такі зміни ми вважаємо специфічними проявами пухлинної прогресії, на відміну від інших знахідок, як то – вогнища некрозів з появою багатоядерних клітин, сполучнотканинна активація у оболонах мозку, дегенеративні зміни стінок судин з проявами порушення мікроциркуляції. Останні можуть свідчити як про реактивні процеси в тканинах прилеглих до зони інвазії, так і у випадках продовженого росту можуть бути наслідком впливу променевої терапії.
За нашими даними кількість мітозів у різних зразках пухлинної тканини значно коливалась. На матеріалі перших операцій середнє значення мітотичного індексу (МІ) становило (M±m 0,41±0,07%). Крива розподілу частот в залежності від значення МІ мала двохфазний характер, на основі чого всі досліджені зразки були розподілені на дві неоднорідні групи: з низькими та більш високими показниками мітотичної активності. У 11% випадків МБ мали дуже низькі показники мітозу, 50% – показували значення мітотичного індексу близькі до вказаного середнього, для решти 29% МБ – значення МІ коливались від 0,33% до 1,2%, з максимумом частоти при значенні МІ=0,78%, та суттєво не відрізнялись в різних вікових групах. У випадках продовженого росту на матеріалі повторних операцій МІ дещо зростав (M±m 0,58±0,06%), але різниця не була достовірна (р>0,05).
Експресія ядерного антигена Кі-67 спостерігалась в усіх досліджених зразках. Для того, щоб виявити можливі коливання індексу мічення (ІМ) Кі-67 було виділено кілька груп: до першої були включені пацієнти з тривалістю безрецидивного виживання (БРВ) більше 12 місяців, до другої випадки продовженого росту, третю групу складали метастази. Всі ці випадки співставлялись з матеріалом першої операції та досліджувались в динаміці. Значення ІМ Кі-67 в МБ у пацієнтів з БВ >12 місяців коливались від 14,7% до 34,2% (M±m 24,66±1,5%). У другій дослідній групі з випадками продовженого росту МБ, коли паралельно досліджували матеріал першої та другої операцій, значення ІМ Кі-67 на матеріалі перших операцій становили від 17,9% до 42,3% (M±m 29,54±2,32%). Значення ІМ Кі-67 при продовженому рості коливались від 19,1% до 41,6% (M±m 31,34±1,8%). Тобто різниця в проліферативній активності первинних та рецидивних пухлин суттєво не відрізнялась та її показники мали близькі значення в різних вікових групах. Але при співставленні динаміки змін ІМ Кі-67 в індивідуальних спостереженнях МБ були виявлені хвилеподібні коливання проліферативної активності, як в один, так і в інший бік. Цей факт може свідчити, по-перше, що біологічні особливості росту МБ носять нелінійний характер, а по-друге це може бути обумовлене впливом протипухлинного лікування.
Порівняльний аналіз первинних та метастатичних пухлин виявив достовірну відмінність та особливості розподілу Кі-67 позитивних клітин в метастатичних вогнищах. Індекс мічення Кі-67 в первинних пухлинах цієї групи становив М±m 35,9±3,04%, а на матеріалі метастазів – М±m 21,88±1,97% (р<0,05). Розподіл Кі-67 позитивних клітин в зразках метастатичної пухлини був нерівномірний, власне пухлинний вузол найчастіше виявлявся негативним, чи демонстрував слабку експресію цього антигену. Найбільша активність спостерігалась в зонах інвазії пухлини, де різко позитивні клітини утворювали ланцюжки та вогнищеві скупчення. Також високі показники ІМ Кі-67 реєструвались навколо судин, в периадвентиціальних пухлинних комплексах.
Апоптозні ядра виявлялись, як в “класичних” МБ, так і в інших структурних підтипах цих пухлин, але найбільш високі показники апоптозного індексу (АІ) спостерігались при десмопластичному варіанті. Розподілення апоптозних ядер в МБ було, як правило, нерівномірне, вони частіше зустрічались в густоклітинних ділянках пухлини, а також навколо некротичних вогнищ. При дослідженні АІ спостереження розподілялись на декілька груп, за аналогією з тими, які виділялись для аналізу проліферативної активності.
Значення АІ в МБ у пацієнтів з БВ>2 місяців коливалось від 0,1% до 0,9% (M±m 0,41±0,06%). У другій групі значення АІ на матеріалі перших операцій коливалось від 0,4% до 1,2% (M±m 0,67±0,07%), а при продовженому рості АІ знаходився у інтервалі від 0,4% до 3,8% (M±m 1,18±0,24, р=0,05). Деяке підвищення рівня апоптозу при продовженому рості МБ можливо пов’язане з впливом опромінення та його некротизуючою дією на пухлинну тканину, що непрямо могло сприяти появі більшої кількості клітин в стані апоптозу навколо зон променевої деструкції.
За результатами співставлення матеріалу перших операцій з тканиною метастазів, які видалялись під час першої операції разом з основним пухлинним вузлом, або метастазів видалених з головного чи спинного мозку під час повторної операції була виявлена достовірна різниця (р=0,04). Апоптозний індекс в первинних пухлинах становив 2,74±0,77%, а в тканині метастазів – 6,41±1,06%, тобто в метастатичних вогнищах різко підвищувалась апоптотична активність.
З отриманих нами даних, коли порівнювався рівень апоптозу в групах, відмінних за показниками безрецидивного виживання та проявами прогресуючого перебігу, були виявлені чіткі статистично-вірогідні відмінності у пацієнтів з високим ризиком метастатичного ураження (р=0,001). Той факт, що дані результати були встановлені на матеріалі первинних пухлин, ще до призначення курсу комбінованого лікування, підтверджує вагу цього показника у прогнозуванні перебігу МБ. Тобто АІ вищий або рівний 1,5% можна вважати фактором ризику метастазування цих пухлин.
Аналіз морфологічної структури МБ виявив, що ці пухлини не тільки відрізняються між собою тканинною архітектонікою, але й неоднорідні за клітинним складом. Нами були описані чисельні клітинні форми, які входять до складу МБ. За сукупністю цитоморфологічних ознак та на підставі їх систематизації та морфометричного обчислення, нами були виділені за клітинним складом три варіанти (типи) МБ.
Перший тип – відносно однорідного складу, серед якого переважають клітини невеликого розміру 8-15 мкм з дрібним ядром округлої форми та чіткими контурами та слабо розвиненою, або зовсім невираженою цитоплазмою. Ці клітини вирізняються за структурою хроматину, переважно дрібноглибчастою з окремими грубими хроматиновими зернами та поодинокими компактними ядерцями з нечіткими контурами. В меншій кількості зустрічаються клітини з ядрами видовженої форми та не дуже чіткою ядерною мембраною з помірною кількістю зернистого та глибчастого хроматину.
Другий тип утворюють декілька клітинних форм, які при цьому не дуже відрізняються між собою за розміром та формою. Переважають одноманітні клітини, 8-12 мкм, з невеликим ядром і структурним ядерцевим утворенням та дрібні клітини, 7-11 мкм, з округлим ядром, багатим на хроматин, та слаборозвиненою цитоплазмою, які нагадують середній лімфоцит. Поряд з ними виявляються клітини видовженої форми з нормохромними ядрами.
Третій тип характеризується наявністю різко поліморфних клітин, розміри яких коливаються від 9 до 32 мкм. Переважно це клітини неправильної вугловатої форми з округлим гіпо- або нормохромним ядром, в якому визначаються компактні мікроядерця (від одного до п’яти) та клітини з ядрами порушеної конфігурації, з ознаками анізохромії та грубопетлистим розподілом хроматину. Часто виявлялись клітини в стані прямого мітотичного поділу. Знайдені клітинні форми були більш-менш густо розсіяні між більш типовими елементами МБ.
Використання високоспецифічної та в достатній мірі об’єктивної методики сріблення кислих негістонових білків дозволило не лише виявити ядерцеутворюючі регіони, але і визначити ступінь їх активності, який безпосередньо був пов’язаний зі структурою та функціональним станом клітин, які досліджуються. Вміст аргірофільних білків, які асоційовані з ділянками ядерцевих організаторів, був значно вище в МБ, порівняно з клітинами інтактного зернистого шару мозочка, який досліджувався в якості контрольного зразка та тканинами у нормі (p<0,05), що пов’язано з суперекспресією цих білків в клітинах з високим рівнем проліферації.
Серед низькодиференційованих пухлинних клітин, які входять до складу першого цитологічного типу, порівняно з контролем різко зростала кількість високоактивних компактних ядерець (M±m 0,87±0,11%), та в меншій мірі нуклеолонемних (M±m 0,50±0,1%); при цьому кількість кільцеподібних ядерець суттєво не змінювалась (M±m 0,24±0,1%), а вміст неактивних мікроядерець знижувався (M±m 0,21±0,01).
Другий цитологічний тип відрізнявся як більш високою загальною проліферативною активністю, так і показниками вмісту окремих ядерцевих форм, а саме – характерним збільшенням вмісту не лише компактних (M±m 3,95±1,24%), але і кільцевидних ядерець (M±m 1,12±0,54%).
Найвищі показники вмісту активних ядерцевих форм показували клітини, що були віднесені до третього цитологічного типу. Загальна кількість ядерцевих утворень у цьому випадку збільшувалась до (M±m 5,09±0,69%), компактних та нуклеолонемних – до 2,04±0,1% та 1,94±0,45% відповідно.
Тобто, дослідження ядерцевих структур дало змогу додатково та більш достовірно верифікувати виділені нами цитологічні типи, а також, на основі існуючих кореляцій між показниками активних ядерцевих форм з проліферативною активністю клітини, виявити ще один критерій злоякісності для МБ. Опираючись на отримані результати ми встановили, що наявність третього цитологічного типу є несприятливим прогностичним фактором, який необхідно враховувати при аналізі перебігу МБ.
В одноваріантному аналізі були досліджені клінічні та гістобіологічні чинники, які впливають на виживання (табл. 1).
Таблиця 1
Вплив клінічних та морфологічних чинників на тривалість трирічного безрецидивного виживання (3-БРВ)
| Чинник | (3-БРВ), % | р | |
| Вік: (0-17 років) (18-48 років) | 47 37 | 0,2 | |
| Стать: чоловіча жіноча | 38 53 | 0,4 | |
| Первинна локалізація пухлини: черв’як гемисфера | 35 66 | 0,9 | |
| Стадія (Т), за Chang: Т2-Т3а Т3b-T4 | 40 23 | 0,04 | |
| Стадія (М), за Chang: М0 М1 М2-М4 | 58 18 12 | 0,04 | |
| Об’єм оперативного втручання: тотальне – майже тотальне видалення субтотальне – часткове видалення | 57 12 | 0,01 | |
| Гістопатоло-гічний тип | МБ: “класичної” будови десмопластичні | 46 35 | 0,049 |
| МБ: недиференційовані з ознаками клітинного (гліального, епендимарного) диференціювання | 46 30 | 0,06 | |
| Експресія Кі-67 | Не впливає | – | |
| Апоптозний індекс: ≤1,5% >1,5% | 68 12 | 0,0001 | |
| Цитоморфологічний тип: І, ІІ ІІІ | 49 21 | 0,03 | |
Терміни безрецидивного виживання у групі досліджень розподілялись наступним чином (рис.1).
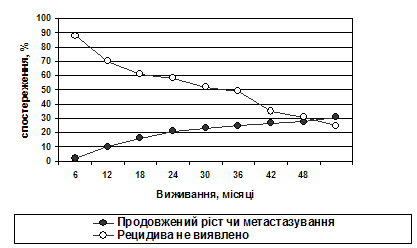
Рис. 1. Терміни безрецидивного виживання (вся група)
Таким чином, на трирічне безрецидивне виживання впливають наступні фактори: топографо-анатомічні особливості росту (інфільтрація дна IV шлуночка, вростання у стовбурові відділи головного мозку), наявність мікро- та макрометастазів на момент першої операції, об’єм оперативного видалення пухлини, гістологічний варіант будови, значення апоптозного індексу, виявлення певного цитоморфологічного типу.
ВИСНОВКИ
В роботі вирішена актуальна медична задача – визначені морфологічні особливості медулобластом мозочка та на підставі проведеного клініко-морфологічного співставлення виявлені незалежні прогностичні чинники перебігу цих пухлин, які впливають на показники трирічного безрецидивного виживання.
1. До несприятливих прогностичних чинників перебігу медулобластом мозочка відносяться інфільтрація дна IV шлуночка (Т3b-Т4 стадії за класифікацією Chang), наявність мікро- та макрометастазів на момент першої операції, а також субтотальний або частковий об’єм хірургічного видалення пухлини.
2. Специфічними морфологічними проявами пухлинної прогресії у випадках продовженого росту і метастазування медулобластом є трансформація типової гістоархітектоніки з переважанням дрібноклітинного малодиференційованого типу будови.
3. Лікувальний патоморфоз після проведеної променевої терапії характеризується сполучнотканинною активацією у оболонах мозку, дегенеративними змінами стінок судин з проявами порушення мікроциркуляції, вогнищами некрозів, появою багатоядерних клітин.
4. Диференціальна діагностика між гістологічними варіантами медулобластом має прогностичне значення у дітей віком після 3 років, у яких встановлена вірогідна різниця між показниками трирічного безрецидивного виживання при десмопластичній медулобластомі (35%) і медулобластомі “класичного” типу (46%).
5. Морфологічний прогноз росту медулобластом пов’язаний зі співвідношенням між показниками проліферативної активності та смерті клітин; особливо важливе значення мають показники апоптозного індексу. При всіх гістологічних варіантах медулобластом вони корелюють із можливістю метастазування цих пухлин: рівень апоптозного індексу більший 1,5% слід вважати несприятливим чинником, який співпадає з їх прогредієнтним перебігом.
6. Особливості клітинного складу медулобластом дозволяють виділити три цитоморфологічних типи цих пухлин (І, ІІ, ІІІ). Найбільш прогностично несприятливим є третій цитоморфологічний тип, який відрізняється наявністю різко поліморфних клітин, розміри котрих коливаються від 9 до 32 мкм. Відображенням проліферативної активності клітин медулобластоми є показники морфофункціональних типів ядерець, відсотковий вміст котрих коливається від 1,82±0,34% до 5,09±0,69% і який разом з особливостями їх розподілу вірогідно характеризує певні цитологічні типи цих пухлин.
7. Доцільно проводити прогностичний розподіл пацієнтів з медулобластомами за морфологічними ознаками на дві групи ризику: група стандартного ризику – Т1-Т3а, М0 стадії за класифікацією Chang, повне або майже повне видалення пухлини, апоптозний індекс нижчий або рівний 1,5 %, І або ІІ цитоморфологічний тип; група високого ризику – Т3b-Т4 стадії за класифікацією Chang, наявність мікро- та макрометастазів на момент першої операції, субтотальний або частковий об’єм хірургічного видалення, апоптозний індекс більший за 1,5%, наявність ІІІ цитоморфологічного типу будови.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
Пропонуються діагностичні підходи до визначення морфологічних особливостей медулобластом мозочка для використання в практичній роботі спеціалізованих нейохірургічних закладів.
Операційний матеріал, отриманий від пацієнтів з медулобластомами мозочка необхідно досліджувати не лише стандартними гістологічними методиками, але і з використанням цитогенетичних методів визначення ядерцевих організаторів із морфометричним аналізом.
На підставі проведених морфологічних досліджень доцільно проводити прогностичний розподіл пацієнтів з медулобластомами за клініко-морфологічними ознаками на групи високого та стандартного ризику.
Пацієнтам, які за визначеними критеріями відносяться до високої групи ризику, має бути індивідуалізована лікувальна тактика для попередження можливої прогресії медулобластоми (продовженого росту, метастазування).
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
0 комментариев