Навигация
Морфофункціональні закономірності змін в міокарді щурів при експериментальному гіпотиреозі та його корекції
Міністерство охорони здоров’я України
Національний медичний університет імені О.О. Богомольця
Петренко Володимир Анатолійович
УДК: 616.127-018:616.441-008.64-085
МОРФОФУНКЦІОНАЛЬНІ ЗАКОНОМІРНОСТІ ЗМІН
В МІОКАРДІ ЩУРІВ ПРИ ЕКСПЕРИМЕНТАЛЬНОМУ ГІПОТИРЕОЗІ ТА ЙОГО КОРЕКЦІЇ
14.03.09 – гістологія, цитологія, ембріологія
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Київ – 2008
Дисертацією є рукопис.
Робота виконана в Національному медичному університеті імені
О.О. Богомольця МОЗ України.
Науковий керівник
доктор біологічних наук, професор Стеченко Людмила Олександрівна, Національний медичний університет імені О.О. Богомольця МОЗ України, професор кафедри гістології та ембріологіїю.
Офіційні опоненти:
доктор біологічних наук, професор Квітницька-Рижова Тетяна Юріївна, Інститут геронтології АМН України, завідуюча лабораторією морфології і цитології;
доктор медичних наук, старший науковий співробітник Захарова Валентина Петрівна, Інститут серцево-судинної хірургії імені М. М. Амосова АМН України, завідуюча відділом патоморфології.
Захист відбудеться „8” травня 2008 р. о 1330 годині на засіданні спеціалізованої вченої ради Д 26.003.06 у Національному медичному університеті імені О. О. Богомольця МОЗ України (01601, м. Київ-601, бульвар Шевченка, 13; тел. 234-60-63).
З дисертацією можна ознайомитись у бібліотеці Національного медичного університету імені О. О. Богомольця МОЗ України (03057, м. Київ, вул. Зоологічна, 1).
Автореферат розісланий „07” квітня 2008 року.
Вчений секретар
спеціалізованої вченої ради,
доктор медичних наук, професор О. М.Грабовий
Загальна характеристика роботи
Актуальність проблеми. Стрімке зростання хірургічної патології щитоподібної залози спричинене наслідками аварії на ЧАЕС [Гульчий Н. В., 1998; Комиссаренко И. В., 2006; Перцова Т. О., 2004; Романенко О. Ю., 1997]. Результатом тотальної тиреоїдектомії є маніфестний гіпотиреоз. Поширеність цієї форми захворювання в популяції коливається від 0,2 до 4% [Моргунова Т. Б., 2005; Фадеев В. В., 2004; Boilous R. W., 1998]. Цим обумовлюється потреба в дослідженні гіпотиреоїдної патології, а також проблемних питань її лікування [Фадеев В. В., 2004; Малова Н. Г., 2006; Klemperer J. D.,1996]. Дефіцит гормонів щитоподібної залози в організмі призводить до порушення водно – електролітного, білкового, ліпідного, вуглеводного обмінів, спричиняючи морфофункціональні та біохімічні зміни в різних органах і системах, зокрема в серцево – судинній системі, які виявляють у 70-80% хворих [Бойчук М. М., 2001]. Це сприяє розвиткові атеросклеротичних змін в судинах, ішемічній хворобі серця та вторинній артеріальній гіпертензії [Білявська С. Б., 2005; Зелінська Н. Б., 2002; Klein J., 2001]. Вказані захворювання, для яких гіпотиреоз є облігатним фактором ризику, призводять до формування серцевої недостатності [Джанашия П. Х., 2004; Погаева Ф. П., 2006; Ellyin F. M., 1992; Schmidt-Ott U. M., 2006].
На жаль, морфофункціональним змінам в серці за умов гіпотиреозу присвячена нечисленна література [Гурьева И. В., 1990; Павлюк В. Г., 1977]. Їх вивчення, враховуючи клінічні та лабораторні дані, стало б теоретичною основою для розуміння патогенезу серцево – судинних захворювань при гіпотиреозі, розробки адекватних методів їх діагностики, лікування та профілактики.
Відомо, що для передсердних кардіоміоцитів окрім скоротливої їх функції, характерна і ендокринна, яка полягає в синтезі та секреції передсердного натрійуретичного пептиду, якому відводять значну роль в регуляції водно – електролітного балансу, формуванню артеріальної гіпертензії, атеросклерозу судин, ремоделюванні міокарду, розвитку серцевої недостатності [Шутка Б. В., 2003; De Bold A. I., 1981; Ellis R., 1998]. Порівняльний аналіз морфофункціональних змін в міокарді правого передсердя, із вираженою ендокринною функцією, та лівого шлуночка, який зазнає найбільшого механічного навантаження, дозволить виявити основні закономірності формування гіпотиреоїдної міокардіопатії, оцінити стан ендокринного та скоротливого апаратів серця за умови післяопераційного гіпотиреозу.
Не зважаючи на активне розроблення клініцистами різних схем симптоматичної терапії міокардіопатій, більшу цікавість викликають етіопатогенетичні способи корекції гіпотиреоїдного стану [Малова Н. Г., 2007; Федоров С. В., 2006], а відповідно – профілактики та лікування захворювань міокарду при післяопераційному гіпотиреозі.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконана в рамках держбюджетної теми Інституту проблем патології НМУ імені О. О. Богомольця „ Морфо-функціональний стан органів найбільш чутливих до дефіциту гормонів щитовидної залози за умов гіпотиреозу та його корекції”, номер державної реєстрації 0106U004081.
Метою даної роботи було вивчити морфофункціональні зміни в міокарді правого передсердя та лівого шлуночка в динаміці експериментального післяопераційного гіпотиреозу та за умови його корекції.
Задачі дослідження:
1. Розробити адекватну модель післяопераційного гіпотиреозу на щурах.
2. Вивчити морфофункціональні особливості міокарда щурів в динаміці післяопераційного гіпотиреозу.
3. Вивчити морфофункціональні особливості міокарда тиреоїдектомованих щурів після гормонзамісної терапії L–тироксином.
4. Вивчити морфофункціональні особливості міокарда тиреоїдектомованих щурів після комбінованої гормонзамісної терапії L–тироксином та кальцитоніном.
5. Вивчити морфофункціональні особливості міокарда тиреоїдектомованих щурів після трансплантації фетальних щитоподібних залоз.
6. Дати морфофункціональну оцінку стану ендокринного апарату серця у щурів при гіпотиреозі та при різних способах його корекції.
Об’єкт дослідження - морфофункціональні зміни в структурних компонентах міокарда правого передсердя та лівого шлуночка щурів в динаміці експериментального післяопераційного гіпотиреозу та при його корекції.
Предмет дослідження - фрагменти міокарда правого передсердя та лівого шлуночка тиреоїдектомованих щурів через 14, 35, 50, 100 діб після тиреоїдектомії та після корекції гіпотиреозу.
Методи дослідження – фізіологічні (електрокардіографія, визначення осмотичної резистентності еритроцитів), біохімічні (визначення концентрації вільного тироксину, загального та зв’язаного кальцію плазми крові; жирнокислотного спектру ліпідів міокарду, стану системи перекисного окислення ліпідів), морфологічні (світлооптичний та електронномікроскопічний).
Наукова новизна одержаних результатів. Вперше проведене комплексне морфофункціональне порівняльне дослідження біохімічних, фізіологічних, структурних, ультраструктурних змін кардіоміоцитів міокарда правого передсердя та лівого шлуночка щурів в динаміці формування післяопераційного гіпотиреозу на розробленій автором моделі, яка підтверджена патентом. Вперше виявлені морфологічні аспекти формування гіпотиреоїдної міокардіопатії та критерії недостатності монотерапії L-тироксином. Вперше викладені теоретичні основи доцільності застосування кальцитоніну в комплексній замісній гормонотерапії післяопераційного гіпотиреозу. Встановлено, що найбільш ефективним способом корекції міокардіопатії тиреоїдектомованих щурів з етіопатогенетичної точки зору є хірургічний метод пересадки фетальної щитоподібної залози, який має і свої недоліки.
Практичне значення одержаних результатів. Результати проведених досліджень сприяють поліпшенню діагностики та прогнозування перебігу гіпотиреоїдної міокардіопатії, за рахунок комплексного аналізу функціональних (ЕКГ, осмотична резистентність еритроцитів, жирнокислотний склад ліпідів міокарду, показників перекисного окислення ліпідів) та морфологічних даних. Узагальнення, що випливають з результатів дослідження дозволяють стверджувати, що у випадку післяопераційного гіпотиреозу доцільною є гормонозамісна терапія, яка компенсує не лише недостатність йодвмісних гормонів, а й кальцитоніну. Отримані дані можуть використовуватися в педагогічному процесі на кафедрах гістології та ембріології; патологічної анатомії, ендокринології, кардіології, при написані монографій, посібників, підручників, а також при розробленні ефективних схем лікування та профілактики гіпотиреоїдної міокардіопатії практикуючими лікарями.
Особистий внесок здобувача. Дисертаційна робота є закінченою науково-дослідною роботою. Автором самостійно виконані аналіз літератури, постановка досліджень, одержання первинного матеріалу, проведення морфологічних, фізіологічних та біохімічних досліджень, опис результатів дослідження, морфометрія, статистична обробка даних, а також їх узагальнення. Розроблена модель гіпотиреозу на щурах, метод вивчення порушення ліпідного обміну при гіпотиреозі, які підтверджені патентами. Усі розділи дисертаційної роботи написані автором самостійно.
Апробація і впровадження. Основні положення дисертації були представлені на: науковій конференції “Актуальні проблеми експериментальної медицини” (Київ, 2003р.); науковій конференції “Использование электронной микроскопии в ХХІ веке” (Москва, 2003р.); VI научно-практической конференции с международным участием «Санкт- Петербургские научные чтения» (Санкт-Петербург, 2004р.); 16-th European students’ conference (Berlin, Germany, 2005); 14-th annual international Ain Shams Medical students’ Congress (Cairo, Egypt, 2006); науково-практичній конференції «Досвід і проблеми застосування сучасних морфологічних методів досліджень органів і тканин у нормі та при діагностиці патологічних процесів» (Тернопіль, 2007р.).
Публікації. За матеріалами дисертації опубліковано 19 наукових праць, з них 8 журнальних статей у фахових виданнях, рекомендованих ВАК України, 9 тез доповідей на наукових конгресах та конференціях, серед яких 5 – в міжнародних виданнях. Отримано 2 патенти України на корисну модель.
Об’єм та структура роботи. Матеріали дисертації викладені на 276 сторінках машинописного тексту, текстова частина займає 152 сторінки. Дисертація складається з вступу, огляду літератури, розділу „Матеріали та методи досліджень”, п’яти розділів власних досліджень, аналізу і узагальнення результатів досліджень, висновків та списку використаних джерел. Список цитованої літератури містить 338 джерел, серед яких 168 – опубліковані кирилицею та 170 – латиницею. Дисертація ілюстрована 93 рисунками та 17 таблицями.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал і методи дослідження. Об’єктом дослідження стали серця від 212 статево-зрілих безпородних щурів–самиць, яким у віці 3-4 місяці хірургічно моделювали стан гіпотиреозу. Вивчали чотири групи тварин, відповідно до поставлених завдань.
I група - віварійний контроль (неоперовані щури, 15 тварин);
II група - тварини, яким моделювали стан гіпотиреозу (70 тварин);
III група - тиреоїдектомовані щури, які отримували гормонзамісну терапію L-тироксином («Фармак», Україна) в дозі 10мкг/кг маси тварини (64 тварини);
IV група - прооперовані тварини, які отримували комбіноване лікування L-тироксином («Фармак», Україна) у дозі 10мкг/кг per os та кальцитоніном (препарат «міакальцик», «Novartis», Швейцарія) у дозі 1,0 МО/кг (58 тварин);
V група – щури, яким після видалення щитовидної залози була проведена трансплантація фетальної щитоподібної залози (5 тварин).
Утримання, догляд за тваринами, маркування і всі маніпуляції проводили відповідно до положень «Європейської конвенції про захист хребетних тварин, які використовуються для експериментальних та наукових цілей» (Страсбург, 1985). Комісією з біоетики Національного медичного університету імені О. О. Богомольця встановлена відповідність проведених наукових досліджень етичним вимогами згідно наказу МОЗ України №231 від 01.11.2000 року.
Гіпотиреоз моделювали хірургічно розробленим методом, підтвердженим патентом.
Біоелектричну активність міокарда піддослідних щурів вивчали за електрокардіограмами у II стандартному відведенні з реєстрацією кривих на Мінгографі-34 («Siemens-Elema», Швеція).
Проникність еритроцитарних мембран вивчали за допомогою показника мембранних процесів – осмотичної резистентності еритроцитів (ОРЕ). ОРЕ визначали за методом Дейсі [Гиріна О. М., 2004], принцип якого полягає в зміні ступеня гемолізу еритроцитів (у відсотках) в серії забуферених гіпотонічних розчинів натрію хлориду (в розведеннях від 0,5% до 0,1%, рН 7,4).
Для контролю ефективності гіпотиреозу, у дослідних тварин досліджували вміст тироксину в сироватці крові імуноферментним методом. Вміст рівня іонізованого та загального кальцію в сироватці крові визначали титруванням.
Процеси перекисного окислення ліпідів оцінювали за рівнем вторинних продуктів ліпопероксидації (малонового діальдегіду) у гомогенатах міокарда, які визначали спектрофотометричним методом при спонтанній неіндукованій ліпопероксидації та індукованому ферментативно-залежному ліпопереокисленні з використанням в ролі прооксиданта систему НАДФН+ та сульфат заліза (ІІ).
Вивчення жирнокислотного складу ліпідів міокарду у експериментальних щурів проведено методом газорідинної хроматографії на базі лабораторії газової хроматографії Інституту проблем патології. Міокард експериментальних тварин гомогенізували у фізіологічному розчині, підготовку біологічного матеріалу ліпідів тканин серця експериментальних та контрольних щурів і газохроматографічний аналіз проводили за існуючою методикою [Трофімова Т. С. із співавт., 2005]. За даним методом отримано патент.
Матеріалом для електронномікроскопічного дослідження були ділянки міокарду правих передсердь та лівих шлуночків щурів. Фрагменти міокарду фіксували в 2,5% розчині глютарового альдегіду на какодилатному буфері з дофіксацією в 1% розчині осмієвої кислоти. Зневоднювали у спиртах 70%, 80%, 90%, 100% концентрації та ацетоні. Заливали в суміш епон – аралдит, згідно загальноприйнятій методиці [Карупу В. Я., 1984]. Напівтонкі та ультратонкі зрізи з блоків отримували на ультратомах LKB III (Швеція) та Reihart (Швеція). Напівтонкі зрізи забарвлювали метиленовим синім та за Hayat [Hayat М., 1986] і досліджували за допомогою фотооптичної системи „Olympus”. Ультратонкі зрізи контрастували насиченим розчином 2% уранілацетату та цитрату свинцю. Препарати досліджували під електронними мікроскопами ЕМ-100 та ПЕМ – 125К.
Для морфометричних досліджень використовували програму «Органела», розроблену на базі лабораторії електронної мікроскопії Інституту проблем патології. В передсердних кардіоміоцитах підраховували співвідношення різних типів гранул [Коростишевская И. М., 1989]. І тип представляє собою популяцію гранул, що формуються. ІІ тип гранул представляє зрілі форми органел, які депоновані в передсердних кардіоміоцитах. ІІІ тип гранул складається з органел, вміст яких виводиться з клітини. Різні типи гранул підраховували на негативах, отриманих при однаковому збільшенні, які містили фрагменти передсердних кардіоміоцитів, зріз яких пройшов через центр клітини.
В кардіоміоцитах лівого шлуночка визначали об’ємну і числову щільність мітохондрій, середню площу мітохондрій, фактор форми мітохондрій, об’ємну щільність міофібрил та співвідношення об’ємних щільностей мітохондрій і міофібрил, згідно принципам стереометричного аналізу [Автанділов Г. Г., 2007].
Трансплантацію фетальної щитоподібної залози експериментальним тваринам здійснювали в день тиреоїдектомії. Донорський матеріал брали від плодів щурів на 9-10 добу гестації. Трансплантували заготовлені фетальні щитоподібні залози в дуплікатору очеревини здухвинної кишки.
Статистична обробка здійснювалась методами варіаційноі статистики, за допомогою програмного забезпечення Statistica for Windiws 6.0 (Microsoft Corporation, USA). Обраховувались дані морфометричного та біохімічних досліджень. По кожному з показників обчислювалося середнє значення та стандартна похибка для кожної з піддослідних тварин. Вірогідність отриманих даних оцінювали за параметричними і непараметричними критеріями достовірності.
Результати досліджень та їх обговорення. Морфофункціональний стан міокарду щурів в динаміці експериментального гіпотиреозу. В результаті тиреоїдектомії у щурів формується стан стійкого гіпотиреозу, про що свідчить достовірне зниження концентрації вільного тироксину плазми крові більше, ніж вдвічі, порівняно з контролем (рис. 1). Встановлене зниження концентрації загального кальцію в плазмі крові впродовж всіх 100 діб дослідження, проте, рівень іонізованого кальцію в крові залишався в межах норми, визначеної для інтактних тварин, що свідчить про відсутність гіпопаратиреозу у досліджуваних тварин [Федоров С. В., 2006; Jacobs D., 2004].
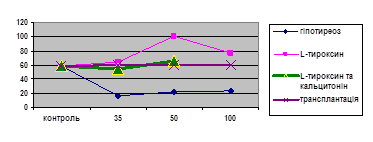
Рис. 1. Графік змін концентрації вільного тироксину в плазмі крові в динаміці експерименту. По осі абсцис – терміни досліджень та контрольне значення, по осі ординат – концентрація вільного тироксину в плазмі крові (нмоль/л).
Аналіз отриманих результатів комплексного дослідження функціонального стану та структури міокарду дозволив виявити стадійність формування патоморфологічних змін в ньому. Ці зміни мали однаковий характер та спрямованість як в міокарді правого передсердя, так і лівого шлуночка, проте їх виразність була більшою в міокарді правого передсердя. За характером виявлені процеси в міокарді можна розділити на три основні стадії: реактивних змін, компенсаторно-пристосувальних процесів та декомпенсації.
Реактивні зміни в міокарді набувають свого розвитку в ранньому післяопераційному періоді (через 14 та 35 діб після операції). Вже на цій стадії активувались процеси як спонтанного, так і НАДФН+-індукованого механізмів перекисного окислення ліпідів (концентрація малонового діальдегіду в гомогенаті міокарда в першому випадку виросла на 116%, а у другому – на 56%). Тобто, реактивні зміни в міокарді характеризувались активацією переважно процесів спонтанного утворення вільних радикалів. Ці дані узгоджуються даними інших авторів [Ланкин В. З., 2000; Реброва Т. Ю., 2007; Сомова О. В., 1999; Ткаченко О. Р., 1994]. Ймовірною причиною ланцюгової активації вільнорадикального окислення ліпідів є розмежування окисно-відновних процесів в мітохондріях.
Одними з перших в процес перекисного окислення ліпідів включаються поліненасичені жирні кислоти за рахунок наявності в них нестійких зв’язків [Савицький И. В., 1982]. Отримані нами результати визначення жирнокислотного спектру ліпідів міокарда дають право вважати, що для періоду реактивних змін характерним є перекисне окислення саме поліненасичених жирних кислот, вміст яких зменшився на 10%. Поліненасичені жирні кислоти в структурі фосфоліпідів беруть участь у формуванні мембран клітин. Причому, чим більший вміст цих жирних кислот в мембрані, тим нижче її в’язкість та тим вищою є активність рецепторних, транспортних та сигнальних систем [Галявич А. С., 2006]. Зниження вмісту поліненасичених жирних кислот в мембранах організму сприяє підвищенню їх проникності та зменшенню міцності. Ми спостерігали це на прикладі мембран еритроцитів тиреоїдектомованих щурів. Виявилось, що через 14 діб рівень нестійких форм еритроцитів в 0,45% NaCl підвищилась на 95,8% порівняно з контролем.
Описані біохімічні та патофізіологічні процеси мали своє морфологічне відображення в міокарді. В патологічний процес включаються обмінні мікросудини, компоненти інтерстиційного простору та самі кардіоміоцити. Виявлений гетеротипізм змінених кардіоміоцитів відображає грубі механізми їх селекції в умовах різкого дефіциту гормонів щитоподібної залози. Найбільш чутливими до дії патогенного чинника виявляються найбільш активні з функціональної точки зору клітини [Непомнящих Л. М., 1981; Твердохліб І. В., 1996].
Характерною ознакою реактивних процесів в міокарді через 14 діб була поява ділянок апоптозно змінених клітин, які втрачають контакти з сусідніми кардіоміоцитами, мають пікноморфні ядра, ущільнену цитоплазму з деструктурованими міофібрилами, розширеними канальцями саркоплазматичної сітки, які не утворюють тріади, активними мітохондріями з дещо ущільненими кристами. Окрім кардіоміоцитів, спостерігались апоптозно змінені ендотеліоцити.
Вважають, що специфічним для кардіоміоцитів є мітохондріальний шлях запуску апоптозу [Cook S. A., 1999; Стеченко Л. А., 2006]. Разом з тим, не можна заперечувати і участь цитоплазматичних кальцієвих механізмів. Очевидно, вони доповнюють висунуту концепцію кальцієвих пошкоджень кардіоміоцитів [Меерсон Ф. З., 1980; Ейлер В. Г., 1990; Kranias E. G., 2007]. Цілком можлива комбінація цих двох механізмів.
Іншою важливою ознакою реактивних процесів в міокарді як через 14, так і через 35 діб була поява значної кількості „світлих” кардіоміоцитів, із вираженими набряковими процесами в саркоплазмі, розвитком альтеративних змін з боку скоротливого та енергетичного апаратів та недостатністю репаративних процесів. Набряк саркоплазми, очевидно, пов’язаний із порушенням функції транспортних білків в складі сарколеми та виявленим зниженням вмісту поліненасичених жирних кислот в структурі фосфоліпідів мембран. Він відображає описане нами підвищення проникності клітинних мембран за умови гіпотиреозу. Згідно даних літератури, тиреоїдині гормони індукують синтез Na/K-АТФази, білків іонних каналів в кардіоміоцитах, що за умови гіпотиреозу спричиняє підвищену її проникність для іонів Na+, яка стає причиною набрякових процесів в кардіоміоцитах [Сыч Ю. П., 2003; Dillman W. H., 1990; Kahaly G. R., 2005].
Реактивні процеси в цей період встановлені і в більшості капілярів, де вони проявлялись активацією мікровезикулярного транспорту та білоксинтетичних процесів, появою мікроклазматозних виростів, які збільшують площу дифузійної поверхні. В цій стадії до 35 доби наростали ознаки порушення гемомікроциркуляції із формуванням мікрогеморагій, сладжу еритроцитів. Такі зміни структур гістогематичного бар’єру посилюють дистрофічні зміни в міокарді.
Перші ознаки включення компенсаторно-пристосувальних процесів в міокарді спостерігаються вже через 35 діб після тиреоїдектомії, проте на цьому етапі вони існують разом із реактивними, а часто і деструктивними процесами, що свідчить про їх невисоку ефективність. Найбільш вираженими процеси адаптації стають через 50 діб після операції. Причому, виразність цих процесів була більшою в міокарді правого передсердя, в той час як в міокарді лівого шлуночка поряд з компенсаторно-пристосувальними, все ще спостерігались і деструктивні ознаки. В цей час відбувається посилення активності НАДФН+-залежного шляху перекисного окислення ліпідів (концентрація малонового діальдегіду становила (125,5 ± 3,4) ммоль/г при (54+6,9) – у контролі). Це опосередковано свідчить про збільшення вмісту в кардіоміоцитах відновленої форми НАДФ, а отже і про посилення її утворення в дихальному ланцюгу мітохондрій [Афонина Г. Б., 2000]. Разом з тим, в структурі ліпідів міокарда підвищується вміст поліненасичених жирних кислот, що збільшує стійкість мембран кардіоміоцитів та сприятливо впливає на процеси трансмембранного транспорту і рецепції. З іншого боку, на 9,23% зменшився вміст насичених жирних кислот в складі ліпідів міокарда. Причиною таких змін може бути посилене їх використання для процесів окислення в мітохондріях кардіоміоцитів, де вони є основним джерелом АТФ [Хехт А., 1975; Галявич А. С., 2006]. Варто зазначити, що показник осмотичної резистентності еритроцитів в цій стадії залишається низьким.
В ендотелії капілярів виявлені ознаки помірної активності як транспортних, так і біосинтетичних процесів. Це сприяє відновленню мікроциркуляції в них, оптимізації обмінних процесів, що разом із зменшенням ітерстиційного набряку покращує трофіку кардіоміоцитів, без чого неможливим є становлення компенсаторних механізмів в них.
В кардіоміоцитах найбільш вираженими виявились компенсаторні реакції білоксинтетичного апарату. Вони були типовими для міокарда [Меерсон Ф. З., 1980; Непомнящих Л. М., 1991; Пауков В. С., 1982] та полягали в гіпертрофії ядер, збільшенні кількості вільних рибосом, полісом та зв’язаних з мембранами гранулярної ендоплазматичної сітки форм. Показник об’ємної щільності міофібрил не змінився, проте їх якісні характеристики відображали активні репаративні процеси. Ознакою останніх є наявність довгих ланцюжків полісом, на яких синтезуються актинові та міозинові міофіламенти. Проте, як відомо, за умови гіпотиреозу переважно синтезуються в-ізоформа важкого ланцюга міозину, потужність та швидкість скорочення для якої нижча, порівняно з б-ізоформою [Morkin Е., 1993; Ojamaa K., 1996; Ladenson P. W., 1992]. Компенсаторно-пристосувальні процеси мітохондрій полягали переважно у вираженій їх гіперплазії, внаслідок якої утворювались молоді форми органел (рис. 2). А в міокарді правого передсердя, спостерігалась і гіпертрофія окремих мітохондрій. Разом з тим, їх ультраструктури відновлюються лише частково. На цьому етапі відбувається компенсація енергетичного дефіциту в кардіоміоцитах як за рахунок мітохондріальних механізмів, так і за рахунок активізації процесів гліколізу. Це узгоджується з даними гістохімічних досліджень в динаміці гіпотиреозу [Павлюк В. Г., 1977; Колесова Н. А., 2007]. Клітини, які не змогли переключитись на гліколітичний шлях отримання енергії, зазнають загибелі. Про це свідчить наявність значної кількості гранул глікогену в поодиноких змінених за „темним” типом кардіоміоцитах. В кардіоміоцитах все більше виникає ознак порушення інтрацелюлярного обміну кальцію, що відображено в особливостях будови саркоплазматичної сітки, накопиченні електронно-щільних депозитів в матриксі мітохондрій, контрактурних змінах міофібрил.
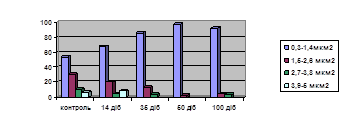
Рис. 2. Розподіл мітохондрій в кардіоміоцитах лівого шлуночка міокарду інтактних щурів та в динаміці експериментального гіпотиреозу. По осі абсцис - групи досліджень, по осі ординат – кількість досліджених об’єктів в %.
Ймовірно, ця стадія розвитку міокардіопатії є ще оборотною та сприятлива для будь-якої медикаментозної корекції (етіопатогенетичного лікування гіпотиреозу або симптоматичної терапії проявів міокардіопатії). Після неї формується стадія декомпенсації міокарда з ознаками розвитку хронічної серцевої недостатності, які є необоротними. В нашому дослідженні ці зміни спостерігались через 100 діб після тиреоїдектомії. Вони супроводжувались зниженням активності НАДФН+-індукованого перекисного окислення ліпідів. Це опосередковано вказує на вторинне порушення окисно-відновних процесів в мітохондріях. Активність спонтанного утворення продуктів перекисного окислення ліпідів все ще залишалась стабільно високою і становила (56,0 ± 10,0) ммоль/г при контрольному значенні - (26+4,2) ммоль/г. З ними, очевидно, пов’язані зміни в жирнокислотному спектрі ліпідів міокарду. На фоні відновлення співвідношення насичених і ненасичених жирних кислот, в структурі останніх зменшується вміст поліненасичених жирних кислот, які, як відомо, першими включаються в процес перекисного окислення. Як наслідок - знову, вторинно, порушуються проникність, трансдукція та ригідність мембран кардіоміоцитів. Подібне співвідношення жирних кислот в структурі ліпідів крові спостерігали і при інших хронічних захворюваннях міокарду у людини [Алимова Е. К., 1970; Pirro М., 2002]. Структурна перебудова клітинних мембран сприяє зменшенню її міцності та проникності, що корелює із зниженням осмотичної резистентності еритроцитів більше, ніж на 200%.
Зрив адаптаційних процесів проявився посиленням деструктивних змін в першу чергу з боку скоротливого та енергетичного апаратів на фоні вираженої недостатності репаративних процесів, що проявляється утворенням глибоких інвагінацій каріолеми з формуванням сегментованих ядер; розширенням перинуклеарного простору, зменшенням вмісту вільних рибосом, полісом та канальців гранулярної ендоплазматичної сітки. Наслідком гіпопластичних та активації деструктивних процесів в міокарді є зменшення вмісту міофібрил, структурна цілісність яких в різній мірі порушена, гетерогенність змін в мітохондріях.
Ми спостерігали початкові етапи апоптозу у вигляді перескорочених і «темних» клітин, проте нам не вдалось виявити кардіоміоцити на термінальних стадіях процесу. Можливо, цей процес не завершувався і високий внутрішній антиапоптичний потенціал дозволяв тривалий час підтримувати життєдіяльність кардіоміоцитів у вигляді їх гібернації, що часто спостерігається при різних захворюваннях міокарда [Brown Т. А., 2001; Schulz R., 2000 ]. За умови енергетичного дефіциту в клітині, на початкових стадіях процес апоптозу міг завершуватись розвитком некротичних змін в кардіоміоцитах, які мали місце в цей період дослідження.
Очевидними були механізми порушення внутрішньоклітинного обміну кальцію, які прогресували в динаміці експерименту. Вони проявились колапсом канальців саркоплазматичної сітки, відкладанням електронно щільних депозитів в мітохондріях та ділянками перескорочення міофібрил.
З розвитком декомпенсації поновлюється активація колагеноутворення фібробластами, що спостерігалось на етапі реактивних змін; відбувається синтез значної кількості еластичних волокон, які відкладаються як периваскулярно, так і в інтерстиційному просторі; організація сполучною тканиною ділянок мікрогеморагій в міокард. Таким чином, через 100 діб після тиреоїдектомії формуються ознаки дифузного дрібновогнищевого склерозу та фіброзу [Гавриш А. С., 2007].
Стадія декомпенсації міокарда при гіпотиреозі характеризується класичними електрокардіографічними ознаками – синусовою брадикардією, подовженням інтервалу РQ та зниженням амплітуди всіх зубців на електрокардіограмі [Левина Л. И., 1989]. Ці дані відображають зниження біоелектричної активності провідної системи серця та розвиток дисметаболічних процесів в ньому. Виявлені нами зміни свідчать про етапність розвитку гіпотиреоїдної міокардіопатії, результатом якої є розвиток хронічної серцево-судинної недостатності.
Морфофункціональний аналіз стану міокарда щурів при корекції гіпотиреозу L-тироксином. Ґрунтуючись на отриманих даних щодо концентрації вільного тироксину в плазмі крові, можна стверджувати про адекватність підібраної нами дози L-тироксину (10 мкг/кг), оскільки у щурів мав місце стан еутиреозу, хоча і спостерігалась індивідуальна різниця концентрації вільного тироксину, яку можна пов’язати з особливостями фармакокінетики препарату (рис. 1). Звертає на себе увагу не лише статистично достовірне зниження рівня загального кальцію в плазмі крові тварин, яке також характерне для нелікованого гіпотиреозу, а і іонізованої його форми.
Проведені нами в комплексі морфологічні, біохімічні та фізіологічні дослідження дають право стверджувати про те, що лікування післяопераційного гіпотиреозу L-тироксином не запобігає розвитку гіпотиреоїдної міокардіопатії як в міокарді правого передсердя, так і лівого шлуночка. Проте, воно здатне відстрочити її формування в часі. Так, виявлені нами біохімічні, фізіологічні та морфологічні ознаки реактивних процесів в міокарді нелікованих тварин через 14 діб після тиреоїдектомії, найбільш виразно проявлялись лише через 35 діб в групі лікованих L-тироксином тиреоїдектомованих щурів. Компенсаторно-пристосувальні процеси зазнавали свого становлення через 50 діб і були добре виражені як в міокарді правого передсердя, так і лівого шлуночка. Перші ознаки декомпенсації з’являлись через 100 діб, проте вони були менш виражені, ніж у відповідний термін без лікування, тобто цей процес затримується в часі.
Разом із загальними ознаками гіпотиреоїдної міокардіопатії, на яких ми ґрунтувались для встановлення стадії процесу, в міокарді лікованих тироксином щурів виникають специфічні зміни, пов’язані з впливом екзогенного L-тироксину. В першу чергу це стосується міокарду правого передсердя. Цікаво, що в передсердних кардіоміоцитах тиреоїдектомованих щурів під впливом L-тироксину відбувалось утворення типових тріад, не характерних для цього відділу серця. Така перебудова передсердних кардіоміоцитів, очевидно, пов’язана з гіпертрофією міокарду передсердя та наростанням в передсердних кардіоміоцитах скоротливої їх функції. Ознаки гіпертрофії міокарда правого передсердя встановлені електрокардіографічно, що супроводжується формуванням вираженого р-«pulmonale». Утворення тріад можна розглядати як компенсаторну реакцію клітини на надлишок іонів кальцію в саркоплазмі. На користь участі кальцієвих механізмів пошкодження кардіоміоцитів свідчать електроннощільні депозити в матрикс мітохондрій, ущільнення кортикального шару саркоплазми та наявність численних перескорочених та «темних» клітин.
Виявлені нами розходження та набряк вставних дисків свідчать про порушення провідності між кардіоміоцитами. Вони з’являються в експерименті в стадії декомпенсації та, очевидно, посилюють прояви серцевої недостатності.
Іншою особливістю впливу L-тироксину на міокард тиреоїдектомованих щурів є активація всіх білоксинтетичних процесів як в кардіоміоцитах, так і в ендотеліоцитах та клітинах сполучної тканини. Якщо в кардіоміоцитах та ендотеліоцитах активація білкового синтезу посилює репараційні та обмінні процеси, відстрочуючи тим самим розвиток хронічної серцевої недостатності, то посилення колагеноутворення фібробластами, навпаки, сприяє формуванню вираженого міокардіофіброза, за рахунок якого відбувається порушення проникності гістогематичного бар’єру міокарда під час зриву адаптаційних процесів, що сприяє формуванню вторинних дистрофічних змін в ньому.
Характеристика міокарду при комбінованій корекції гіпотиреозу L-тироксином та кальцитоніном та після трансплантації фетальних щитоподібних залоз. Виявлена нами недостатність монотерапії гіпотиреоїдної міокардіопатії L-тироксином може бути обумовлена дефіцитом іншого гормону щитовидної залози – кальцитоніном. Відомо, що вміст цього гормону знижується у людей з післяопераційним гіпотиреозом [Schneider Р., 1991; Kouneva-Skerleva V. H., 2006]. Використання кальцитоніну при комбінованому з тироксином лікуванні забезпечує більшу збереженість структур міокарда, ніж при застосуванні єдиного L-тироксину. Це супроводжується адекватним заміщенням тироксину в плазмі крові (рис. 1), а також відновленням рівнів загального та іонізованого кальцію крові до контрольних значень. Складний каскад вторинних посередників, що запускаються рецепторно-гормональною взаємодією чинить значну кількість ефектів, регулюючи проникність іонних каналів в кардіоміоцитах, процеси диференціювання та клітинної загибелі [Findlay D. M., 2002; Sueur S., 2005]. Можливо саме з антиапоптичним ефектом цього гормону пов’язане те, що вміст «темних» та контрактурно-змінених кардіоміоцитів при його застосуванні на пізніх термінах післяопераційного гіпотиреозу був незначним, а через 100 діб взагалі не виявлялись перескорочені кардіоміоцити.
Оскільки відомо, що кальцитонін регулює проникність мембран кардіоміоцитів для кальцію, то очевидним є його вплив на регуляцію концентрації Са2+ в саркоплазмі [Bick R. J., 2005; Saini H. K., 2007]. Схоже, точкою прикладання цього гормону є мембрани канальців саркоплазматичної сітки, де він відновлює активність Са2+-АТФази та надходження іонів кальцію з саркоплазми в середину канальців. Підтвердженням такої думки може бути структурна цілісність саркоплазматичної сітки, відсутність ознак кальцієвих пошкоджень в кардіоміоцитах як правого передсердя, так і лівого шлуночка на пізніх термінах експерименту. Ми не виявили ознак міокардіофіброза при комбінованому з кальцитоніном лікуванні, які є проявом хронічної серцевої недостатності. Це можна пов’язати з позитивним впливом гормону на процеси ремоделювання в сполучній тканині.
Використання трансплантації фетальних щитоподібних залоз дало тривалий ефект лікування. При цьому через 100 діб досягався рівень еутиреозу (рис. 1), нормалізувались показники обміну кальцію в організмі, що є ознакою функціональної активності трансплантатів. Вражала збереженість ультраструктури кардіоміоцитів як в міокарді правого передсердя, так і лівого шлуночка. Проте, нами встановлені деякі особливості переважно з боку сполучної тканини міокарду. Окрім помірно вираженого інтерстиційного набряку та формування дифузного міокардіофіброзу, в периваскулярному просторі виявлені низькодиференційовані, з високим ядерно-цитоплазматичним співвідношенням, клітини, в цитоплазмі яких містились поодинокі гранули, що містили значно гіпертрофовані ядерця із переважанням фібрилярного компоненту, гігантські мітохондрії. В ендотеліоцитах спостерігались мікроядра. Такі зміни являють собою ознаки клітинного атипізму, що, в свою чергу, з часом може призвести до пухлинного переродження таких клітин [Благодаров В. М., 1997; Струков А. И., 1995]. Отримані дані ставлять перед нами питання щодо доцільності використання трансплантації фетальних щитовидних залоз з метою корекції післяопераційного гіпотиреозу, враховуючи її корисний ефект та можливий шкідливий вплив для організму.
Комплексна оцінка ендокринного апарату серця в динаміці гіпотиреозу та при його корекції. З огляду на доведену участь передсердного натрійуретичного пептиду (ПНУП) в розвитку серцевої недостатності [Поливода С. Н., 2004; Скворцов А. А., 2003; Ellis R., 1998], варто детальніше зупинитись на ендокринній функції серця. Встановлено, що в динаміці гіпотиреозу першими уражаються механізми виділення гормону з кардіоміоцитів, а його синтез порушується лише в стадії декомпенсації. Це супроводжується ознаками гіпотрофії білоксинтетичного апарату в передсердних кардіоміоцитах та характерним перерозподілом типів гранул, що відображає зниження вмісту новоутворених форм та накопичення безмембранних гранул в саркоплазмі (рис. 3). Майже вдвічі зменшується показник середньої площі всіх типів гранул. Виявлені ознаки порушення базальної секреції ПНУПу. В якості компенсаторного механізму, активується стимульована секреція недозрілих гранул, про що дає право думати їх екзоцитоз з кардіоміоцитів та поява поодиноких гранул в інтерстиційному просторі на пізніх етапах гіпотиреоза. Підвищення концентрації іонів Са2+ в саркоплазмі сприяє екзоцитозу даного пулу мембрановмісних гранул, вкритих клатрином, використовуючи G-білки [Bensimon M., 2005; Klein R. M., 1993]. Вміст частини гранул організується з фібрилярними білками та обмежовується мембранами комплексу Гольджі, переходячи в пул мембранних гранул. Частина безмембранних гранул зливається з лізосомами, ферменти яких, очевидно, беруть участь в елімінації ПНУП.
Використання з терапевтичною метою L-тироксину стимулює процеси білкового синтезу, в тому числі і ПНУПу в передсердних кардіоміоцитах, що сприяє врівноваженню вмісту різних типів передсердних гранул, проте не попереджає накопиченню безмембранних форм гранул (рис. 3). Кальцитонін (екзогенний або той, що походить з трансплантованих фетальних щитоподібних залоз), відновлюючи внутрішньоклітинний обмін іонів кальцію сприяє врівноваженню процесів синтезу, депонування, дозрівання та секреції гормону на пізніх етапах експерименту, що, очевидно, відіграє важливу роль в попередженні розвитку хронічної серцевої недостатності та артеріальної гіпертензії (рис. 3).
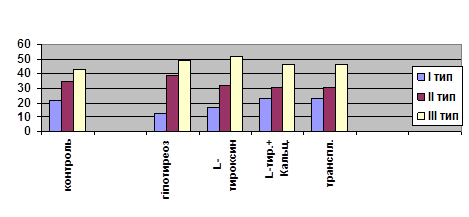
Рис. 3. Розподіл передсердних гранул в дослідних групах тварин через 100 діб після операції. По осі абсцис - групи досліджень, по осі ординат – кількість досліджених об’єктів в %.
Таким чином, отримані результати свідчать про недостатню ефективність використання монотерапії тироксином в запобіганні розвитку гіпотиреоїдної міокардіопатії. Використання комбінованого з кальцитоніном лікування дозволяє попередити маніфестні ураження міокарда, що може слугувати теоретичним підґрунтям для розроблення схем лікування післяопераційного гіпотиреозу. Максимальна збереженість кардіоміоцитів спостерігається при трансплантації фетальних щитовидних залоз, що ставить питання про доцільність подальших пошуків, враховуючи і виявлені негативні аспекти цього виду лікування.
висновки
В дисертації наведено теоретичне узагальнення та нове вирішення актуального питання морфофункціональних змін в міокарді правого передсердя та лівого шлуночка в динаміці формування післяопераційного гіпотиреозу та можливостей їх корекції.
0 комментариев