Навигация
Наукове обґрунтування методів передгравідарної підготовки перед допоміжними репродуктивними технологіями у жінок з патологією щитоподібної залози
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ ім. О.О. БОГОМОЛЬЦЯ
КАСЯНЧУК НАТАЛІЯ ЮРІЇВНА
УДК: 618.177-06:616.441-008.64:616.441-002]-07-08
НАУКОВЕ ОБҐРУНТУВАННЯ МЕТОДІВ ПЕРЕДГРАВІДАРНОЇ ПІДГОТОВКИ ПЕРЕД ДОПОМІЖНИМИ РЕПРОДУКТИВНИМИ ТЕХНОЛОГІЯМИ У ЖІНОК З ПАТОЛОГІЄЮ ЩИТОПОДІБНОЇ ЗАЛОЗИ
14.01.01 – акушерство та гінекологія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата медичних наук
Київ – 2008
Дисертацією є рукопис.
Робота виконана в Національній медичній академії післядипломної освіти ім. П.Л. Шупика МОЗ України.
Науковий керівник: доктор медичних наук, професор
Вдовиченко Юрій Петрович, Національна медична академія післядипломної освіти ім. П.Л. Шупика МОЗ України (м. Київ), завідувач кафедри акушерства, гінекології та перинатології
Офіційні опоненти: доктор медичних наук, професор
Товстановська Валентина Олександрівна, Національний медичний університет ім. О.О. Богомольця МОЗ України (м. Київ), професор кафедри акушерства та гінекології №1
доктор медичних наук, професор
Вовк Іраїда Борисівна,
Державна установа „Інститут педіатрії, акушерства і гінекології АМН України” (м. Київ), завідувач відділення планування сім’ї
Захист відбудеться 19 червня 2008 року о 13:30 годині на засіданні спеціалізованої вченої ради Д 26.003.03 при Національному медичному університеті ім. О.О. Богомольця МОЗ України (01050, м. Київ, бульв. Тараса Шевченка, 17).
З дисертацією можна ознайомитись у бібліотеці Національного медичного уні-верситету ім. О.О. Богомольця МОЗ України (01057, м. Київ, вул. Зоологічна, 3).
Автореферат розісланий 13 травня 2008 р.
Вчений секретар
спеціалізованої вченої ради
кандидат медичних наук, _________доцент Я.М. Вітовський
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Безплідність у шлюбі є однією із найбільш актуальних і вагомих проблем сучасної медицини, частота якої коливається у межах 10-18% (В.М.Запорожан, 2000; В.Б.Самойленко, 2007). За даними Всесвітньої Організації Охорони Здоров’я, 50-80 мільйонів подружніх пар у світі є безплідними, що становить 7-15% від усіх пар репродуктивного віку (ВООЗ, 2004). При цьому, в структурі причин ендокринної неплідності вагоме місце належить патології щитоподібної залози (ЩЗ) (Т.М.Тітенко, 2006; K.Poppe, 2003). Згідно даних сучасної літератури (П.М.Боднар, 2002; Т.Ф.Татарчук 2003; T.G.Strieder, 2003), серед різних варіантів тиреоїдної дисфункції у жінок репродуктивного віку провідне місце належить гіпотиреозу, а також аутоімунному тиреоїдиту як одній з найчастіших причин гіпотиреозу. Саме тому питання лікування безплідності у жінок з патологією ЩЗ набувають особливого значення.
У наш час одним із методів лікування бездітності будь-якого ґенезу є допоміжні репродуктивні технології (ДРТ) (Ф.В.Дахно, 2002; В.І.Кулаков, 2004). Та якщо результати вивчення акушерських і перинатальних особливостей після використання ДРТ досить детально викладені в наукових публікаціях (К.А.Яворовская, 2004; J.C.Barros, 2006; A.N.Andersen, 2007), то дані стосовно особливостей ДРТ у жінок з патологією ЩЗ нечисленні, неоднозначні, а іноді навіть суперечливі. Так, W.H.Kutteh (1999), M.F.Prummel (2004) та N.L.Sieiro (2004) стверджують, що збільшення рівня тиреоїдних антитіл чинить негативний вплив на процес виношування вагітності, не впливаючи на результативність ДРТ, а C.H.Kim (1998) та S.Bussen (2000) вважають їх наявність достовірним маркером погіршення репродуктивного прогнозу після ДРТ.
Актуальність дослідження зумовлена тим, що наразі продовжує збільшуватись питома вага патології ЩЗ у жінок репродуктивного віку (Т.В.Овсянникова, 2004; R.C.Smallridge, 2005), а частота невдалих спроб лікування безплідності методами ДРТ залишається достатньо високою як у загальній популяції, так і серед жінок із тиреоїдною патологією (Р.Н.Щедрина, 2001; T.G.Strieder, 2003). Таким чином, існує необхідність поглибленого вивчення стану гіпоталамо-гіпофізарно-гонадної системи у жінок, які мають патологію ЩЗ, з подальшою розробкою чіткої системи передгравідарної підготовки.
Зв¢язок роботи з науковими програмами, планами, темами. Дисертаційна робота виконана відповідно до планової наукової тематики кафедри акушерства, гінекології та перинатології НМАПО ім. П.Л. Шупика “Актуальні аспекти збереження та відновлення репродуктивного здоров’я жінки та перинатальної охорони плода на сучасному етапі” (№ державної реєстрації 0106U010506).
Мета дослідження. Підвищення ефективності лікування безплідності у жінок з патологією ЩЗ шляхом удосконалення алгоритму підготовки до ДРТ на основі встановлення взаємозв’язків між тиреоїдним гомеостазом, анатомо-функціональним станом гіпофізарно-яєчникової системи та морфофункціо-нальними особливостями ендометрію.
Задачі дослідження:
1. Визначити захворювання ЩЗ, що мають клінічне значення для лікування безплідності методами ДРТ.
2. Вивчити клінічні особливості та результативність лікувальних циклів ДРТ у жінок на тлі патології ЩЗ.
3. Дослідити особливості анатомо-функціонального стану гіпофізарно-яєчникової системи у пацієнток із тиреоїдною патологією та встановити його взаємозв’язок із показниками тиреоїдного гомеостазу.
4. З’ясувати морфофункціональні особливості ендометрію у жінок з патологією ЩЗ.
5. З’ясувати особливості перебігу ранніх термінів вагітності у пацієнток із тиреоїдною дисфункцією після застосування ДРТ.
6. Розробити комплекс лікувально-профілактичних заходів передгра-відарної підготовки у жінок із безплідністю на тлі тиреоїдної патології.
Об’єкт дослідження – репродуктивна система у жінок з патологією ЩЗ.
Предмет дослідження – особливості ДРТ та першого триместру вагітності, гіпофізарно-яєчниковий та тиреоїдний гомеостаз, структурно-функціональний стан яєчників та ендометрію.
Методи дослідження – клінічні, гормональні, інструментальні, гістологічні (аспіраційна біопсія ендометрію), імуногістохімічні, математично-статистичні.
Наукова новизна одержаних результатів. Вперше з’ясовано, що некоригований гіпотиреоз та аутоімунний тиреоїдит, навіть при еутиреозі, є клінічно значимими захворюваннями ЩЗ, що впливають на тактику ведення та ефективність лікування безплідності методами ДРТ.
Обґрунтована доцільність диференційованого підходу до вибору методів ДРТ у жінок з тиреоїдною патологією та безплідністю. Зокрема, доведена необхідність призначення мінімальних доз гонадотропінів та кломіфенцитрату з метою попередження ризику розвитку у них синдрому гіперстимуляції яєчників. Вперше доведений достовірний взаємозв’язок ступеню прогестеронової насиченості та вмісту антитіл до тиреопероксидази в сироватці крові та обґрунтована доцільність визначення цього показника для діагностики недостатності лютеїнової фази на етапі передгравідарного консультування. Вперше виявлено погіршення репродуктивного прогнозу після ДРТ у пацієнток із патологією ЩЗ при збільшенні рівня зазначених антитіл вище 1000 МО/мл.
Вперше встановлено, що аутоімунний тиреоїдит при еутиреозі у жінок репродуктивного віку супроводжується овуляторними менструальними циклами з недостатністю лютеїнової фази внаслідок недосконалого фолікулогенезу та зниження експресії рецепторів ендометрію до яєчникових стероїдів. Виявлено, що некоригований гіпотиреоз як на тлі, так і без аутоімунного тиреоїдиту, характеризується гіперпролактинемією та ознаками класичної і овуляторної форм полікістозу яєчників.
Практичне значення отриманих результатів. Розроблено та апробовано алгоритм підготовки до застосування ДРТ у жінок із тиреоїдною патологією. Запропоновано застосування прогностичних маркерів результативності програм ДРТ у жінок із патологією ЩЗ. Розроблено та апробовано методи контролю за станом реабілітації репродуктивної функції у жінок із патологією ЩЗ.
Результати досліджень впроваджено в практику роботи Київського міського клінічного ендокринологічного центру, Інституту репродуктивної медицини, акушерсько-гінекологічної клініки „Ісіда”, а також у навчальний процес кафедр акушерства, гінекології та перинатології, акушерства, гінекології та репродуктології Національної медичної академії післядипломної освіти ім. П.Л.Шупика.
Особистий внесок здобувача. Дисертантом самостійно проведений інформаційно-патентний пошук по проблемі поєднаної патології ЩЗ та репродуктивної системи. Сформульована концепція дослідження, розроблено карти обліку, за якими обстежувались пацієнтки. Автором самостійно виконані основні дослідження, у тому числі клініко-параклінічні обстеження, забір і підготовка до дослідження аспіраційних біологічних матеріалів, статистична обробка даних. Автором узагальнено, проаналізовано та викладено отримані результати, сформульовано висновки, обґрунтовано практичні рекомендації.
Апробація результатів дисертації. Основні положення дисертаційної роботи доповідались на засіданнях пленуму акушерів-гінекологів (Львів, жовтень, 2005), на засіданні асоціації акушерів-гінекологів Київської області (червень, 2004; грудень, 2005), науково-практичних конференціях „Актуальні питання репродуктивного здоров’я жінок” (Київ, 2003, 2004), міжнародній науковій конференції „Сучасні проблеми клінічної та теоретичної медицини”, присвяченій Дню науки в Україні (Суми, 2005), 66-ій науковій конференції студентів та молодих вчених із міжнародною участю „Досягнення сучасної медицини” (Львів, 2005), міжнародній школі-семінарі „Досягнення та перспективи перинатальної медицини” (Київ, 2006) та на школі-семінарі з міжнародною участю „Сучасні досягнення та перспективи ендоскопічної хірургії в гінекології” (Київ, 2006).
Публікації. За темою дисертації опубліковано 8 наукових робіт, 5 із яких – статті у наукових фахових виданнях, рекомендованих ВАК України, 1 рішення про видачу деклараційного патенту на корисну модель (заявка № u2009 03257 від 14.03.2008, рішення від 05.05.2008 №6063/1), 2 – тези у матеріалах конференцій.
Обсяг та структура дисертації. Дисертація викладена на 138 сторінках, складається з вступу, огляду літератури, клінічної характеристики обстежених жінок та методів дослідження, 5 розділів власних досліджень, аналізу та узагальнення результатів, висновків та практичних рекомендацій. Список використаної літератури налічує 148 джерел кирилицею та латиною. Робота ілюстрована 28 таблицями та 10 рисунками.
ОСНОВНИЙ ЗМІСТ
Об’єкт та методи дослідження. Першим етапом роботи було проведення ретроспективного аналізу 219 медичних карток пацієнток Інституту репродуктивної медицини, які використовували ДРТ при різних формах безплідності. З них у 99 жінок середнього віку 29,3±0,8 років, які склали основну групу (ОГ), була виявлена патологія ЩЗ: 6,1% жінок мали некоригований гіпотиреоз (підгрупа Іа), 24,2% пацієнток - гіпотиреоз на тлі аутоімунного тиреоїдиту (АІТ) (підгрупа Іб) та 69,7% жінок - з АІТ при еутиреозі (підгрупа Ів). До контрольної групи (КГ) увійшли 120 жінок середнього віку 30,0±0,8 років без тиреоїдної патології.
На другому етапі дослідження клінічному обстеженню підлягали 93 жінки віком від 18 до 43 років. До основної групи увійшли 43 жінки середнього віку 30,2±1,1 років, які знаходились на диспансерному обліку в Київському міському клінічному ендокринологічному центрі з приводу патології ЩЗ, до контрольної – 50 соматично та гінекологічно здорових жінок середнього віку 32,6±0,7 років Основна група була розділена на дві підгрупи: підгрупу ІІа склали 12 (27,9%) жінок середнього віку 30,9±2,6 років з АІТ та еутиреозом, підгрупу ІІб – 31 (72,1%) пацієнтка середнього віку 29,9±1,2 років з АІТ, що супроводжувався гіпотиреозом.
Оцінку гормонального статусу здійснювали шляхом визначення вмісту в сироватці крові гонадотропних (ФСГ, ЛГ) та тиреотропного (ТТГ) гормонів, яєчникових стероїдів – естрадіолу і прогестерону, а також пролактину двохетапним імуноферментним методом на хемілюмінесцентному аналізаторі “Access” фірми “Beckman Coulter” у фолікулярній та лютеїновій фазах менструального циклу.
Імунологічне дослідження наявності та рівня антитіл до тиреопероксидази (Ат-ТПО) в сироватці крові проводили одночасно з іншими серологічними дослідженнями методом імуноферментного аналізу з використанням високоочищеної ТПО людини на рідері “Sunrise” фірми “Tecan”, Австрія.
Для визначення анатомо-функціонального стану репродуктивної системи проводилось ультразвукове дослідження органів малого тазу в положенні на кушетці за допомогою апарату Siemens G50 (Німеччина) з інтравагінальним датчиком із частотою 5-9 МГц.
Аспіраційна біопсія ендометрію виконувалась амбулаторно без застосування анестезії за допомогою ендометріальних аспіраторів на 7-9 день після овуляції або на тлі олігоменореї після перевірки на вагітність.
Для імуногістохімічного дослідження експресії стероїдних рецепторів в отриманих аспіратах ендометрію використовувався авідин-біотин-пероксидазний метод (ER, PR; Dako). Результати імуногістохімічних реакцій оцінювали напівкількісним методом, PR та ERбули підраховані у 10 полях зору при 200-кратному збільшенні. Дані верифікувались як відсоток забарвлених клітин від всієї клітинної популяції у кожному полі зору. Інтенсивність реакції оцінювалась за чотирьохбальною шкалою: 1) ++++ >91% клітин з позитивною реакцією; 2) +++ 51-90% клітин з позитивною реакцією; 3) ++ 11-50% клітин з позитивною реакцією; 4) + <10% клітин із позитивною реакцією (Y.Yamamoto, 1992). Позитивна реакція антиген-антитіло проявлялась у вигляді коричневих забарвлених ядер на світло-блакитному фоні антитіло-негативних ділянок тканини.
Статистичну обробку і аналіз даних виконували на персональному комп’ютері Pentium-IV загальноприйнятими методами за допомогою прикладних програм Microsoft Excel 2003 та Statistica 6.0. Достовірність різниці між показниками визначали за критеріями Ст’юдента, Фішера, Уілкоксона, Уайта, Ван-дер-Вардена (А.Я.Боярський і співавт.,1985; О.П.Мінцер, 2003). Різниця між показниками вважалась достовірною при рівні похибки р<0,05. Для виявлення парціальних впливів різних чинників на результативні ознаки застосовувався багатофакторний кореляційно-регресійний аналіз (Н.Дрейпер, 1987).
Результати власних досліджень та їх обговорення. При проведенні ретроспективного аналізу 400 медичних карток пацієнток, які звернулись до клініки IVF, патологія ЩЗ була виявлена в 16,3%. До даного дослідження було включено 99 медичних карток жінок репродуктивного віку з безплідністю на тлі тиреоїдної патології. Тривалість безплідності у пацієнток основної групи становила 6,3±0,7 років, а у жінок контрольної групи цей період був достовірно триваліший – 8,6±0,8 років (р<0,05). Вірогідно, це пояснюється відсутністю будь-яких клінічних ознак порушень репродуктивного здоров’я у жінок без патології ЩЗ, що обумовлює більш пізнє їх звернення до клінік IVF.
Пацієнткам обох клінічних груп в залежності від фактора безплідності застосовувалась як стимуляція яєчників без IVF (індукція овуляції тільки гонадотропінами та/або кломіфенцитратом, моніторинг відповіді яєчників та подальше контрольоване зачаття або внутрішньоматкова інсемінація) та внутрішньоматкова інсемінація у нестимульованому оваріальному циклі, так і протоколи ДРТ (рис. 1).
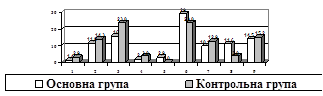
Рис. 1. Застосування різних методів лікування безплідності у жінок основної та контрольної груп (на 100 жінок відповідної групи)
1 – контрольоване зачаття; 2 – внутрішньоматкова інсемінація у природному циклі; 3 – внутрішньоматкова інсемінація при індукції овуляції; 4 – IVF у природному циклі; 5 – IVF при індукції овуляції; 6 – IVF/ICSI довгий протокол; 7 – IVF/ICSI короткий протокол; 8 – IVF\ICSI протокол з ант-ГнРГ; 9 – ембріотрансфер кріовідтанутих ембріонів.
Аналіз проведених циклів лікування безплідності в різних підгрупах основної групи показав, що у жінок з гіпотиреозом, як некоригованим, так і на тлі аутоімунного тиреоїдиту, не використовувався природний оваріальний цикл у програмах внутрішньоматкової інсемінації та IVF/ICSI внаслідок відсутності спонтанного фолікулогенезу.
При індукції овуляції в циклах внутрішньоматкової інсемінації у 6 жінок з гіпотиреозом на тлі АІТ під час ехофолікулометрії було виявлено мультифолікулярний відгук при прийомі кломіфенцитрату у дозі 50 мг на добу. Це зумовило необхідність виконання УЗ-пункції фолікулів з переходом на програму IVF у зв’язку з ризиком багатоплідної вагітності у разі одночасної овуляції всіх фолікулів.
При порівнянні середньокурсової кількості ампул гонадотропінів при різних протоколах контрольованої стимуляції суперовуляції у жінок основної та контрольної груп ми не встановили статистично достовірних відмінностей у значеннях цього показника (довгий протокол з а-ГнРГ: 30,2±1,5 в ОГ порівняно з 32,0±1,5 в КГ, p>0,05; короткий протокол з а-ГнРГ: 28,0±2,9 в ОГ порівняно з 28,2±1,8 в КГ, p>0,05; протокол з ант-ГнРГ: 26,6±1,9 в ОГ порівняно з 26,6±1,8 в КГ, p>0,05).
Середня кількість ооцитів (11,1±1,3 в ОГ порівняно з 12,2±1,3 в КГ, p>0,05), відсоток дегенерованих яйцеклітин (12,7±2,9% в ОГ порівняно з 17,2±2,7% в КГ, p>0,05), запліднених ооцитів (63,2±5,3% в ОГ порівняно з 59,8±3,7% в КГ, p>0,05) та клітин на стадії двох пронуклеосів (84,3±5,2% в ОГ порівняно з 72,3±3,1% в КГ, p>0,05) у жінок з тиреоїдною патологією достовірно не відрізнялись від відповідних ембріологічних показників пацієнток контрольної групи.
Частота настання біохімічної вагітності у відношенні до проведених ембріотрансферів (табл. 1) у пацієнток основної групи статистично не відрізнялась від відповідного показника у жінок контрольної групи (45,5% порівняно з 42,5%; p>0,05), проте частота клінічної вагітності у пацієнток без патології ЩЗ майже удвічі перевищувала таку у жінок із тиреоїдною патологією (29,2% порівняно з 15,1%; р<0,05).
Таблиця 1
Особливості перебігу вагітності у обстежених жінок в першому триместрі (n та Р±m)
| Показники | Основна група | Контрольна група | |
| Біохімічна вагітність (%) | 45 (45,5±5,0) | 51 (42,5±4,5) | |
| Клінічна вагітність (%) | 15 (15,1±3,6)* | 35 (29,2±4,2) | |
| Ускладнення вагітності | загроза переривання (%) | 6 (40,0±12,7) | 6 (17,1±6,4) |
| мимовільна редукція одного плоду з двійні (%) | 2 (13,3±8,8) | 2 (5,7±3,9) | |
| мимовільний аборт (%) | 2 (13,3±8,8) | 2 (5,7±3,9) | |
| Всього ускладнень (%) | 10(66,7±12,2)* | 10 (28,6±7,6) | |
| Прогресуюча вагітність (%) | 13 (13,1±3,4)* | 33 (27,5±4,1) | |
Примітка: * – різниця достовірна відносно відповідного показника КГ (р<0,05).
З метою вивчення впливу сироваткової концентрації Ат-ТПО на результативність лікування безплідності методами ДРТ ми дослідили наявність, напрямок та силу кореляційного зв’язку між зростанням їх рівня та ефективністю ДРТ. В результаті з’ясувалось, що за умови високих концентрацій Ат-ТПО (вище 1000 МО/мл) погіршувався репродуктивний прогноз: між зазначеними двома показниками встановлено статистично значимий зворотний кореляційний зв’язок середньої сили впливу (r=0,511±0,113; р<0,01).
В групі жінок із тиреоїдною патологією, які завагітніли в результаті ДРТ, спостерігався більш високий рівень ускладнень першого триместру вагітності, ніж у пацієнток без патології ЩЗ (66,7% та 28,6% відповідно; р<0,05). В таблиці 1 наведені варіанти ускладнень, а також частота прогресування вагітності у жінок основної та контрольної груп.
Наступний етап дослідження мав за мету з’ясувати причини зменшення вірогідності настання вагітності та ускладнень перебігу першого її триместру у жінок з високим рівнем Ат-ТПО. Для цього вивчались особливості гіпофізарно-яєчникового та тиреоїдного гомеостазу, а також структурно-функціональний стан репродуктивної системи у фолікулярній та лютеїновій фазах менструального циклу пацієнток з АІТ як на тлі, так і без гіпотиреозу.
За нашими результатами, у жінок з АІТ на тлі еутиреозу спостерігаються овуляторні менструальні цикли зі статистично достовірним зниженням концентрації естрадіолу та зменшенням ехоскопічного розміру домінантного фолікула в І фазі циклу при нормальних рівнях гонадотропінів (див. табл. 2), а також гіпогестагенія та зменшення соно-діаметру жовтого тіла у ІІ фазі циклу, що пояснюється неадекватністю оогенезу. Клінічно 41,7±14,2% пацієнток даної підгрупи мають скарги на періодичні мізерні кров’янисті виділення зі статевих шляхів за 5-6 днів до початку менструації.
Таблиця 2
Динаміка середніх значень вмісту досліджуваних гормонів та антитіл у обстежених жінок, M±m
| Гормони та антитіла | До лікування | Після І етапу | Після ІІ етапу | Контрольна група (n=50) | |||
| ІІа підгрупа (n=12) | ІІб підгрупа (n=31) | ІІа підгрупа (n=12) | ІІб підгрупа (n=18) | ІІа підгрупа (n=12) | ІІб підгрупа (n=18) | ||
| ТТГ, мМО/л | 1,89±0,19 | 13,25±3,24** | - | 1,83±0,22 | - | 1,67±1,35 | 1,51±0,11 |
| Ат-ТПО, МО/мл,** | 578,0±143,3 | 687,1±106,1 | 401,8±117,8* | 414,9±58,4* | 261,6±47,7* | 272,6±125,6* | 11,95±0,90 |
| ФСГ, МО/мл | 7,46±0,38 | 8,62±0,46** | 7,09±0,71 | 7,86±0,45** | 7,01±0,62 | 6,89±0,35* | 6,39±0,42 |
| ЛГ, МО/мл | 6,06±0,55** | 9,95±0,42** | 6,03±0,50** | 9,02±0,78** | 5,68±0,73 | 6,72±0,43*,** | 4,72±0,29 |
| Е2, пг/мл | 56,83±4,18** | 81,85±2,56** | 59,75±2,43** | 81,72±2,94** | 72,30±3,92* | 74,19±2,83* | 71,90±2,06 |
| Прл, нг/мл | 8,02±0,89 | 23,45±1,31** | 8,31±0,76 | 9,32±1,97*,** | 7,95±0,63 | 8,64±0,95* | 8,44±0,44 |
| ЛГ/ФСГ | 0,81±0,05 | 1,18±0,04** | 0,85±0,48 | 1,16±0,48** | 0,81±0,12 | 1,0±0,07* | 0,82±0,05 |
| Р, нг/мл | 2,21±0,24** | 3,67±0,183** | 2,54±0,63** | 3,60±0,82** | 12,64±0,74* | 14,02±0,74* | 13,43±0,89 |
Примітки:
1. * - різниця достовірна відносно відповідного показника до лікування в межах групи (р<0,05; р<0,01; р<0,001);
2. ** - різниця достовірна відносно відповідного показника контрольної групи (р<0,05).
При АІТ, що супроводжується гіпотиреозом, (див. табл. 2), відмічається гіперпролактинемія, гіперестрогенія, гіпогестагенія, збільшення рівнів гонадотропінів та гонадотропного індексу. Також у пацієнток даної підгрупи спостерігаються клінічні прояви олігоменореї та мультифолікулярна структура яєчників з овуляторними менструальними циклами у 48,4±9,0% жінок та відсутністю соно-ознак овуляції у 51,6±8,7% пацієнток. Отримані результати у жінок із гіпотиреозом на тлі АІТ можуть трактуватись як тенденція до розвитку полікістозу яєчників.
Звертає на себе увагу зниження сироваткового рівня прогестерону при збільшенні концентрації Ат-ТПО (табл. 3). Між зазначеними двома показниками визначено статистично значимий зворотній кореляційний зв’язок середньої сили (r=-0,606±0,099; р<0,001). Водночас, статистично достовірним виявився не тільки лінійний коефіцієнт кореляції рівнів Ат-ТПО та прогестерону, але й різниця між отриманими середніми числовими значеннями концентрацій гормону в двох виділених сукупностях (3,55±0,18 нг/мл та 1,99±0,24 нг/мл відповідно; р<0,001).
Таблиця 3
Взаємозв’язок рівня Ат-ТПО з концентрацією прогестерону
у всіх обстежених жінок із аутоімунним тиреоїдитом, M±m
| Обстежені жінки | Рівень прогестерону, нг/мл | Коефіцієнт кореляції, r |
| Жінки з концентрацією Ат-ТПО 98 – 1000 МО/мл (n=35) | 3,55±0,18 | -0,606±0,099; р<0,001 |
| Жінки з концентрацією Ат-ТПО 1001 – 2840 МО/мл (n=8) | 1,99±0,24 | |
| Всі жінки основної групи | 3,27±0,18 | - |
Оцінюючи методом математичного моделювання (Н.Дрейпер, 1987), який із чинників має більшу силу впливу на концентрацію прогестерону в крові у пацієнток з АІТ, ми провели багатофакторний кореляційно-регресійний аналіз зв’язку, з одного боку, рівня Ат-ТПО та низки інших факторіальних чинників, з іншого – концентрації прогестерону. Це дозволило нам кількісно визначити напрямок, достовірність та ступінь впливу різних факторів на рівень цього гормону. Оцінювались вік пацієнток, концентрації ФСГ, ТТГ та рівень Ат-ТПО. Під час дослідження з’ясувалось, що з чотирьохфакторної моделі необхідно виключити такий чинник, як рівень ТТГ через його високу мультиколінеарність (за рівнем критерію Феррара-Глаубера) з рівнем ФСГ, адже зазначені фактори виявились сильно взаємопов’язаними, тобто чинили вплив на концентрацію прогестерону один через інший. Стандартизоване рівняння регресії впливу вищезазначених чинників мало наступний вигляд: у=0,009х1+0,270х2–0,745х3,
де у – концентрація прогестерону,
х1 – вік жінок,
х2 – концентрація ФСГ,
х3 – концентрація Ат-ТПО.
Повний перелік параметрів трифакторного стандартизованого рівняння регресії представлений в таблиці 4.
Таблиця 4
Параметри математичної моделі впливу віку жінок, рівнів ФСГ та Ат-ТПО на концентрацію прогестерону
| Показник | Я-коеф. | sЯ | t | ПСВ |
| Вік жінок | 0,009 | 0,119 | 0,077 | 0,07 |
| Рівень ФСГ | 0,270 | 0,138 | 1,948 | 3,09 |
| Рівень Ат-ТПО | -0,745 | 0,137 | 5,432 | 45,16 |
Умовні позначення:
1. Я-коеф. – бета-коефіцієнт стандартизованого рівняння регресії;
2. sЯ – середнє квадратичне відхилення Я-коефіцієнта;
3. t – критерій Ст’юдента;
4. ПСВ – показник сили впливу (у відсотках).
Наведені дані свідчать, що найбільш значним чинником впливу на зниження сироваткової концентрації прогестерону є наявність та рівень Ат-ТПО (45,16% - показник сили впливу цього фактора, t=5,432). На його фоні впливи віку (ПСВ=0,07%, t=0,077) та рівня ФСГ (ПСВ=3,09%, t=1,948) виявляються незначними.
Таким чином, в клінічній практиці при високих рівнях антитілоутворення буде спостерігатись зниження сироваткової концентрації прогестерону, практично незалежно від віку жінок та концентрації у них ФСГ. Також отримана математична модель означає, що прогестеронова недостатність призводить до суттєвого підвищення рівня Ат-ТПО. Встановлена модель є статистично адекватною (р<0,05) за критерієм Фішера. В цілому, взаємозв’язок рівня Ат-ТПО, віку пацієнток, рівня ФСГ та концентрації прогестерону має статистично значимий множинний коефіцієнт кореляції: R=0,648±0,093.
Далі в ході дослідження вивчались особливості морфофункціональної структури ендометрію у жінок з патологією ЩЗ: у даного контингенту жінок однією з причин зниження шансів на вагітність, поряд з гаметним, може бути і ендометріальний фактор (M.Bals-Pratsch, 1993; K.Poppe, 2002). Слід зазначити, що, згідно сучасних правил біоетики, ми не проводили інвазивні дослідження у здорових жінок контрольної групи, а оцінка результатів, отриманих в основній групі, виконувалась на основі їх співставлення з даними контролю клініки або даними літератури (О.В. Буловенко, 2008).
Гістологічне дослідження аспіратів слизистої порожнини матки пацієнток з АІТ на тлі еутиреозу показало відставання морфофункціональної структури ендометрію від реального дня циклу на 2,75±0,18 дня у всіх жінок даної підгрупи, що дозволило нам гістологічно підтвердити у них діагноз НЛФ.
Для уточнення та об’єктивізації причин морфологічної невідповідності структури ендометрію дню та фазі менструального циклу у жінок з еутиреозом при АІТ імуногістохімічним методом вивчався характер імунолокалізації та експресії рецепторів ендометрію до яєчникових гормонів. У результаті з’ясувалось, що експресія ER в ендометріальних залозах становить 0%(−), в стромі – <10%(+); а PR – в залозах 10%(+), в стромі – 40-50%(++), тобто, згідно шкали Y.Yamamoto (1992), а також даних А.Vogler (1989) та K.H.Abd-el-Maeboud (1997), у даного контингенту жінок спостерігається зниження локальної експресії стероїдних рецепторів. Таким чином, з’ясувалось, що НЛФ у жінок з АІТ на тлі еутиреозу викликається як власне гормональною недостатністю жовтого тіла внаслідок недосконалого оогенезу, так і зменшенням чутливості ендометрію до статевих стероїдів (у відповідності до класифікації причин НЛФ C.Gompel, 1983).
В результаті гістологічного дослідження тканин ендометрію у жінок з АІТ, що супроводжується гіпотиреозом на тлі овуляторних менструальних циклів, виявилась не тільки невідповідність морфологічної картини клінічним проявам ІІ фази менструального циклу, проте й наявність у даного контингенту жінок гіпопластичних змін ендометрію, а саме, гіпопластичного ановуляторного ендометрію проліферативного типу.
При гістологічному дослідженні тканин слизистої порожнини матки у пацієнток даної підгрупи з соно-ознаками ановуляцій також виявлено невідповідність між морфофункціональною структурою ендометрію та станом репродуктивного гомеостазу: в аспірованих фрагментах ендометрію виявлено ациклічні гіпопластичні зміни отриманих тканин.
З наукових джерел відомо (Т.Ф.Татарчук, 2003; Т.В.Овсянникова, 2004), що наявність диспролактинемії призводить до зменшення в ендометрії кількості стероїдогенного реактивного протеїну, котрий відповідає за клітинну відповідь на гормональний вплив. Враховуючи те, що у жінок з АІТ на тлі гіпотиреозу виявлено підвищений сироватковий рівень пролактину (табл. 2), гіпопластичні зміни ендометрію у них ми пояснюємо саме пролактин-залежним зниженням чутливості клітин слизистої порожнини матки до впливу статевих стероїдів. Тобто навіть овуляторні цикли у жінок з гіпотиреозом на тлі АІТ та диспролактинемією не можуть викликати адекватної ендометріальної відповіді на гормональний вплив, навіть на тлі гіперестрогенії.
Для глибшого розуміння патогенетичних особливостей гіпоплазії ендометрію у жінок з АІТ та гіпотиреозом також вивчались особливості локальної експресії рецепторів ендометрію до статевих стероїдів. Виявлено, що жінки даної підгрупи з овуляторними менструальними мають нерівномірну експресію ER, що становить 50-60%(++/+++) у залозах та 30%(++) – у стромі; PR у залозах ендометрію також представлені нерівномірно на 70%(+++) та у стромі – на 60-70%(+++). У пацієнток з ановуляторними циклами та гіпоплазією ациклічного ендометрію ER в залозах ендометрію експресовані на 30%(++), у стромі – на 10%(+); PR в стромі представлені нерівномірно на 70%(+++), у залозах – рівномірно на 70-80% (+++).
Таким чином з’ясовано, що всі жінки з АІТ на тлі гіпотиреозу мають адекватну локальну експресію стероїдних рецепторів (K.H.Abd-el-Maeboud, 1997), чим підтверджується у них залежність гіпоплазії ендометрію від наявної диспролактинемії.
Виходячи із виявлених особливостей гормонального гомеостазу репродуктивної системи жінок із патологією ЩЗ, розроблено та апробовано диференційовану систему лікувально-профілактичних засобів двохетапної передгравідарної підготовки (ПП).
Враховуючи наявність тиреоїдної патології та виражену дисфункцію репродуктивної системи, ми вважали за доцільне всім пацієнткам основної групи на першому етапі провести етіопатогенетичне лікування АІТ згідно схеми, розробленої спільно з ендокринологами. При гіпотиреозі на тлі АІТ призначали препарат левотироксину еутирокс, дозування котрого підбиралось у залежності від ступеня порушення функції ЩЗ – від 50 до 200 мкг. Контроль рівня ТТГ проводився через один місяць після початку прийому еутироксу, при чому критерієм адекватності призначеної дози вважалось зниження сироваткового рівня ТТТ нижче 2,0 мМО/л.
З огляду на спільний механізм розвитку аутоімунного тиреоїдиту, всім жінкам основної групи призначали базову терапію, що містила немедикаментозні заходи та медикаментозне лікування.
Як немедикаментозну складову застосовували: мікрохвильову резонансну терапію (в діапазоні частот генератора когерентних коливань від 54 до 78 ГГц з вихідною потужністю 10-9–10-12 Вт/Гц) та ультрафонофорез із гідрокортизоном місцево на ЩЗ (з інтенсивністю випромінювання від 0,05 до 0,2 Вт/см2 та частотою ультразвукових коливань 880±0,88 кГц), – протягом двох тижнів.
Крім зазначених вище фізіотерапевтичних процедур, всім жінкам призначали прийом мікроелементу селену (100 мкг на день п’ять циклів по два тижні з перервою на сім днів між циклами), біологічно важлива роль якого пов’язана з антиоксидантними властивостями – патогенетичною ланкою лікування аутоімунного тиреоїдиту (В.А. Тутельян, 2002; O.Olivieri., 1995).
За літературними даними (Т.В.Овсянникова, 1997; S.R.Lincoln, 1999), рівень пролактину крові у жінок із гіпотиреозом нормалізується паралельно зі зниженням концентрації ТТГ при замісному лікуванні еутироксом, тому ми не призначали жінкам з гіпофункцією ЩЗ та гіперпролактинемією агоністів D2 дофамінових рецепторів до виконання першого контролю стану гіпофізарно-яєчникової системи.
Другий етап ПП жінок із аутоімунним тиреоїдитом проводився диференційовано в залежності від ступеня компенсації тиреоїдного гомеостазу. Пацієнткам з аутоімунним тиреоїдитом на тлі еутиреозу призначали комбінований естроген-гестагенний препарат фемостон (по 1 таблетці один раз на ніч протягом трьох послідовних менструальних циклів перед спробами лікування безплідності), якому, поряд із властивістю покращувати якість оогенезу, збільшувати кількість рецепторів ендометрію до яєчникових стероїдів та компенсувати гіпогестагенію, притаманна імуносупресивна дія, що також раціонально для даного контингенту жінок.
На другому етапі ПП пацієнток із гіпотиреозом на тлі АІТ, паралельно із замісною терапією левотироксином, призначали гестагенний препарат дуфастон, який, поряд з основними гестагенними, теж має імуносупресивні властивості (по 1 таблетці двічі на добу з 16 по 25-й день трьох послідовних менструальних циклів перед виконанням спроб лікування безплідності).
З метою контролю ефективності розробленої диференційованої системи ПП обстежено групу пацієнток із зазначеною тиреоїдною патологією. У підгрупу ІІа увійшли 12 жінок з АІТ без порушення функції ЩЗ, в підгрупу ІІб – 18 пацієнток з АІТ, що супроводжувався гіпотиреозом. Ендокринологічний контроль ефективності І етапу ПП проводився через три місяці після початку терапії, при чому, поряд з контролем стану ЩЗ, проводився також перший моніторинг динаміки змін репродуктивного гомеостазу з метою з’ясування впливу лікування тиреоїдної патології на стан гіпофізарно-яєчникової системи пацієнток з патологією ЩЗ. Для цього визначались сироваткові рівні ТТГ, Ат-ТПО, гонадотропінів, естрадіолу та пролактину у І фазі менструального циклу (1-3 день), а також – сироватковий рівень прогестерону в середині ІІ фази циклу (на 7-9 день після овуляції).
Аналіз ефективності І етапу ПП пацієнток з АІТ на тлі еутиреозу показав, що після його застосування статистично достовірно знижуються сироваткові рівні Ат-ТПО, проте не виявляється суттєвих змін у репродуктивному гомеостазі (див. табл. 2). Отримані результати ще раз підтверджують обґрунтованість та необхідність застосування диференційованого підходу, адже з’ясовано, що монотерапія тиреоїдної патології не дозволяє досягти позитивної динаміки у гормональних проявах порушень репродуктивного гомеостазу (рис. 2). В результаті контролю ефективності ІІ етапу ПП, як видно з таблиці 2 та рисунка 2, у жінок з АІТ на тлі еутиреозу спостерігалось підвищення сироваткового рівня естрадіолу в І фазі циклу (р<0,05) та концентрації прогестерону в ІІ фазі циклу (р<0,001).
Досліджуючи ефективність І етапу ПП жінок з АІТ, що супроводжується гіпотиреозом, ми виявили статистично достовірне покращення стану тиреоїдного гомеостазу, а також зниження сироваткового рівня пролактину при відсутності достовірних змін у гомеостазі гонадотропінів та яєчникових гормонів (див. табл. 8). Контроль ефективності ІІ етапу ПП показав зниження сироваткових концентрацій гонадотропінів (р<0,01), зменшення гонадотропного індексу (р<0,01), а також нормалізацію рівнів статевих стероїдів (р<0,001).
Наявність зворотного кореляційного зв’язку між сироватковими рівнями прогестерону та Ат-ТПО (див. табл. 3) підтверджується також динамікою концентрацій зазначених показників після застосування ІІ етапу ПП (див. табл. 2). Так, у всіх жінок з АІТ, незалежно від функціональної здатності ЩЗ, спостерігалось зниження концентрацій Ат-ТПО на тлі застосування гормональної ланки системи ПП - гестагена дідрогестерона, що входить до складу фемостона та дуфастона. Це дозволяє припустити імуностабілізуючу дію прогестерону на перебіг аутоімунного процесу в ЩЗ.
Після застосування двохетапної системи ПП проводився також і гістологічний контроль її ефективності. Аспіраційна біопсія ендометрію показала відповідність морфофункціональної структури ендометрію реальному дню менструального циклу у 10 (83,3±10,8%) пацієнток з АІТ та еутиреозом (р<0,01), а також нормальну морфофункціональну структуру ендометрію у 16 (88,9±7,4%) жінок з АІТ на тлі гіпотиреозу (р<0,01).
Також слід зазначити, що на тлі прийому лікувально-профілактичних заходів ПП у 7 (70,0±14,5%) пацієнток з соно-ознаками ановуляцій відновились овуляторні менструальні цикли (p<0,05).
Таким чином, результати застосування розробленого двохетапного комплексу лікувально-профілактичних заходів ПП у жінок з АІТ як на тлі, так і без гіпотиреозу, підтверджують їх ефективність, патогенетичну обґрунтованість та доцільність застосування в клінічній практиці.
ВИСНОВКИ
У дисертації наведене вирішення актуального наукового завдання щодо підвищення ефективності лікування безплідності у жінок із тиреоїдною патологією шляхом удосконалення алгоритму підготовки до допоміжних репродуктивних технологій на основі встановлення взаємозв’язків між структурно-функціональним станом гіпофізарно-яєчникової системи, морфофункціональними особливостями ендометрію та гомеостазом щитоподібної залози.
1. Ретроспективний аналіз застосування допоміжних репродуктивних технологій при різних формах безплідності показав, що в структурі порушень жіночої фертильності питома вага тиреоїдної патології становить 16,3%. При цьому клінічно значимими захворюваннями щитоподібної залози, що впливають на тактику ведення та результативність методів допоміжних репродуктивних технологій, є аутоімунний тиреоїдит, як на тлі еутиреозу (69,7%), так і при гіпотиреозі (24,2%), а також некоригований гіпотиреоз (6,1%).
2. Клінічними особливостями допоміжних репродуктивних технологій у жінок із гіпотиреозом, як некоригованим, так і на тлі аутоімунного тиреоїдиту, є неефективність використання лікувальних програм у природному циклі в зв’язку з відсутністю спонтанного фолікулогенезу, а також мультифолікулярний відгук на стимуляцію кломіфенцитратом у дозі 50 мг на добу. Результативність (частота настання клінічної вагітності) допоміжних репродуктивних технологій у пацієнток із патологією щитоподібної залози становить 15,1%, що істотно нижче цього показника у пацієнток без тиреоїдної патології (29,2%; р<0,05). При цьому репродуктивний прогноз погіршує збільшення рівня антитіл до тиреопероксидази вище 1000 МО/мл (r=-0,511±0,113; р<0,01).
3. При аутоімунному тиреоїдиті за умов еутиреозу відмічаються овуляторні менструальні цикли з недостатністю лютеїнової фази внаслідок недосконалого оогенезу, що підтверджується нормальними рівнями гонадотропінів, статистично достовірним зменшенням концентрації естрадіолу та ехоскопічного розміру домінантного фолікула, зниженням сироваткового рівня прогестерону та соно-розміру жовтого тіла, а також наявністю морфофункціональних ознак недостатності лютеїнової фази. При аутоімунному тиреоїдиті на тлі гіпотиреозу відмічається гіперпролактинемія, а також збільшення гонадотропного індексу, що, поряд з олігоменореєю та результатами УЗ-діагностики (мультифолікулярна структура яєчників із субкапсульним розташуванням фолікулів у 100% жінок та соно-ознаками ановуляції у 51,6±9,0% пацієнток) може трактуватись як ознаки розвитку полікістозу яєчників. Встановлено достовірний зворотний взаємозв’язок концентрації прогестерону та рівня антитіл до тиреопероксидази (r=-0,606±0,099, р<0,001), що також підтверджується регресом антитілоутворення на тлі прийому дідрогестерону.
4. У жінок з еутиреозом на тлі аутоімунного тиреоїдиту гістологічно підтверджується діагноз недостатності лютеїнової фази (відставання морфологічної структури ендометрію від реального дня циклу на 2,8±0,2 дня), що викликається як власне гормональною недостатністю жовтого тіла, так і зниженням рецепції ендометрію до яєчникових стероїдів. У пацієнток із гіпотиреозом та аутоімунним тиреоїдитом спостерігається морфологічно гіпопластичний ендометрій внаслідок пролактин-залежного зниження чутливості ендометрію до статевих гормонів, що підтверджується відсутністю порушень локальної експресії стероїдних рецепторів при підвищених сироваткових рівнях естрадіолу.
5. Перебіг першого триместру вагітності після допоміжних репродуктивних технологій у 66,7% жінок із тиреоїдною патологією супроводжувався розвитком ускладнень, що перевищувало відповідний показник в контрольній групі (28,6%, р<0,05). Зокрема, спостерігались: загроза переривання у 40,0%, мимовільний аборт у 13,3% та мимовільна редукція одного плоду із двійні у 13,3% (17,1%; 5,7%; 5,7% - відповідно в контрольній групі, р>0,05).
6. Розроблений комплекс лікувально-профілактичних заходів перед-гравідарної підготовки жінок з патологією щитоподібної залози, що включає базову тиреоїдну терапію та наступне призначення гестагенних або комбінованих естроген-гестагенних препаратів, диференційоване в залежності від ступеня компенсації тиреоїдного гомеостазу, ефективно забезпечує адекватну підготовку до допоміжних репродуктивних технологій шляхом корекції репродуктивних порушень у 83,3±10,8% жінок з аутоімунним тиреоїдитом на тлі еутиреозу та у 88,9±7,4% пацієнток з аутоімунним тиреоїдитом при гіпотиреозі, а також чинить позитивний вплив на стан щитоподібної залози, зменшуючи активність аутоімунного процесу.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. З огляду на існування анатомо-функціональних порушень репродуктивної системи та зниження ефективності лікування безплідності методиками ДРТ у жінок з патологією ЩЗ, даний контингент пацієнток слід відносити до групи ризику щодо зниження фертильності та проводити поглиблене обстеження на предмет своєчасного виявлення дисгормональних розладів.
2. Всім жінкам з ендокринними формами безплідності, а саме гіперпролактинемією, полікістозом яєчників та недостатністю лютеїнової фази рекомендується скринінгове обстеження стану ЩЗ для виявлення аутоімунного тиреоїдиту та гіпотиреозу. При плануванні лікування безплідності методами ДРТ рекомендується проводити скринінг присутності антитіл до тиреопероксидази як незалежного маркера невдач таких програм.
3. Враховуючи високий рівень мультифолікулярних відгуків у жінок з гіпотиреозом, як некоригованим, так і на тлі аутоімунного тиреоїдиту, при індукції овуляції слід застосовувати мінімальні дози кломіфенцитрату з метою запобігання багатоплідній вагітності у разі одночасної овуляції всіх фолікулів. У зв’язку з ризиком розвитку синдрому гіперстимуляції яєчників у пацієнток з гіпотиреозом, як некоригованим, так і на тлі аутоімунного тиреоїдиту, ми рекомендуємо призначати їм мінімальні дози гонадотропінів.
4. В лікувально-профілактичний комплекс передгравідарної підготовки жінок з аутоімунним тиреоїдитом крім базової етіопатогенетичної терапії (селен, фізіотерапевтичні заходи: мікрохвильова резонансна терапія, ультрафонофорез з гідрокортизоном місцево на щитоподібну залозу, - а також еутирокс за умов гіпотиреозу) другим етапом доцільно включати препарати, що містять селективні гестагени (дуфастон) при гіпотиреозі та комбіновані естроген-гестагенні препарати з натуральними естрогенами та селективними гестагенами (фемостон) при еутиреозі.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Вороненко Н.Ю. Агоністи та антагоністи гонадотропін-рилізинг гормону в різних протоколах допоміжних репродуктивних технологій // Збірник наукових праць співробітників КМАПО ім. П.Л. Шупика. – Київ. – 2005. – Випуск 13 (частина 3). – С. 184 – 191.
2. Дахно Ф.В., Вороненко О.Ю., Вороненко Н.Ю. Особливості допоміжних технологій у жінок з тиреоїдною патологією // Педіатрія, акушерство, гінекологія. – 2005. – №3. – С. 98-101. (особисто автором проводився огляд та переклад літературних джерел, статистична обробка, узагальнення та аналіз даних, підготовка до друку).
0 комментариев