ДЕРЖАВНА УСТАНОВА
«ІНСТИТУТ ПРОБЛЕМ ЕНДОКРИННОЇ ПАТОЛОГІЇ ім. В.Я. ДАНИЛЕВСЬКОГО АКАДЕМІЇ МЕДИЧНИХ НАУК УКРАЇНИ»
ВЕЛИКИХ НАДІЯ ЄВГЕНІВНА
УДК 616.379-008.64:615.252.349
ОСОБЛИВОСТІ РОЗВИТКУ АБСОЛЮТНОЇ ІНСУЛІНОВОЇ НЕДОСТАТНОСТІ У ХВОРИХ НА ЦУКРОВИЙ ДІАБЕТ 2 ТИПУ ТА ОБҐРУНТУВАННЯ ДИФЕРЕНЦІЙОВАНОЇ ТЕРАПІЇ
14.01.14 - ендокринологія
Автореферат дисертації на здобуття наукового ступенякандидата медичних наук
Харків - 2008
Дисертацією є рукопис
Робота виконана в Державній установі «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України»
Науковий керівник доктор медичних наук, професор Караченцев Юрій Іванович, Державна установа «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України», директор
Офіційні опоненти:
доктор медичних наук, професор Хворостінка Володимир Миколайович, Харківський національний медичний університет МОЗ України, завідувач кафедри факультетської терапії
доктор медичних наук, професор Бобирьова Людмила Єгорівна, Вищий державний навчальний заклад України «Українська медична стоматологічна академія» МОЗ України, завідувачка кафедри ендокринології з лікувальною фізкультурою та спортивною медициною
Захист відбудеться “_26_” ___червня___ 2008 року о _13__ годині на засіданні спеціалізованої вченої ради Д 64.564.01 при Державній установі «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України» (61002, м. Харків, вул. Артема, 10).
З дисертацією можна ознайомитися в бібліотеці Державної установи «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України» (61002, м. Харків, вул. Артема, 10).
Автореферат розісланий „__23_” ___травня_______ 2008 р.
Учений секретар
спеціалізованої вченої ради
кандидат медичних наук Т.М. Тихонова
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. На сучасному етапі розвитку науки показано існування спонтанної еволюції цукрового діабету (ЦД) (UKPDS Group, 1995). Вона являє собою процес переходу відносної інсулінової недостатності в абсолютну, яка потребує екзогенного введення інсуліну як життєво необхідного методу лікування. Швидкість формування абсолютної інсулінової недостатності переважно залежить від стану β-клітин на момент виявлення захворювання (UKPDS Group, 1998). Незважаючи на загальновідомий факт розвитку з часом інсулінової залежності у хворих на ЦД 2 типу та сучасні рекомендації щодо призначення інсулінотерапії на стадії відносної інсулінової недостатності для гальмування розвитку діабетичних ускладнень (American Diabetes Association and the European Association for the Study of Diabetes, 2006), велика кількість хворих тривалий час отримує пероральну цукрознижуючу терапію, яка згодом не забезпечує належну компенсацію вуглеводного обміну (Єфімов А.С., 2002; Боцюрко В.І., 2003; Зелінська Н.Б., 2004; Бобирьова Л.Є., 2005; Маньковський Б.М., 2006). Це пов’язано, насамперед, з так званою «психологічною інсулінорезистентністю» хворих, які будь-якими шляхами намагаються уникнути терапії інсуліном, та лікарів, які не переконані у необхідності саме цього методу лікування (Hunt L. et al., 1997; Peyrot M. et al., 2005; Haque M. et al., 2005; Polonsky W. et al., 2005; Snoek F. et al., 2006; Meece J., 2006). Враховуючи це, існує актуальна проблема розробки чітких критеріїв своєчасного призначення інсулінотерапії, яка при її ранньому використанні допомагає забезпечити більш тривалий період залишкового функціонування β-клітин підшлункової залози, зменшити дозу пероральних цукрознижуючих препаратів при комбінованій терапії (завдяки ефекту потенціювання фармакологічної дії) та в такий спосіб послабити ступінь прояву їх можливих побічних ефектів (Зуєва Н.О., 2000; Боднар П.М., 2005; Тронько М.Д., 2006; Сергієнко О.О., 2006; Хворостінка В.М., 2006; Паньків В.І., 2007). Крім того, на певному етапі терапії похідними сульфонілсечовини спостерігається вторинна сульфаніламідна неадекватність, що спричиняє необхідність екзогенного введення інсуліну (Генделека Г.Ф., 2000; Балаболкин М.И. і співавт., 2000). Це можна пояснити тим, що тривале застосування похідних сульфонілсечовини при неадекватному метаболічному контролі потенціює глюкозотоксичність, яка, у свою чергу, стимулює апоптоз клітин інсулінопродукуючого апарату підшлункової залози. Необхідно також зазначити, що похідні сульфонілсечовини, які широко використовуються для лікування ЦД 2 типу, стимулюючи виділення інсуліну, викликають ендогенну гіперінсулінемію, що є атерогенною. Екзогенне ж введення інсуліну при ЦД 2 типу не викликає процесів атерогенезу і не має негативних судинних ефектів, що є дуже важливим для хворих, у яких уже під час виявлення захворювання наявні певні судинні ускладнення ЦД (UKPDS Group, 1998).
Відомо, що ЦД 1 та 2 типів включає одні й ті ж стадії захворювання – від відсутності інсулінової залежності до наявності такої, проте тривалість цих періодів значно відрізняється. Не викликає сумніву участь генетичних механізмів та факторів зовнішнього середовища в розвитку обох типів захворювання. Результати вітчизняних та закордонних досліджень свідчать про роль спадкового компоненту в детермінації розвитку абсолютної інсулінової недостатності при ЦД 2 типу (Polonsky K.S., 1996; Levchenko T.P. et al., 1997; Генделека Г.Ф., 2001; Штан-дель С.А. і співавт., 2001; Tuomi T., 2005). Так існує припущення, що в популяції збільшилась частота генного комплексу схильності до абсолютної інсулінової недостатності внаслідок введення в широку практику інсулінотерапії. Остання призвела до подовження тривалості життя хворих на ЦД 1 типу і здатності залишати нащадків, у яких існує можливість підвищеної частоти зустрічаємості комплексу генів схильності як до 1-го, так і 2-го типів ЦД (Erbey J.R. et al., 1998; Штандель С.А. і співавт., 2001; Xu P. et al., 2007). Проте до сьогодні відсутні чіткі маркери, за допомогою яких уже під час встановлення діагнозу ЦД можна було б прогнозувати швидкість еволюції захворювання в кожного конкретного хворого для призначення йому найбільш оптимального лікування. Виходячи з цього, доцільним є напрямок дослідження наявності міцно асоційованих з ЦД 1 типу генів у хворих на ЦД 2 типу з інсулінозалежністю.
Зважаючи на аутоімунний генез деструкції панкреатичних β-клітин при ЦД 1 типу, особливу увагу привертають дослідження останніх років про ймовірність участі локусу PTPN22, який кодує фермент тирозинфосфатазу, в негативному контролі каскаду Т-клітинних реакцій, які забезпечують імунний гомеостаз (She J.X. et al., 1998; Alonso A. et al., 2004). Визначено асоціацію ЦД 1 типу та поліморфізму С→Т1858Т гену тирозинфосфатази (PTPN22), який пов’язаний з розвитком процесів аутоімунної агресії проти β-клітин підшлункової залози (Zheng W. et al., 2005; Федець М. і співавт., 2006). Даний поліморфізм полягає в заміщенні цитозину (С) на тимін (Т) в положенні 1858. Вищенаведене дозволяє тестувати дану мутацію для оцінки участі генів, асоційованих з ЦД 1 типу, в розвитку абсолютної інсулінової недостатності у хворих на ЦД 2 типу. На популяції міста Харкова дослідженнями Федець М. та співавт. (2006) підтверджено існування зв’язку між відповідним поліморфізмом С→Т1858Т гену PTPN22 та ЦД 1 типу, що обумовлює актуальність дослідження саме цього гену для виділення групи хворих із генетично детермінованою високою швидкістю розвитку абсолютної інсулінової недостатності за умов ЦД 2 типу.
На теперішній час розроблені алгоритми лікування ЦД 2 типу (American Diabetes Association and the European Association for the Study of Diabetes, 2006), проте немає чітких критеріїв відносно вибору одного з трьох варіантів терапії на етапі неможливості досягнення компенсації вуглеводного обміну за допомогою модифікації способу життя та застосування метформіну. Усі лікарі-ендокринологи зустрічаються у своїй практиці як із хворими, яким уже через кілька років необхідно призначати інсулінотерапію внаслідок декомпенсації вуглеводного обміну, так і з пацієнтами, які протягом тривалого часу (20-30 років) мають задовільну компенсацію стану, використовуючи пероральні цукрознижуючі препарати. Саме проблемі визначення факторів, які можуть впливати на тривалість спонтанної еволюції ЦД 2 типу, присвячена дана робота. Прогнозування швидкості розвитку абсолютної інсулінової недостатності у хворих на ЦД 2 типу під час маніфестації захворювання дозволить виділяти хворих, які потребують найбільш раннього призначення інсулінотерапії (спочатку базального в комбінації з пероральними цукрознижуючими препаратами) для «контролю» вуглеводного обміну, а не «для виживання» (ВООЗ, 1999). Призначення інсулінотерапії хворим на етапі неефективності лікування метформіном дозволить подовжити спонтанну еволюцію ЦД 2 типу та затримати прогресування діабетичних ускладнень.
Зв’язок роботи з науковими програмами, планами, темами. Дисертацію виконано згідно з планом науково-дослідних робіт ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України» в рамках НДР: «Оптимізація засобів вторинної та третинної профілактики судинних ускладнень у хворих на цукровий діабет 2 типу з урахуванням його гетерогенності» № держреєстрації 0104U002203.
Мета і завдання дослідження. Мета дослідження – визначити фактори ризику раннього розвитку абсолютної інсулінової недостатності у хворих на ЦД 2 типу, залежно від характеру перебігу захворювання, і обґрунтувати алгоритм диференційованої терапії, спрямованої на гальмування спонтанної еволюції ЦД.
Основні завдання дослідження:
1. Дослідити значення дисглікемії, дисліпідемії та асоційованих із ними кардіо-васкулярних порушень на момент обстеження та в анамнезі захворювання для розвитку інсулінової залежності в осіб, хворих на ЦД 2 типу.
2. Виявити генетичну схильність хворих на ЦД 2 типу до раннього розвитку абсолютної інсулінової недостатності шляхом аналізу родоводів пацієнтів.
3. Визначити наявність поліморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), який асоційований з аутоімунною деструкцією панкреатичних β-клітин, у хворих на ЦД 2 типу з відносною та абсолютною інсуліновою недостатністю; оцінити його патогенетичне значення в еволюції захворювання.
4. Установити присутність антитіл до острівцевих клітин підшлункової залози (ІСА) для визначення участі аутоімунних механізмів у розвитку абсолютної інсулінової недостатності за умов ЦД 2 типу.
5. Дослідити рівень С-пептиду в сироватці крові як показника ендогенної продукції інсуліну у хворих на ЦД 2 типу, залежно від виду терапії, для диференціації відносної та абсолютної недостатності інсуліну.
6. На підставі отриманих даних удосконалити існуючі алгоритми терапії ЦД 2 типу.
Об’єкт дослідження – хворі на ЦД 2 типу за наявності відносної та абсолютної інсулінової недостатності.
Предмет дослідження – параметри вуглеводного обміну, секреції інсуліну, імунологічні та генетичні маркери швидкого розвитку абсолютної інсулінової недостатності у хворих на ЦД 2 типу.
Методи дослідження: клінічні, біохімічні, імуноферментні, генеалогічні, молекулярно-генетичні, статистичні.
Наукова новизна одержаних результатів. Визначено гетерогенність чинників, які впливають на швидкість розвитку абсолютної інсулінової недостатності у хворих на ЦД 2 типу. Виділено групу ризику щодо раннього розвитку інсулінової залежності на основі вивчення анамнезу хворих: генеалогічного (хворі, які мають двох та більше родичів, хворих на ЦД 2 типу) та клінічного (хворі, які перенесли інфаркт міокарда). Доведено, що помірна гіперглікемія під час маніфестації захворювання не є предиктором характеру спонтанної еволюції ЦД. Охарактеризовано поліморфізм С→Т1858Т гену PTPN22 (тирозинфосфатази) у хворих на ЦД 2 типу в популяції міста Харкова та визначено несуттєве значення аутоімунних механізмів в еволюції захворювання. На підставі детального вивчення клінічного анамнезу та родоводів хворих на ЦД 2 типу патогенетично обґрунтовано призначення інсулінотерапії на етапі неефективності лікування метформіном особам із групи ризику швидкого формування абсолютної інсулінової недостатності.
Практичне значення одержаних результатів. Результати вивчення генеалогічної інформації хворих на ЦД 2 типу дозволяють виділити пацієнтів групи ризику раннього розвитку абсолютної інсулінової недостатності, які мають двох та більше родичів, хворих на діабет. Крім того, наявність в анамнезі судинних катастроф, а саме інфаркту міокарда, дозволяє також прогнозувати більш ранній розвиток абсолютної інсулінової недостатності. Хворим групи ризику доцільно додатково призначати інсулінотерапію на етапі неефективності лікування метформіном з метою подовження періоду функціонування панкреатичних β-клітин. Хворим на ЦД 2 типу з низькою концентрацією С-пептиду, що отримують терапію пероральними цукрознижуючими препаратами, доречно призначати курси тимчасової інсулінотерапії для диференціації станів відносного та абсолютного дефіциту інсуліну. Удосконалені клінічні підходи до лікування хворих на ЦД 2 типу дозволять ефективно та своєчасно загальмувати розвиток абсолютної інсулінової недостатності та прогресування ускладнень захворювання, поліпшити якість життя хворих.
Основні результати досліджень упроваджені в роботу клініки ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України» м. Харкова; Рівненського обласного ендокринологічного диспансеру; ендокринологічного відділення міської лікарні №4 Маріупольського управління охорони здоров’я; ендокринологічного відділення Сумської обласної клінічної лікарні; КУ «Обласний клінічний ендокринологічний диспансер» Запорізької обласної ради.
Особистий внесок здобувача. Здобувачем самостійно проведено патентно-інформаційний пошук. На основі аналізу літератури спільно з науковим керівником визначено напрямок, мету і завдання дослідження. Автор самостійно проводила обстеження хворих, готувала матеріал біологічних рідин для біохімічних та імуноферментних досліджень, провела статистичний аналіз отриманих даних та проаналізувала результати дослідження.
Апробація результатів дисертації. Основні положення дисертації представлено та обговорено на Всеукраїнській науково – практичній конференції молодих учених і спеціалістів «Від фундаментальних досліджень до медичної практики» (Харків, 2005), науково-практичній конференції з міжнародною участю «Ендокринна патологія у віковому аспекті» (Харків, 2007) та науково-практичній конференції з міжнародною участю «Фундаментальна та клінічна ендокринологія: проблеми, здобутки, перспективи» (Сьомі Данилевські читання) (Харків, 2008).
Публікації. За темою дисертації опубліковано 7 наукових праць, з яких 4 статті (2 самостійних та решта у співавторстві) у фахових виданнях, затверджених ВАК України, 3 роботи у матеріалах науково-практичних конференцій.
Структура та обсяг дисертації. Дисертацію викладено на 157 сторінках машинописного тексту. Вона складається із вступу, огляду літератури, шести розділів власних досліджень, обговорення отриманих результатів, висновків, списку використаних джерел, який містить 234 посилання та складає 25 сторінок. Дисертацію проілюстровано 36 таблицями та 25 рисунками.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали та методи дослідження. У дослідження було включено 205 осіб, хворих на ЦД 2 типу. Вік хворих коливався від 50 до 80 років.
Залежно від клінічних симптомів захворювання, глікемії натще та постпрандіальної, рівня глікозильованого гемоглобіну, глюкозурії, визначали ступінь компенсації ЦД. У якості лабораторних показників глікемічного контролю використовували критерії European Diabetes Policy Group (1999), а саме: компенсація (глікемія натще (4,4-6,1) ммоль/л, постпрандіальна (4,4-8,0) ммоль/л, глікозильований гемоглобін менше 6,5%, аглюкозурія), субкомпенсація (глікемія натще менше чи дорівнює 7,8 ммоль/л, постпрандіальна менше чи дорівнює 9,5 ммоль/л, глікозильований гемоглобін менше чи дорівнює 7,5%, глюкозурія менше чи дорівнює 0,5%) та декомпенсація (глікемія натще більше 7,8 ммоль/л, постпрандіальна більше 9,5 ммоль/л, глікозильований гемоглобін більше 7,5%, глюкозурія більше 0,5%).
Пацієнтів було розподілено на дві групи, співставні за статтю, віком та тривалістю ЦД. Критерієм включення до першої групи була ефективна пероральна цукрознижуюча терапія, при цьому тривалість її становила не менше 15 років.
До другої групи увійшли хворі, які отримували інсулінотерапію, розпочату у зв’язку з декомпенсацією вуглеводного обміну. Тривалість періоду ефективної пероральної цукрознижуючої терапії в цих осіб була меншою за 15 років. Критерієм виключення був початок інсулінотерапії у зв’язку з розвитком судинних катастроф, трофічних поразок нижніх кінцівок, планових хірургічних втручань, розвитку пізніх ускладнень ЦД.
З 205 осіб клінічне обстеження було проведено 65 хворим на ЦД 2 типу. До першої групи увійшли 34 пацієнти (13 чоловіків та 21 жінка) з легким (один хворий), середньої важкості (31 хворий) та важким (2 хворих) перебігом ЦД, що отримували дієтотерапію та терапію пероральними цукрознижуючими препаратами – похідними сульфонілсечовини (глібенкламідом, гліклазидом, глімепіридом) у вигляді монотерапії або в комбінації з метформіном. До другої групи увійшов 31 хворий на ЦД 2 типу з інсулінозалежністю (14 чоловіків та 17 жінок). Чотирнадцять осіб мали середню важкість захворювання, 17 пацієнтів – важкий ЦД. Усі обстежені мали ускладнення основного захворювання. Найчастішою супутньою патологією були гіпертонічна хвороба та ішемічна хвороба серця. Гіпертонічну хворобу мали 28 осіб (82,3%) з І групи та 27 осіб (87,1%) з ІІ групи. На ішемічну хворобу серця страждали по 30 пацієнтів з кожної групи (88,2 % хворих І та 96,8 % хворих ІІ групи).
Обстеження включало аналіз скарг, ретельне вивчення анамнезу захворювання, визначення антропометричних показників (зріст, маса тіла, індекс маси тіла, обсяг талії, обсяг стегон), аналіз загальноклінічних, біохімічних та імунологічних показників, проведення генеалогічного та молекулярно-генетичного обстеження. Наявність та ступінь ожиріння визначалися за індексом маси тіла згідно з критеріями ВООЗ (2000). Тип ожиріння оцінювався за загальноприйнятим індексом обсяг талії/обсяг стегон (ОТ/ОС): абдомінальний тип ожиріння визначався у жінок при значенні індексу ОТ/ОС більше, ніж 0,85; у чоловіків – більше, ніж 0,9. При цьому значення обсягу талії, характерні для метаболічного синдрому, визначались за критеріями NCEP-ATP III (2001): більше 89 см для жінок та більше 102 см для чоловіків.
Дисліпідемію діагностували при перевищенні ліпідних рівнів ризику, а саме: концентрація в сироватці крові тригліцеридів (ТГ) 1,7 ммоль/л, загального холестерину (ЗХС) 5,2 ммоль/л, холестерину ліпопротеїдів високої щільності (ЛПВЩ) менше 1,2 ммоль/л, холестерину ліпопротеїдів низької щільності (ЛПНЩ) 2,6 ммоль/л, холестерину ліпопротеїдів дуже низької щільності (ЛПДНЩ) 0,8 ммоль/л (American Diabetes Association, 2000).
Концентрацію глюкози в крові визначали глюкозооксидазним методом за допомогою ферментативного аналізатора глюкози “Ексан-Г” (Литва), середньодобову глікемію розраховували як середній показник глікемії протягом доби. Зразки венозної крові забирали в кожної особи після 12-годинного голодування. Глікозильований гемоглобін визначали фотоколориметричним методом (Parker K.M. et al., 1981), концентрації ЗХС, ЛПВЩ, ТГ – ферментативним методом. Концентрацію ЛПНЩ, ЛПДНЩ та коефіцієнт атерогенності (КА) обчислювали за загальноприйнятими формулами (Климов А.Н., 1999). Концентрацію С-пептиду досліджували за допомогою імуноферментного набору для кількісного визначення останнього в сироватці крові (C-peptide ELISA EIA-1293 DRG Instruments GmbH, Germany). Діапазон нормальних значень для даного набору становив 0,5-3,2 нг/мл. ІСА визначали за допомогою імуноферментного тесту для якісного визначення циркулюючих антитіл в сироватці крові людини Isletest-ICA, “BIOMERICA”. Результат вважали позитивним, якщо оптична щільність дорівнювала або перевищувала значення точки відсікання (0,25), а негативним, – якщо була нижче за 0,25.
Збір генеалогічної інформації проводили шляхом особистого опитування згідно з рекомендаціями ВООЗ. Сімейне накопичення ЦД серед родичів першого та другого ступеня спорідненості вивчено у 160 хворих на ЦД 2 типу з абсолютною інсуліновою недостатністю та 45 пацієнтів з ЦД 2 типу з відносною інсуліновою недостатністю (тривалою ефективною пероральною цукрознижуючою терапією).
Визначення поліморфізму С→Т1858Т гену PTPN22 (дослідження алельних варіантів цього гену) при ЦД 2 типу було проведено у 52 пацієнтів (36 хворих на ЦД 2 типу за наявності відносної інсулінової недостатності та у 16 хворих на ЦД 2 типу з інсулінозалежністю). За дозволом М.І. Федець для проведення порівняльного аналізу було використано її дані щодо розповсюдження алелей С та Т гену PTPN22 серед здорових та хворих на ЦД 1 типу мешканців міста Харкова (Федець М.І. та співавт., 2006). Визначення поліморфізму проводилось в ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського Академії медичних наук України» шляхом виконання полімеразної ланцюгової реакції та рестриктного аналізу за умов, викладених у роботах Zheng W. (Zheng W., 2005), сумісно зі старшим науковим співробітником лабораторії патофізіології та медичної генетики к.б.н. С.А. Штандель.
При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону Гаусса проводили, розраховуючи показники асиметрії та ексцесу. Однорідність груп визначали за середніми величинами та дисперсіями. Порівняння часток проводили за допомогою критерію Фішера. Для статистичної оцінки розходжень, що спостерігалися між емпіричними та теоретичними частотами варіаційного ряду, використовували критерій χ2. Зв’язок між кількісними нормально розподіленими показниками оцінювали за допомогою коефіцієнта кореляції Пірсона. Для визначення зв’язку між якісною ознакою з двома варіантами та кількісною ознакою використовували бісеріальний коефіцієнт кореляції (Лакин Г.Ф., 1990). Асоціацію захворювання зі статтю визначали за допомогою тетрахоричного показника зв’язку. Порівняння груп за кількісними ознаками, що нормально розподіляються, проводили за допомогою критерію Ст’юдента. Для порівняння декількох груп використовували однофакторний дисперсійний аналіз (Плохинский Н.А., 1970). Для визначення типу дисліпідемії проведено факторний аналіз (Дюк В., 1997). Висновок про силу зв’язку між генетичними маркерами та захворюванням робили на підставі розрахунку показника відносного ризику (RR), який показує, у скільки разів специфічність ДНК, що тестована на роль маркера, частіше (рідше) зустрічається в одній із груп, порівняно з іншою (Armitage P. et al., 1994). Перевірку статистичних гіпотез проводили на рівні значущості 0,05.
Результати дослідження та їх обговорення. На першому етапі дослідження проведено клініко-анамнестичне обстеження хворих на ЦД 2 типу за умов відносної (І група) та абсолютної (ІІ група) інсулінової недостатності. При вивченні анамнезу захворювання розглянуто стан вуглеводного обміну на момент постановки діагнозу. Виявлено, що у більшості обстежених хворих глікемія не перевищувала 11,0 ммоль/л (в середньому (9,65±0,2) ммоль/л). За таких умов не визначено залежності швидкості еволюції ЦД 2 типу від рівня виявленої на момент маніфестації захворювання глікемії. Таким чином, помірна виразність гіперглікемії (в межах (7,0-11,0) ммоль/л) під час постановки діагнозу ЦД має обмежену інформативність для передбачення швидкості формування у хворого абсолютної інсулінової недостатності. При аналізі особливостей попередньої терапії пацієнтів не визначено залежності між тривалістю періоду відносної інсулінової недостатності та видом пероральних цукрознижуючих препаратів, що були призначені хворим. Вивчення анамнезу обстежених пацієнтів виявило, що тривалість періоду від початку захворювання до моменту призначення інсулінотерапії або до моменту обстеження (у групі хворих з відносною інсуліновою недостатністю) не визначалася фактом дотримання хворими рекомендацій лікаря щодо дієтичного режиму та лікування. Тобто тривалість періоду відносної інсулінової недостатності не залежала від комплаєнтності хворих.
Як відомо, дисліпідемії майже завжди супроводжують ЦД, посилюючись за наявності надлишкової ваги. За результатами вивчення особливостей ліпідного обміну хворих на ЦД 2 типу, залежно від ступеня інсулінової недостатності, було побудовано факторні моделі, які виявили наявність в обох групах хворих дисліпідемій ІІ-а та ІV типу (ВООЗ). У ІІ групі також виділено присутність гіпоальфахолестеринемії, яка є самостійним чинником ризику атеросклерозу (Клімов А.М. і співавт., 1999). Для візуальної оцінки показників ліпідного спектру було побудовано діаграми частот виявлення відхилень показників ліпідного спектру від нормативних значень (Рис. 1).
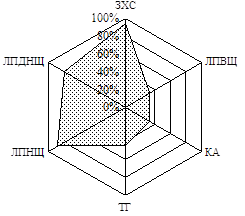
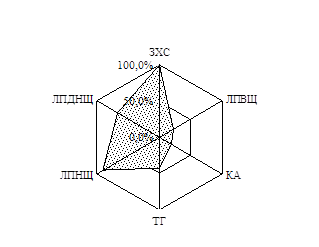
Рис. 1. Частота виявлення відхилень показників ліпідного спектру від нормативних значень у хворих І та ІІ груп
Слід зауважити, що хворі на ЦД 2 типу відрізнялись між собою за рівнем ЛПДНЩ (від нормальних до підвищених значень), при цьому він зростав зі збільшенням ваги. Коефіцієнт атерогенності змінювався, залежно від індексу маси тіла, лише у підгрупі хворих на ЦД 2 типу з нормальною вагою: у таких хворих значення КА зростало пропорційно збільшенню індексу маси тіла.
На підтвердження даних епідеміологічних досліджень про незалежний вплив гіперглікемії на ризик серцево-судинних катастроф у проведеній роботі виявлено кореляцію між рівнем глюкози крові натще та показниками атерогенних фракцій ліпідів (зокрема, ЗХС та ТГ). Указаний зв’язок в більшості випадків мав лінійний характер, збільшуючи ступінь атерогенності в міру збільшення глікемії. Незважаючи на відсутність розходжень у виразності діабетичної дисліпідемії за умов відносної та абсолютної інсулінової недостатності, у дослідженні виявлено суттєву залежність наявності в анамнезі судинних катастроф, а саме інфаркту міокарда, з наступним розвитком абсолютної інсулінової недостатності. Так хворі на ЦД 2 типу з розвинутою інсулінозалежністю більш ніж у чотири рази частіше, порівняно з хворими за умов відносної інсулінової недостатності (25,8 та 5,9% хворих відповідно, р=0,05), вказували на перенесений ними інфаркт міокарда. Це доводить украй важливе значення вивчення анамнезу пацієнтів, бо виявлення перенесених хворим гострих серцево-судинних станів свідчить на користь швидкого розвитку у нього абсолютної недостатності ендогенного інсуліну.
Стратегію подальшої терапії хворих на ЦД 2 типу багато в чому визначає рівень С-пептиду. При аналізі функціональних резервів підшлункової залози було виявлено зниження вмісту С-пептиду у хворих обох груп (0,43±0,06 нг/мл в І групі та 0,35±0,04 нг/мл у ІІ групі, р>0,05). Враховуючи відсутність достовірної різниці між середніми концентраціями С-пептиду у групах хворих з ефективною пероральною цукрознижуючою терапією та з інсулінотерапією, було проаналізовано стан компенсації вуглеводного обміну у пацієнтів обох груп. У хворих ІІ групи дана ситуація є закономірною, оскільки має місце абсолютна інсулінова недостатність. Виявлено, що, незважаючи на задовільні показники глікемії натще (6,3±0,24 ммоль/л), постпрандіальної (6,7±0,27 ммоль/л) та середньодобової глікемії (6,5±0,21 ммоль/л) у хворих І групи (тобто у хворих у стані ВІН), рівень глікозильованого гемоглобіну у них (7,7±0,26%) свідчить про відсутність компенсації вуглеводного обміну протягом попередніх трьох місяців. Останнє здатне викликати тимчасове зниження концентрації С-пептиду завдяки глюкозотоксичності. Для перевірки цього твердження 16 пацієнтам із низьким рівнем С-пептиду, випадково обраним із І групи, було призначено тимчасову інсулінотерапію (Рис. 2).
|
|
|
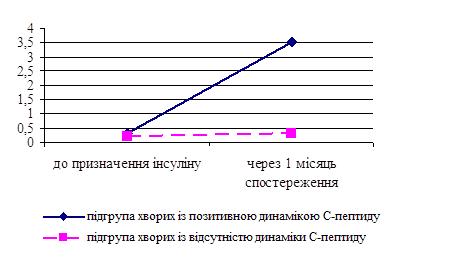
Рис. 2. Концентрація С-пептиду в динаміці спостереження у хворих І групи:
* - достовірність різниці між показниками в динаміці спостереження (р<0,001);
**- достовірність різниці між показниками в підгрупах хворих з позитивною динамікою та відсутністю динаміки С-пептиду через 1 місяць спостереження (р<0,001)
Після досягнення глікемічної компенсації через один місяць спостереження (глікемія натще (6,1±0,22) ммоль/л, постпрандіальна глікемія (6,5±0,25) ммоль/л, середньодобова глікемія (6,3±0,22) ммоль/л, добова аглюкозурія) концентрація С-пептиду у 13 хворих достовірно збільшилася (з 0,32±0,04 до (3,52±0,24) нг/мл, р<0,001) та сягала нормальних значень, в той час як у трьох хворих не спостерігалося динаміки С-пептиду (0,20±0,06 та (0,30±0,05) нг/мл, відповідно, р>0,05), що свідчить про абсолютну інсулінову недостатність. Вищеозначене дозволяє рекомендувати введення в клінічну практику методу тимчасової інсулінотерапії в якості тесту для диференціації станів відносного та абсолютного дефіциту інсуліну. Даний тест є інформативним у випадку виявлення зниженої концентрації С-пептиду на фоні декомпенсації вуглеводного обміну у хворих на ЦД 2 типу.
Попередні дослідження зарубіжних та вітчизняних учених стосувалися дерматогліфічних та молекулярно-генетичних маркерів, що визначають ступінь інсулінової недостатності за умов ЦД 2 типу. Водночас аналіз дерматогліфічного рисунку, на жаль, не здобув належного рівня поширеності, а молекулярно-генетичні дослідження є достатньо складними та багатовитратними, що обмежує їх застосування в рутинній медичній практиці. Серед простих методів, які можуть використовуватися будь-яким лікарем, на другому етапі дослідження було проведено аналіз родоводів хворих.
Структура спадкової обтяженості при ЦД 2 типу є типовою для захворювання з генетичним компонентом. Аналіз родоводів хворих на ЦД 2 типу показав, що частота виявлення хворих на дану патологію родичів в обстежених хворих вище, ніж поширеність захворювання в популяції, тобто має місце родинне накопичення ЦД 2 типу. Так відсоток уражених батьків серед родичів хворого в 5,5-9 разів вище, ніж у населенні в цілому (10,2% у І групі та 15,7% у ІІ групі, р<0,05). Родинне накопичення виявлено також у братів і сестер – 7,5% та 10,1% відповідно, що у 4–5,5 разів вище, ніж у популяції (р<0,05). Виявлено пряму залежність між розвитком абсолютної інсулінової недостатності у хворих на ЦД 2 типу та ступенем родинного накопичення цього захворювання у родичів першого та другого ступеня спорідненості: у хворих на ЦД 2 типу з абсолютною інсуліновою недостатністю у 4 рази була більшою кількість родичів другого ступеня спорідненості (дядьків та тіток), уражених на відповідну патологію, ніж у хворих на ЦД 2 типу з відносною інсуліновою недостатністю (р<0,001).
З метою визначення групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності було проведено аналіз, який довів наступне. Виявлення у пацієнта родичів, хворих на ЦД 2 типу, підвищує ймовірність швидкого розвитку в нього абсолютної інсулінової недостатності у 1,5 рази. При розподілі хворих за статтю виявлено більшу ймовірність розвитку інсулінозалежності у жінок, порівняно з чоловіками (1,6 та 1,1 разів відповідно).
Серед осіб, що виявилися спадково обтяженими, кількість хворих на ЦД родичів першого та другого ступеня спорідненості коливалася від 1 до 7 осіб. Враховуючи це, спадково обтяжених хворих також було розподілено на дві підгрупи, залежно від кількості хворих родичів. До 1 підгрупи ввійшли хворі, що мають одного ураженого родича першого чи другого ступеня, до другої підгрупи – ті, що мають 2 та більше хворих родичів (табл. 1). Хворі обох підгруп не відрізнялись за тривалістю ЦД, віком маніфестації захворювання, виразністю гіперглікемії при виявленні ЦД.
Таблиця 1
Характеристика спадково обтяжених хворих залежно від кількості уражених родичів
| Стадія еволюції ЦД 2 типу | Пробанди, що мають | |||
| одного родича, хворого на ЦД 2 типу (n=50) | двох та більше родичів, хворих на ЦД 2 типу (n=47) | |||
| абс | % | абс | % | |
| Відносна інсулінова недостатність | 15 | 30,0 | 3 | 7,3 |
| Абсолютна інсулінова недостатність | 35 | 70,0 | 38 | 92,7 |
Таким чином, у підгрупі хворих, які мають двох та більше уражених родичів, відносна кількість хворих з більш несприятливим перебігом захворювання (раннім формуванням абсолютної інсулінової недостатності) суттєво перевищувала таку у хворих, що мають одного ураженого родича (р<0,05). При аналізі отриманих даних визначено, що відносний ризик розвитку абсолютної інсулінової недостатності (RR) у випадку, якщо хворий має двох та більшу кількість уражених родичів першого та/або другого ступеня, порівняно з одним ураженим, становить 5,4 (для жінок RR дорівнює 4,6, для чоловіків - 12,0). При збільшенні кількості уражених родичів ризик розвитку інсулінової залежності збільшується.
Узагальнюючи вищенаведені дані, до групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності можна віднести хворих на ЦД 2 типу, які мають уражених родичів. Імовірність швидкого розвитку абсолютної інсулінової недостатності значно збільшується в осіб, які мають двох та більше родичів першого та/або другого ступеня спорідненості, хворих на ЦД 2 типу. У зв’язку з цим у повсякденну лікарняну практику вкрай необхідно впровадити збір генеалогічного анамнезу, який може проводитись як генетиком, так і лікарем-ендокринологом чи терапевтом.
На третьому етапі роботи з метою з’ясування особливостей накопичення генів, асоційованих з ЦД 1 типу, за умов ЦД 2 типу на різних стадіях еволюції захворювання проведено молекулярно-генетичне дослідження, результати якого свідчать про частоту алеля Т гену тирозинфосфатази (PTPN22) серед хворих на ЦД 2 типу на рівні такої у хворих на ЦД 1 типу (табл. 2).
Таблиця 2
Частоти генотипів та алелей гену PTPN22 серед хворих на цукровий діабет 1 та 2 типу і здорових мешканців міста Харкова
| Показник | Контроль*, n=242 | Хворі на ЦД 1 типу*, n=296 | Хворі на ЦД 2 типу, n=52 | Контроль - ЦД 1 типу | Контроль - ЦД 2 типу | ||||||
| абс. | % | абс. | % | абс. | % | р | RR | р | RR | ||
| Генотип | С/С | 176 | 72,73 | 187 | 63,18 | 27 | 51,92 | <0,05 | 1,00 | <0,05 | 1,00 |
| С/Т | 64 | 26,45 | 93 | 31,42 | 22 | 42,31 | >0,05 | 1,37 | <0,05 | 2,24 | |
| Т/Т | 2 | 0,82 | 16 | 5,40 | 3 | 5,77 | <0,05 | 7,53 | <0,05 | 9,78 | |
| Алель | С | 416 | 85,95 | 467 | 78,89 | 76 | 73,08 | <0,05 | - | <0,05 | - |
| Т | 68 | 14,05 | 125 | 21,11 | 28 | 26,92 | <0,05 | - | <0,05 | - | |
Примітка. * – цитовано за М. Федець
Теоретично це може викликати у пацієнтів з ЦД 2 типу – носіїв цієї мутації – розвиток аутоімунної агресії проти інсулінпродукуючих клітин підшлункової залози. Проте дослідженням ІСА аутоімунний компонент розвитку абсолютної інсулінової недостатності не був доведений.
Молекулярно-генетичні дослідження показали захисне значення алелю С щодо розвитку ЦД. Навпаки, алель Т є фактором більш високого ризику розвитку захворювання. Людина з будь-яким варіантом генотипу (С/С, С/Т, Т/Т) може бути здоровою або може захворіти на ЦД. Проте ймовірність останнього не є однаковою: в осіб з генотипом С/С вона є зниженою, з генотипом С/Т – підвищеною. Найбільш високу ймовірність захворіти на ЦД мають гомозиготи Т/Т. Так у проведеному дослідженні доведено, що особи з генотипом Т/Т мають майже у 10 разів більш високий ризик захворіти на ЦД 2 типу, ніж особи, що не мають в генотипі алелю Т (гомозиготи С/С) (р<0,001).
Таким чином, у хворих на ЦД 2 типу визначено достовірно підвищену частоту відповідного поліморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), порівняно зі здоровими особами (в 1,9 разів). Подібна частота алелей С та Т гену PTPN22 у хворих на ЦД 2 типу за умов відносної та абсолютної інсулінової недостатності у поєднанні з невеликою частотою виявлення та низьким титром ІСА засвідчує несуттєвий внесок аутоімунних механізмів у спонтанну еволюцію захворювання. Наявність алеля Т у хворих на ЦД 2 типу може свідчити про те, що він є маркером, за яким можна формувати групу ризику щодо розвитку цього захворювання серед осіб з метаболічним синдромом без порушення толерантності до глюкози (RR=9,78).
Опубліковані алгоритми лікування хворих на ЦД 2 типу (American Diabetes Association and the European Association for the Study of Diabetes, 2006), на жаль, не припинили дискусій щодо інсулінотерапії як медикаментозного лікування першої лінії при неефективності монотерапії метформіном на фоні зміни способу життя (Standl E. et al., 2008). Адже відомо, що рання інсулінотерапія дозволяє подовжити період залишкового функціонування панкреатичних β-клітин (Ryan E.A. et al., 2004; Ilkova H. et al., 1997). Проте упередженість хворих щодо призначення інсуліну не дає змоги лікарям використовувати комбіновану терапію на перших кроках лікування. Останнім викликана необхідність визначення групи хворих, для яких раннє призначення базальної інсулінотерапії є необхідним.
Проведеним дослідженням доведено наявність груп ризику щодо раннього розвитку абсолютної інсулінової недостатності. Хворим зі спадковою обтяженістю на ЦД 2 типу (тим, що мають двох та більше родичів першого та/або другого ступенів спорідненості, хворих на ЦД 2 типу) та пацієнтам, які мають в анамнезі серцево-судинні катастрофи, а саме, інфаркт міокарда, доцільно починати інсулінотерапію (спочатку в комбінації з пероральними цукрознижуючими препаратами) на етапі неефективного контролю вуглеводного обміну за допомогою зміни способу життя та монотерапії метформіном.
ВИСНОВКИ
1. У дисертації визначено фактори ризику раннього розвитку абсолютної інсулінової недостатності у хворих на цукровий діабет 2 типу, обґрунтовано призначення ранньої інсулінотерапії хворим групи ризику, запропоновано метод диференціації станів відносної та абсолютної інсулінової недостатності за наявності зниженої концентрації С-пептиду.
2. Доказано доцільність урахування наявності інфаркту міокарда в анамнезі як предиктора раннього розвитку абсолютної інсулінової недостатності у хворих на цукровий діабет 2 типу, незалежно від виразності діабетичної дисліпідемії.
3. Наявність сімейного накопичення цукрового діабету 2 типу визначає більший ризик розвитку у хворого абсолютної недостатності інсуліну (RR=1,5). До групи найвищого ризику належать пацієнти, які мають двох та більше родичів першого та/або другого ступенів спорідненості, хворих на цукровий діабет 2 типу (RR=5,4).
4. Установлено достовірно підвищену частоту поліморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), що відіграє роль в аутоімунному пошкодженні β-клітин підшлункової залози, у хворих на цукровий діабет 2 типу, порівняно зі здоровими особами (в 1,9 разів). Водночас подібна частота алеля Т гену PTPN22 у хворих на цукровий діабет 2 типу за умов відносної та абсолютної інсулінової недостатності в поєднанні з невеликою частотою виявлення антитіл до острівцевих клітин підшлункової залози та їх низьким титром свідчить про несуттєвий внесок аутоімунних механізмів в еволюцію захворювання.
5. Доведено обмежену інформативність помірної гіперглікемії на момент маніфестації цукрового діабету (в межах 7-11 ммоль/л) для визначення швидкості формування у хворого абсолютної інсулінової недостатності.
6. Визначено зниження концентрації С-пептиду у хворих на цукровий діабет 2 типу як за наявності абсолютної інсулінової недостатності, так і на стадії відносної інсулінової недостатності. Тимчасове призначення інсулінотерапії дозволяє за характером динаміки рівня С-пептиду диференціювати стани відносного та абсолютного дефіциту інсуліну для подальшого призначення адекватного лікування (комбінована пероральна або інсулінотерапія).
7. Для гальмування спонтанної еволюції захворювання обґрунтовано доцільність призначення інсулінотерапії на етапі неефективності лікування метформіном хворим із групи підвищеного ризику формування абсолютної інсулінової недостатності (за наявності двох та більше хворих на цукровий діабет 2 типу родичів та/або інфаркту міокарда в анамнезі).
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Для визначення групи підвищеного ризику щодо раннього розвитку абсолютної інсулінової недостатності з метою своєчасного призначення інсулінотерапії лікарям практичної охорони здоров’я рекомендується в разі встановлення діагнозу «цукровий діабет 2 типу» провести аналіз стану здоров’я родичів хворого (першого та другого ступеня спорідненості) на предмет наявності у них цукрового діабету.
2. У пацієнтів групи ризику (за наявності двох та більше хворих на цукровий діабет 2 типу родичів та/або інфаркту міокарда в анамнезі) у випадках неможливості досягнення компенсації цукрового діабету (рівень HbA1c ≥ 7%) шляхом модифікації способу життя та застосування метформіну необхідно додаткове призначення базальної інсулінотерапії.
3. Для вирішення питання про необхідність початку своєчасної інсулінотерапії (розвиток абсолютної інсулінової недостатності) хворим на цукровий діабет 2 типу у випадку встановлення концентрації С-пептиду < 0,5 нг/мл на фоні пероральної цукрознижуючої терапії показано тимчасове (1 місяць) призначення інсуліну для диференціації відносної та абсолютної інсулінової недостатності (відповідно, підвищення рівня С-пептиду та відсутність змін).
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Великих Н.Є. Аналіз впливу маси тіла на тривалість періоду відносної інсулінової недостатності у хворих на цукровий діабет 2 типу [Текст] / Н. Є. Великих // Проблеми ендокринної патології. – 2006. – № 4. – С. 10-14.
2. Великих Н. Е. Семейное накопление сахарного диабета и развитие абсолютной инсулиновой недостаточности у больных сахарным диабетом 2 типа [Текст] / Н.Е. Великих, С.А. Штандель, Ю.И. Караченцев // Ендокринологія. – 2006. – Т. 11, № 2. – С.169-174. (Дисертантом особисто здійснено аналіз родоводів хворих, статистичну обробку даних та оформлення у вигляді статті).
3. Великих Н.Є. Аналіз перебігу цукрового діабету 2 типу у хворих з відносною та абсолютною інсуліновою недостатністю за даними вивчення анамнезу [Текст] / Н.Є. Великих // Проблеми ендокринної патології. – 2007. – № 2. – С. 13-17.
4. Великих Н.Є. Дослідження антитіл до острівців Лангерганса та С-пептиду у хворих на цукровий діабет 2 типу за умов відносної та абсолютної інсулінової недостатності [Текст] / Н.Є. Великих, І.І. Алексеєва // Проблеми ендокринної патології. – 2008. – № 1. – С. 14-23. (Дисертантом особисто проведено клінічні дослідження, аналіз наявності антитіл до острівців Лангерганса у хворих на цукровий діабет 2 типу, аналіз концентрацій С-пептиду у хворих у процесі компенсації вуглеводного обміну, статистичну обробку даних та оформлення у вигляді статті).
5. Великих Н.Е. Оценка клинических маркеров развития абсолютной инсулиновой недостаточности у больных сахарным диабетом 2 типа [Текст] / Н.Е. Великих // Від фундаментальних досліджень до медичної практики: всеукраїнська науково – практична конференція молодих учених і спеціалістів, 16 листопада 2005 р.: матеріали. – Харків, 2005. – С. 23.
6. Тихонова Т. М. Гетерогенність інсулінозалежності в осіб старшої вікової групи зі встановленим діагнозом цукрового діабету 2 типу [Текст] / Т.М. Тихонова, Н.Є. Великих, С.П. Олійникова // Ендокринна патологія у віковому аспекті: матеріали наук.-практ. конф. з міжнарод. участю, Харків, 29-30 листопада 2007 р. – Харків, 2007. – С. 89-90. (Дисертантом особисто проведено клінічне обстеження хворих на цукровий діабет 2 типу з абсолютною інсуліновою недостатністю; статистичний аналіз та оформлення результатів у вигляді тез).
7. Великих Н.Є. Дослідження динаміки С-пептиду у хворих на цукровий діабет 2 типу в процесі компенсації вуглеводного обміну [Текст] / Н.Є. Великих, Ю.І. Караченцев, І.І. Алексеєва // Фундаментальна та клінічна ендокринологія: проблеми, здобутки, перспективи (Сьомі Данилевські читання): матеріали наук.-практ. конф. з міжнарод. участю, Харків, 21-22 лютого 2008 р. – Харків, 2008. – С. 34-35. (Дисертантом особисто досліджено динаміку С-пептиду в процесі компенсації вуглеводного обміну, проведено статистичний аналіз одержаних даних, оформлено результати у вигляді тез).
АНОТАЦІЯ
Великих Н.Є. Особливості розвитку абсолютної інсулінової недостатності у хворих на цукровий діабет 2 типу та обґрунтування диференційованої терапії. - Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.14 – ендокринологія. ДУ „Інститут проблем ендокринної патології ім. В.Я. Данилевського АМН України”, Харків, 2008.
Робота присвячена пошуку маркерів раннього розвитку абсолютної інсулінової недостатності за умов ЦД 2 типу для оптимізації лікування хворих групи ризику.
Клініко-анамнестичне та генеалогічне обстеження довело, що підвищений ризик раннього розвитку абсолютної інсулінової недостатності мають хворі, які перенесли інфаркт міокарда, та особи, які мають двох та більше родичів першого та/або другого ступеня спорідненості, хворих на ЦД 2 типу. Доведено асоціацію поліморфізму С→Т1858Т гену PTPN22 (тирозинфосфатази), що відіграє роль в аутоімунному пошкодженні β-клітин підшлункової залози, з ЦД 2 типу. Водночас визначено несуттєве значення аутоімунних механізмів у розвитку інсулінозалежності за умов ЦД 2 типу. Запропоновано використання тимчасової інсулінотерапії в якості тесту для диференціації відносного та абсолютного дефіциту інсуліну при виявленні зниженої концентрації С-пептиду. Обґрунтовано необхідність призначення інсулінотерапії на етапі неефективності лікування метформіном хворим групи підвищеного ризику раннього розвитку абсолютної інсулінової недостатності для гальмування спонтанної еволюції ЦД 2 типу.
Ключові слова: цукровий діабет 2 типу, відносна інсулінова недостатність, абсолютна інсулінова недостатність, спонтанна еволюція цукрового діабету, інсулінотерапія.
АННОТАЦИЯ
Великих Н.Е. Особенности развития абсолютной инсулиновой недостаточности у больных сахарным диабетом 2 типа и обоснование дифференцированной терапии. – Рукопись.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.01.14 – эндокринология. ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского Академии медицинских наук Украины», Харьков, 2008.
Работа посвящена поиску маркеров раннего развития абсолютной инсулиновой недостаточности при СД 2 типа для оптимизации лечения больных группы риска.
Больные сахарным диабетом (СД) с длительностью заболевания болем 10 лет были распределены на группы по принципу отсутствия (I группа) или наличия (II группа) инсулиновой зависимости. Клинико-анамнестическое обследование виявило, что наличие в анамнезе сердечно-сосудистых событий, в частности, инфаркта миокарда, повышает вероятность развития ранней абсолютной инсулиновой недостаточности у больных СД 2 типа при отсутствии различий в выраженности диабетической дислипидемии в условиях относительного и абсолютного дефицита инсулина. Уровень гликемии на момент манифестации СД в пределах 7-11 ммоль/л не определял скорость дальнейшего прогрессирования заболевания, что связано с невысокой степенью инсулиновой недостаточности при выявлении патологии.
У больных СД 2 типа выявлена повышенная частота полиморфизма С→Т1858Т гена PTPN22 (тирозинфосфатазы), который играет роль в аутоиммунном поражении β-клеток поджелудочной железы. Для определения участия аутоиммунных механизмов в формировании абсолютной инсулиновой недостаточности было проведено исследование наличия ІСА у больных СД 2 типа в зависимости от длительности эффективной пероральной сахароснижающей терапии (у больных I группы) и инсулинотерапии (у больных II группы). Выявлена небольшая частота и низкий титр указанных антител у больных обеих групп, что свидетельствует о несущественном значении аутоиммунных механизмов в эволюции СД 2 типа.
Влияние наследственности на скорость формирования абсолютной инсулиновой недостаточности показано при изучении родословных 205 больных СД 2 типа. Так среди пациентов выявлено семейное накопление случаев данного заболевания, то есть значительно большее количество больных СД родственников, чем распространенность патологии у населения в целом. При этом выявлено, что наличие у обследуемого пациента больных родственников первой и/или второй степени родства ускоряет развитие у него инсулиновой зависимости по сравнению с наследственно не отягощенными пациентами. Установлено, что вероятность раннего формирования абсолютной инсулиновой недостаточности зависит от количества больных родственников. Так показано, что пациенты, имеющие двух и более родственников, больных СД 2 типа, относятся к группе риска раннего развития абсолютной инсулиновой недостаточности.
При оценке эндогенной секреции инсулина выявлено снижение концентрации С-пептида у больных обеих групп. У пациентов II группы данное положение закономерно, так как имеет место абсолютная инсулиновая недостаточность. Одновременно с этим у пациентов I группы снижение концентрации С-пептида возможно было связать только с развитием феномена глюкозотоксичности вследствие предшествующего отсутствия компенсации СД. Для проверки этого предположения из I группы больных со сниженной концентрацией С-пептида случайным путем были отобраны 16 пациентов, которым была назначена временная инсулинотерапия в адекватных дозах и оценена динамика показателя спустя один месяц. У 13 больных отмечалось достоверное увеличение концентрации С-пептида, что свидетельствовало о восстановлении функции β-клеток поджелудочной железы на фоне устранения гипергликемии и, соответственно, глюкозотоксичности. У троих больных существенной динамики С-пептида не отмечалось, что свидетельствует об органической природе гипофункции инсулино-продуцирующего аппарата поджелудочной железы и формировании у них абсолютной инсулиновой недостаточности. Таким образом, назначение временной инсулинотерапии можно использовать для дифференциации состояний относительной и абсолютной инсулиновой недостаточности в случае выявления сниженной концентрации С-пептида в условиях отсутствия компенсации углеводного обмена.
На сегодняшний день остается открытым вопрос выбора конкретного направления в терапии СД 2 типа на этапе неэффективности изменения образа жизни и лечения метформином (назначение комбинированной терапии с использованием пероральних препаратов нескольких групп или включение в схему лечения инсулина). В исследовании обоснована необходимость назначения инсулинотерапии в качестве первого шага пациентам группы риска раннего развития абсолютной инсулиновой недостаточности, а именно: лицам, имеющим в анамнезе инфаркт миокарда, и лицам, имеющим двух и более родственников первой и/или второй степени родства, больных СД 2 типа.
Ключевые слова: сахарный диабет 2 типа, относительная инсулиновая недоста-точность, абсолютная инсулиновая недостаточность, спонтанная эволюция сахарного диабета, инсулинотерапия.
SUMMARY
Velykykh N.Y. Development features of absolute insulin insufficiency in patients with type 2 diabetes mellitus and background of the differentiated therapy. - Manuscript.
The dissertation on acquiring the scientific degree candidate of medical sciences on speciality 14.01.14 - endocrinology. SE „V. Danilevsky Institute for endocrine pathology problems of Academy of Medical Sciences of Ukraine”, Kharkiv, 2008.
The work is devoted to the search of markers of early absolute insulin insufficiency development in type 2 diabetes mellitus (DM) in order to optimize treatment of patients from the risk group.
Clinical-anamnesis and genealogical research proved that the high development risk of early absolute insulin insufficiency had the patients, who were exposed to the medium severity heart attacks, and patients who had two or more the first and/or second cognation degree relatives, that suffered from type 2 DM. It was proved the association of С→Т1858Т polymorphism of PTPN22 gene (of thyrosinphosphatase) which plays role in autoimmune damage of pancreatic β-cells with type 2 DM. At the same time it was determined the minor value of autoimmune mechanisms in insulin dependence development provided type 2 DM. In case of the reduced C-peptide concentration it was offered the use of temporal insulin therapy as test for differentiation of relative and absolute insulin deficiency. It was justified insulin administration necessity on the stage of lost effectiveness from metformin treatment in patients group with the boosted risk of early absolute insulin insufficiency development for braking of the spontaneous evolution type 2 DM.
Keywords: type 2 diabetes mellitus, relative insulin insufficiency, absolute insulin insufficiency, spontaneous evolution of diabetes mellitus, insulin therapy.
ПЕРЕЛІК УМОВНИХ СКОРОЧЕНЬ
ВООЗ- Всесвітня організація охорони здоров’я
ЗХС- загальний холестерин
КА- коефіцієнт атерогенності
ЛПВЩ- ліпопротеїди високої щільності
ЛПДНЩ- ліпопротеїди дуже низької щільності
ЛПНЩ- ліпопротеїди низької щільності
ОТ/ОС- обсяг талії/обсяг стегон
С- цитозин
Т- тимін
ТГ- тригліцериди
ЦД- цукровий діабет
ІСА- islet cell antibodies – антитіла до острівцевих клітин підшлункової залози
PTPN22- ген тирозин фосфатази
RR- показник відносного ризику
UKPDS- United Kingdom Prospective Diabetes Study
Похожие работы
... 2006 p.). – X.: Харків, 2006. – С. 11. Здобувач провів інформаційний пошук, написав тези, підготував їх до друку. АНОТАЦІЯ Можина Т. Л. Клініко-патогенетичне обґрунтування корекції шлункових дисритмій у хворих на цукровий діабет 2-го типу. – Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.02 – внутрішні хвороби. – Кримський державний медичний ...
... перебігу генералізованого пародонтиту, а високі цифри цих показників – формування симптомів прогресуючого перебігу захворювання. Розроблена концепція диференційованої комплексної терапії генералізованого пародонтиту при цукровому діабеті 2 типу, з застосуванням системного багатофакторного аналізу, може бути основою пріоритетного методологічного підходу до обґрунтування нових терапевтичних заходів ...
... і працівники. Дослідження проводилося в невеликих групах по 5 – 10 осіб, в 5 етапів. Кожна наступна методика проводилась в усіх групах з інтервалом у 5 днів. 3.2 Психологічні характерситики досліджених хворих соматичного профілю: гіпертонічнa хворобa, виразковa хворобa шлунку і 12-палої кишки, ішемічнa хворобa серця Андрій Сергійович. Чоловік 32 років із середньою фаховою освітою. Одружений ...
... ів як початкової ланки подальших дисгормональних, метаболічних, психовегетативних та судинних порушень при первинній відкритокутовій глаукомі зумовлює необхідність її корекції за допомогою використання селективних модуляторів естрогенових рецепторів. Під наглядом перебували 39 хворих на ПВКГ (64 ока), у комплексному лікуванні яких використовували один із препаратів групи селективних модуляторів ...
0 комментариев