Навигация
8. ЛЕЧЕНИЕ ОСТРОЙ АСТМЫ
Задача врача ОНП проста: быстрое улучшение функции дыхательных путей, предотвращение гипоксемии и предупреждение возникновения дыхательной недостаточности и наступления смерти. Кроме того, желательна быстрая идентификация тех больных, которые не ответят положительно на лечение в ОПН, а также больных, требующих госпитализации. Врач также не должен выписывать из ОНП тех больных, которые, по всей вероятности, вновь обратятся за неотложной помощью через несколько часов или дней. Как уже отмечалось, решение относительно дальнейшего лечения (в стационаре или амбулаторно) в большинстве случаев может быть принято уже после часового пребывания больного в ОНП.
Основной подход к лечению
Хотя многие общепринятые лечебные мероприятия имеют надежное обоснование с позиций физиологии системы органов дыхания, лишь некоторые из них прошли строгую оценку в хорошо контролируемых исследованиях с использованием двойного слепого метода. Тем не менее рациональный подход к лечению острой астмы может быть разработан на основе современных концепций патогенеза данного заболевания, принципов фармакотерапии и клинического опыта.
Всем больным с острой астмой следует немедленно дать кислород через носовую канюлю (скорость 2—3 л/мин). Такое эмпирическое лечение вполне оправдано, так как у большинства больных наблюдается та или иная степень гипоксемии, а потенциал для быстрого ухудшения состояния всегда очень велик. Более того, риск возникновения кислородиндуцированной респираторной депрессии у настоящего астматика незначителен. Адекватность подачи дополнительного кислорода определяется либо при анализе газов артериальной крови, либо (что предпочтительно) с помощью пульсовой оксиметрии.
Так как у больных, госпитализированных по поводу острой астмы, имеет место выраженная закупорка дыхательных путей слизистыми пробками, необходимо внутривенное введение жидкостей для разжижения и удаления густого секрета. Кроме того, обильная жидкостная терапия благоприятна для многих астматиков, находящихся в состоянии дегидратации вследствие чрезмерной потери воды при учащенном дыхании, а также в связи с ее ограниченным потреблением. Удалению густого секрета могут также помочь физиотерапевтические процедуры и приемы (перкуссия и постуральный дренаж). Поскольку такие процедуры могут быть трудновыполнимыми у тяжелых астматиков и способны иногда вызывать рефлекторный бронхоспазм, лучше избегать их проведения на начальном этапе лечения.
Таблица 6. Критерии госпитализации при острой астме1
1. Обращение за медицинской помощью в ОНП в предшествующие 3 дня
2. Отсутствие субъективного улучшения после лечения
3. Увеличение FEV, после лечения не более чем на 500 мл (или абсолютное значение < 1,6 л)
4. Увеличение PEFR после лечения не более чем на 15 % относительно исходной величины (или абсолютное значение < 200 л/мин)
5. Изменения ментального статуса (летаргия, возбуждение, крайнее изнеможение, спутанность сознания)
6. Сохранение гиперкарбии после лечения
7. Наличие пневмоторакса
Наличие любого из перечисленных состояний требует госпитализации.
При лечении острой астмы следует всегда избегать применения ряда препаратов. Седативные средства и транквилизаторы абсолютно противопоказаны независимо от того, каким бы нервным больной не казался; в результате такого лечения часто возникает остановка дыхания. Противопоказаны также отхаркивающие средства (ацетилцистеин), так как во время приступа астмы они могут спровоцировать усиление бронхоспазма. Следует избегать применения йодидов и глицерилгваяколата ввиду неопределенности их терапевтического эффекта. У больных с острой астмой не следует применять бета-адренергические блокаторы (даже селективные препараты) для лечения гипертензии, аритмий и ишемической болезни сердца. Многие астматики плохо реагируют на ультразвуковые аэрозоли и лечение с применением прерывистого положительного давления при искусственном дыхании. Гидратация может быть достигнута при использовании внутривенного пути, а медикаментозные препараты целесообразно вводить с помощью компрессорных аэрозолей.
р-Адренергические агонисты
Недавние исследования показали, что бета-адренергические агонисты предпочтительны для премедикации при лечении острого бронхоспазма, а также у стабильных амбулаторных больных. Эти препараты обеспечивают более быстрое улучшение легочной функции, чем парентеральное введение теофиллина. Добавление теофиллина к бета-адренергической терапии резервируется для более тяжелых случаев.
Описание
Бета-адренергические рецепторы делятся на два типа: бета-1 и бета-2. Стимуляция бета-1-рецепторов в сердце увеличивает частоту и силу его сокращений, в то время как подвижность и тонус тонкого кишечника снижаются. Стимуляция бета-2-адренергических рецепторов способствует расширению бронхов (в дыхательных путях), вазодилатации (в кровеносных сосудах), релаксации матки и тремору скелетной мускулатуры.
Механизм бронходилататорного действия бета-адренергических препаратов включает стимуляцию фермента аденилциклазы, которая превращает внутриклеточный аденозинтрифосфат (АТФ) в циклический аденозинмонофосфат (цАМФ). Этот процесс способствует связыванию внутриклеточного кальция с мембранами клеток, уменьшая концентрацию миоплазматиче-ского кальция, в результате чего происходит релаксация гладкой мускулатуры бронхов. Помимо расширения бронхов, бета-адренергические препараты (БАП) тормозят высвобождение медиаторов и усиливают мукоцилиарный клиренс.
Эффективность тахифилаксии при использовании БАП часто возрастает. Считается, что если данный эффект наблюдается у больных астмой, то вряд ли он имеет клиническое значение. Указанные препараты метаболизируются с помощью моноаминоксидазы (МАО) и катехол-О-метилтрансферазы (КОМТ) до неактивных соединений. В кишечнике БАП инактивируются также с помощью сульфатаз.
Наиболее часто встречающимся побочным эффектом БАП является тремор скелетных мышц. Могут также наблюдаться нервозность, беспокойство, бессонница, головная боль, учащенное сердцебиение, тахикардия, гипергликемия и гипертензия. Несмотря на ранее существовавшее мнение о потенциальной кардиотоксичности БАП, особенно при их комбинации с теофиллином, значительных клинических осложнений при их использовании не отмечается. Аритмии и признаки ишемии миокарда редки, особенно у больных без указаний на ИБС в анамнезе.
Аэрозольное введение
Аэрозольная терапия бета-адренергическими препаратами вызывает расширение верхних бронхов и оказывает более благоприятное действие, чем пероральное или парентеральное введение этих препаратов. При аэрозольном введении относительно небольшая доза препарата оказывает местное действие с минимальной системной абсорбцией и гораздо меньшими побочными эффектами. Оптимальное наложение на слизистую оболочку и удерживание капелек аэрозоля должной величины (1— 5 мк в диаметре), содержащих бронходилататор, усиливается благодаря замедленной скорости воздушного потока при вдохе с последующей продолжительной (10 секунд и более) задержкой дыхания. Аэрозольная терапия может осуществляться с помощью дозированного ингалятора, компрессорного распылителя или прибора IPPB. Лечение с помощью этого устройства не имеет особых преимуществ перед компрессорным распылителем и может оказывать раздражающее действие у некоторых астматиков. Если у стабильных больных распылитель и ингалятор одинаково эффективны, то при острой астме компрессорный распылитель имеет определенные преимущества, так как дозированный ингалятор оказывается менее эффективным при частом и неглубоком дыхании и больному нелегко скоординировать действие ингалятора с моментом вдоха. Прокладочное приспособление к ингалятору может улучшить поступление препарата в бронхи, если больной не справляется с методом использования ингалятора. Но даже при оптимальной технике в легких удерживается не более 15 % дозы лекарственного препарата независимо от используемого аэрозольного метода терапии.
Р2-Адренергические препараты
Р2-Адренергические агонисты, применяемые в настоящее время, являются аналогом естественных симпатомиметиков. Идеальный бронходилататор этого класса соединений обладает чистой бета-2-рецепторной активностью (расширение бронхов без влияния на сердце). Использовавшиеся раньше катехол-аминовые бронходилататоры (изопротеренол и эпинефрин) не обладают бета-2-специфичностью и имеют короткий период действия. Изоэтарин является более бета-2-селективным, однако длительность его действия также невелика. Эти препараты практически вытеснены новыми химическими соединениями, созданными на основе химической модификации исходных соединений. В настоящее время существует два класса новых р-адренергических препаратов, обладающих большей бета-2-специфичностью (относительно, не абсолютной) и большей продолжительностью действия (благодаря резистентности к МАО и КОМТ); они эффективны и при пероральном применении (что обусловлено их резистентностью к сульфатазам кишечника). К ним относятся резерциноловые бронходилататоры (метапротеренол, тербуталин и фенотерол) и салигениновые бронходилататоры (албутерол и карбутерол). Битолтерол представляет более новую концепцию в бета-адренергической терапии. Этот предшественник лекарственного препарата остается неактивным, пока не гидролизуется эстеразами, превращаясь в активный бета-2-специфический катехоламин колтерол. Поскольку концентрация необходимых эстераз в легких выше, чем в сердце, препарат сохраняет свою бета-2-селективностъ. В настоящее время в продаже имеется битолтерол в виде дозированного ингалятора.
В табл. 7 перечислены оправдавшие себя БАП бронхорасширяющего действия для неотложного лечения. Тербуталин, альбутерол и битолтерол не выпускаются в растворах для использования в компрессорных распылителях, хотя дозированные ингаляторы с этими препаратами вполне доступны. Фенотерол и карбутерол не выпускаются. Хотя подкожные инъекции эпинефрина (адреналина) и тербуталина широко используются в ОНП, этот метод лечения в настоящее время не считается достаточно эффективным; кроме того, он связан с многочисленными системными побочными эффектами. Парентерального введения БАП следует избегать у больных старше 40 лет. Не следует также применять продолжительное внутривенное введение изопротеренола.
Таблица 7. р-Адренергические бронходилататоры, применяемые при острой астме
| Доза | Продолжитель- | Дозированные | |
| ность действия | интервалы | ||
| Подкожное введение1 | |||
| Эпинефрин | 0,3 мг | 4 ч | 20 мин х 3 |
| Тербуталин сульфат | 0,25 мг | 4-6 ч | 20 мин х 3 |
| Аэрозольное введение | |||
| Изоэтарин мезилат | 2,5-5,0 мг | 3-4 ч | Зч |
| Метапротеренол сульфат | 10-15 мг | 3-5 ч | Зч |
1 Не является предпочтительным методом введения; его использование следует ограничить у детей и подростков. Избегать применения этого метода у больных старше 40 лет, а также у лиц с гипертензией или ИБС в анамнезе.
Теофиллин
До недавнего времени внутривенное введение теофиллина было первоочередным мероприятием у больных с острой астмой. Но такой подход был изменен после проведения исследований, показавших, что при острой астме теофиллин расширяет бронхи в меньшей степени, чем БАП. Более того, теофиллин в комбинации с ингалируемыми БАП, по-видимому, повышает токсичность, но не эффективность лечения. Хотя его эффективность остается противоречивой, ясно, что при острой астме лучше всего начинать лечение с распыляемых бета-2-адренергических препаратов. Это не означает, что теофиллин следует изъять из схемы лечения. Действительно, поскольку многим астматикам требуется госпитализация с проведением комбинированной медикаментозной терапии, включение в схему теофиллина вполне рационально. Теоретически это объясняется более продолжительным бронхорасширяюшим эффектом с распространением последнего на мелкие дыхательные пути, что особенно важно в тех случаях, когда слизистые пробки препятствуют проникновению распыляемого препарата; кроме того, теофиллин повышает физическую выносливость дыхательных мышц.
Фармакология
В течение многих лет бронхорасширяющее действие теофиллина рассматривалось как следствие ингибирования фосфодиэстеразы (что предупреждает деградацию циклического АМФ). Однако более углубленные исследования показали, что это не так; механизм действия теофиллина остается неизвестным. Основной метаболизм теофиллина происходит в печени (90 %) с помощью двух различных оксидаз. Остатки теофиллина в неизмененном виде выделяются почками. Теофиллин оказывает многообразное положительное влияние на легочную физиологию. Четко установлена пропорциональная сывороточной концентрации препарата бронходилатация. Кроме того, теофиллин увеличивает сократимость и мышечную выносливость диафрагмы (а возможно, и других дыхательных мышц), повышая тем самым механическую эффективность, в результате чего мышечное утомление наступает в более отдаленные сроки. К другим эффектам теофиллина относятся стимуляция мукоцилиарного клиренса, повышение активности дыхательного центра, ингибирование высвобождения медиаторов, увеличение сократимости миокарда, усиление желудочной секреции и увеличение диуреза.
В то же время достаточно хорошо описана токсичность теофиллина. Наиболее часто наблюдаемым побочным эффектом является раздражение желудочно-кишечного тракта (тошнота, боли в желудке, диарея). Нередки также головная боль, общая Нервозность, бессонница и синусовая тахикардия. Более серьезные побочные эффекты, такие как спутанность сознания, перевозбуждение, судорожные припадки и аритмии, встречаются относительно редко при концентрации теофиллина в сыворотке крови более 40 мкг/мл. Симптоматическая интоксикация теофиллином при сывороточной концентрации препарата более 40 мкг/мл лечат перорально назначаемым древесным углем (30 г каждые 2 часа в четыре приема). В отдельных случаях приходится прибегать к гемоперфузии через древесный уголь.
Концентрация теофиллина в крови
Как и благоприятный эффект бронходилатации, побочные эффекты теофиллина связаны с его сывороточной концентрацией. Ввиду высокой вариабельности метаболизма теофиллина (печеночный клиренс) зависимость дозы препарата от его уровня в сыворотке крови непредсказуема. Осторожный врач всегда тщательно контролирует концентрацию теофиллина в крови, пока не наступит стабильное улучшение состояния больного и не выявятся какие-либо симптомы, предполагающие изменение терапии. Теофиллин имеет узкий терапевтический диапазон; его терапевтическая концентрация в сыворотке составляет 10—20 мкг/мл. У некоторых больных улучшение может наблюдаться при уровне ниже 10 мкг/мл. Токсичность теофиллина возрастает при его концентрации выше 20 мкг/мл, но становится заметной уже при более низких концентрациях, иногда ниже терапевтического уровня. В острых ситуациях наиболее безопасным подходом является поддержание концентрации препарата в диапазоне от 10 до 15 мкг/мл.
Многие факторы изменяют метаболизм теофиллина, воздействуя на печеночные оксидазы. Снижение клиренса теофиллина (повышение его концентрации в крови) ассоциируется с заболеванием печени, застойной сердечной недостаточностью, легочным сердцем, вирусной респираторной инфекцией с высокой температурой тела, а также со старческим возрастом и применением циметидина, эритромицина, пероральных контрацептивов и аллопуринола. Наоборот, увеличение клиренса теофиллина (снижение его концентрации в крови) отмечается при курении сигарет, приеме фенобарбитала и фенитоина, при значительном потреблении жаренного на углях мяса и усиленном выделении из организма факторов, снижающих клиренс препарата.
Дозировка теофиллина
Углубленное изучение фармакокинетики теофиллина позволило разработать рациональные рекомендации по его дозировке. Поскольку положительные эффекты препарата прямо связаны с его концентрацией в крови, желательно поддержание постоянной терапевтической концентрации у больного. Это требует применения ударной дозы теофиллина (для установления его уровня в крови) с немедленной последующей инфузией. Разумеется, правильное использование теофиллина требует от врача осведомленности в отношении предшествующего введения препаратов, а также клинической оценки факторов, способных изменить метаболизм теофиллина.
Кортикостероиды
Кортикостероиды высокоэффективны при астме; они составляют основу лечения тяжелых астматических приступов. Хотя механизм их действия остается неизвестным, предполагается, что стероиды оказывают благоприятное действие, восстанавливая чувствительность к бета-адренергетикам и уменьшая воспаление. Общепринято считать, что их действие после внутривенного введения начинается не ранее чем через 6—8 часов. Однако, как показывают недавние исследования, улучшение состояния больного может наступить уже через час после введения кортикостероидов, возможно, в результате улучшения чувствительности к бета-адренергетикам. В отношении использования кортикостероидов остается немало противоречий. Нижеследующие рекомендации отражают один из подходов к лечению астмы этими препаратами.
Кортикостероиды должны быть немедленно применены в ОНП у всех астматиков, которые в настоящее время принимают (или недавно принимали) эти препараты. Они также назначаются больным, обнаруживающим какой-либо из угрожающих признаков тяжелой астмы (см. табл. 5), а также больным, у которых не наблюдается объективного улучшения легочной функции (см. табл. 6) после начального аэрозольного лечения бронходилататорами. Хотя существуют значительные разногласия в отношении оптимальной дозы кортикостероидов (с колебаниями от 100 до 4000 мг гидрокортизона в качестве эквивалента в первые 24 часа), разумным и эффективным представляется начальное введение внутривенного болюса метилпреднизолона (от 60 до 80 мг). После болюса больному дают 15—20 мг препарата каждые 6 ч до восстановления функции дыхательных путей до уровня, близкого к исходному. Последующее уменьшение количества назначаемого перорально препарата до одной утренней дозы зависит от состояния больного и его истории заболевания. Поскольку кортикостороидные аэрозоли могут оказывать раздражающее действие при приступе астмы, их применения следует избегать.
Антихолинергические препараты
Растения, содержащие антихолинергические алкалоиды, использовались для курения сотни, если не тысячи, лет с целью лечения респираторных расстройств. В последние годы антихолинергетики были вновь открыты как сильные бронходилататоры, применяемые у больных с астмой и другими формами обструктивного заболевания легких. Хотя в сравнительных исследованиях бронхорасширяющей способности антихолинергетиков и бета-адренергических агонистов были получены противоречивые результаты, оказалось, что комбинированное применение этих препаратов дает дополнительный положительный эффект. Повидимому, это действительно так, ведь места действия обоих препаратов различны: антихолинергетики действуют на крупные, центральные бронхи, а бета-адренергетики — на более мелкие.
Антихолинергетики конкурентно вытесняют ацетилхолин на уровне постганглионарных парасимпатических соединений эффекторных клеток. Этот процесс эффективно блокирует брон-хоконстрикцию, вызванную вагусной (холинергически опосредованной) иннервацией в крупных и центральных бронхах. Кроме того, концентрация циклического АМФ в гладкой мускулатуре бронхов уменьшается, еще больше способствуя расширению бронхов.
Более ранние предположения о потенциальных побочных эффектах антихолинергетиков, таких как образование слизистых пробок и системная интоксикация, не были признаны клинически значимыми, вероятно, вследствие использования аэрозольного пути введения и в связи с тенденцией к применению небольших доз. Потенциальные побочные эффекты аэрозольных антихолинергетиков включают сухость во рту (наиболее часто), жажду, затруднения при глотании. Реже наблюдаются тахикардия, изменение ментального статуса (беспокойство, раздражительность, спутанность сознания), затруднения при мочеиспускании, илеус или неясное зрение.
Основным аэрозольным антихолинергическим препаратом в США является сульфат атропина. К сожалению, это далеко не идеальный препарат ввиду возможного возникновения значительной системной абсорбции. Однако более новые синтетические дериваты атропина, такие как ипратропиум бромид, атропин метонитрат и гликопирролатметилбромид, оказались более сильными и длительно действующими; к тому же они вызывают меньше системных побочных эффектов.
Доза ингалируемого сульфата атропина (от 0,4 до 2,0 мг; максимум 0,025 мг/кг), по-видимому, обладает максимальным эффектом при минимальной токсичности. Сульфат атропина и метапротеренол могут ингалироваться вместе. Начало действия более медленное, чем у бета-адренергических препаратов; пик эффективности во многих случаях не наблюдается в течение 60—90 мин. Продолжительность действия — в пределах 4 часов.
Другие медикаменты
При лечении острой астмы приемлемо эмпирическое применение одного из антибиотиков широкого спектра действия, так как во многих случаях наблюдается вторичный бактериальный бронхит. При остром астматическом приступе следует избегать использования двунатрияхромогликата и ингаляционных кортикостероидов, так как они имеют минимальный терапевтический эффект и способны вызвать еще большее раздражение дыхательных путей. Антигистамины неблагоприятны при астме.
Блокаторы кальциевых каналов могут ингибировать кальцийзависимые реакции, которые способствуют сокращению мускулатуры бронхов, секреции слизи, высвобождению медиаторов и проводимости нервных импульсов. Как было показано, эти препараты предотвращают бронхоспазм в ответ на физическую нагрузку, а также на гипервентиляцию, вдыхание холодного воздуха, введение гистамина и различных дополнительных антигенов. Хотя профилактическое действие блокаторов кальциевых каналов было показано, эти препараты не доказали своей значимости и надежности как бронходилататоры. В настоящее время они не играют никакой роли в лечении приступа астмы.
Искусственная вентиляция
Если все усилия, направленные на устранение тяжелой обструкции воздушного потока, оказываются тщетными, а у больного прогрессируют гиперкарбия и ацидоз, и он либо впадает в прострацию, либо обнаруживает спутанность сознания, то для предотвращения остановки дыхания необходимо проведение интубации и искусственной вентиляции. Механическая вентиляция не ликвидирует обструкции, она просто исключает работу дыхания и дает возможность больному отдохнуть, пока не разрешится обструкция. К счастью, лишь небольшой процент астматиков (менее 1 %) нуждается в искусственной вентиляции. Прямая оральная интубация предпочтительнее назотрахеальной.
Потенциальные осложнения механической вентиляции у больных с астмой многочисленны. Повышенная сопротивляемость дыхательных путей может обусловить крайне высокий пик давления в них (потенциально создавая частую перегрузку вентилятора), возникновение баротравмы и гемодинамических нарушений. Вследствие тяжести обструкции на ранних этапах лечения объем вдыхаемого воздуха может быть больше выдыхаемого объема, в результате чего воздух задерживается в легких и возрастает остаточный объем. Этого можно частично избежать, используя большие скорости потока воздуха при уменьшенной частоте дыхания (12—14 дыханий в минуту), что обеспечивает адекватное время для экспираторной фазы. Часто возникают слизистые пробки в бронхах, что приводит к повышению сопротивляемости дыхательных путей, образованию ателектазов и появлению легочной инфекции. И, наконец, присутствие эндотрахеальной трубки может усилить у некоторых астматиков чувство удушья, что обусловливает дальнейшее увеличение бронхоспазма.
ЛИТЕРАТУРА
1. «Неотложная медицинская помощь», под ред. Дж. Э. Тинтиналли, Рл. Кроума, Э. Руиза, Перевод с английского д-ра мед. наук В.И.Кандрора, д. м. н. М.В.Неверовой, д-ра мед. наук А.В.Сучкова, к. м. н. А.В.Низового, Ю.Л.Амченкова; под ред. Д.м.н. В.Т. Ивашкина, Д.М.Н. П.Г. Брюсова; Москва «Медицина» 2001
2. Внутренние болезни Елисеев, 1999 год
3. Диагностика и лечение болезней органов дыхания Милькаманович 1997 год
Похожие работы
... условно можно разделить на специфические, применяемые при аллергической астме, и неспецифические, применяемые при всех формах бронхиальной астмы. Последние включают в себя медикаментозную терапию, физиотерапию, курортное лечение, лечебную физкультуру, психотерапию и иглорефлексотерапию. Специфические методы лечения применяют аллергологи, исходя из результатов аллергологического обследования ...
... форм этого заболевания и дало практике весьма действенные методы лечения. Русские клиницисты М. В. Черноруцкий, М. П. Кончаловский, Н. Д. Стражеско и др. уделяли много внимания аллергическому механизму бронхиальной астмы. Большое значение они придавали различным аллергенам неинфекционного и инфекционного происхождения в качестве этиологических факторов различных форм этого заболевания. Большое ...
... , особенно если в программе медицинской помощи планируется парентеральное введение лекарственных и диагностических средств. ГЛОССАРИЙ терминов, использованных в тексте "Аллергия и аллергические заболевания". Агранулоцитоз - резкое снижение количества гранулоцитов, прежде всего, нейтрофилов в периферической крови. Чаще встречается миелотоксический (прием цитостатиков) ...
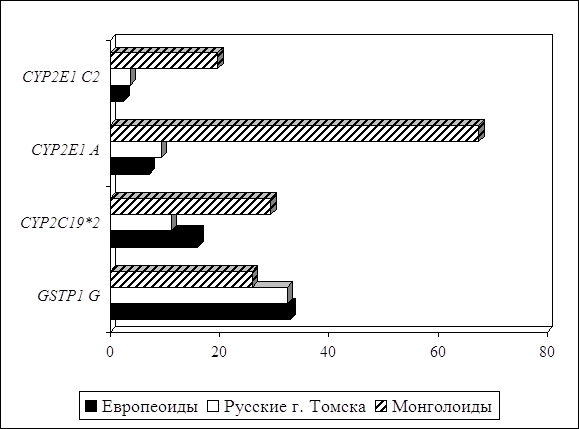
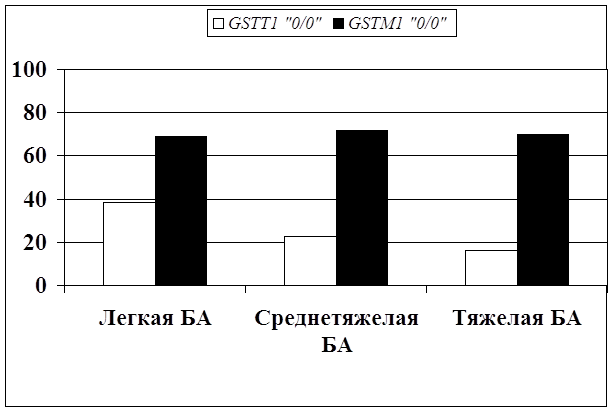
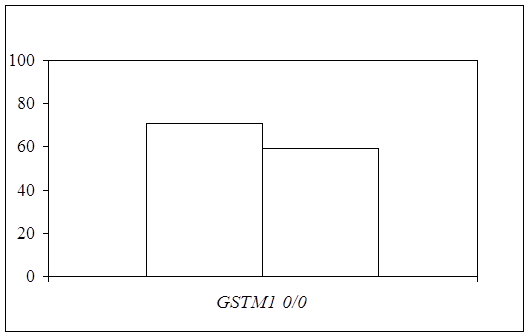
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
0 комментариев