Навигация
Н 7,4 г ЭДТА-Na растворить в 900 мл воды, довести рН до 8 IM NaOH и затем добавить воды до 1 л
Выделение антител методом иммуносорбции. Специфичность сыворотки проверяется в реакциях с используемым для иммунизации препаратом антигена и с набором близких ему по структуре химических соединений. В случае недостаточна очищенного антигена возможны неспецифические реакции, обусловленные наличием антител к применяемым антигенам. Перекрестные реакции с другими соединениями могут наблюдаться при наличии у них химических структур, близких к структуре антигенных детерминант иммуногена.
Удаление неспецифических антител из антисыворотки обычно осуществляют с помощью метода адсорбции на соответствующем неспецифическом антигене. Адсорбция неспецифических антител в реакции преципитации с растворимой фракцией путем центрифугирования может привести к появлению в антисыворотке или растворимых комплексов At-Ar, или избытка добавленного Ar, присутствие которых влияет на способность антисыворотки реагировать со сцецифическим антигеном в ИФА. Наиболее удобно для адсорбции антисыворотки использовать антиген, иммобилизованный на твердой фазе. Добавляя такой иммуносорбент в антисыворотку или пропуская антисыворотку через колонку с иммуносорбентом, можно быстро освободиться от перекрестно реагирующих антител.
Метод аффинной хроматографии на иммуносорбентах используется для получения препаратов очищенных антител. Наиболее широкое распространение лолучили иммуносорбенты на основе CNBr-активированной сефарозы. Выпускаемая в нашей стране CNBr-активированная агароза по своим основным параметрам не уступает зарубежному аналогу.
Основные операции, используемые для получения иммобилизованных на CNBr-агарозе антигенов или антител, приведены в табл.5.1.
Следует отметить, что при работе с иммуносорбентами на основе CNBr-активированной сефарозы нельзя использовать буфер, содержащий аминогруппы.
Получение фрагментов антител. При разработке некоторых модификаций ИФА может возникнуть необходимость использования конъюгатов фермента не с целой молекулой иммуноглобулина, а с тем ее фрагментом, который специфически связывается с молекулой антигена - Fab-фрагментом. Обусловлено это прежде всего тем, что Fc-фрагмент молекулы, ответственный за эффекторные функции иммуноглобулина, обладает способностью неспецифически взаимодействовать с другими белками, сорбированными на носителях при проведении твердофазного ИФА. Эффект неспецифической сорбции определяется природой антигена, концентрацией сорбированного на носителе белка и рядом других факторов.
Таблица 5.1. Ковалентное связывание с CNBr-активированной сефарозой
| Операция | Условия |
| 1" Взвесить требуемое количество CNBr-активирован ион сефарозы 2. Промыть на стеклянном фильтре и дать набухать гелю 3. Растворить в буфере белок 4. Смешать белковый раствор с суспензией геля 5. Блокировка оставшихся активных групп 6. Отмывка от несвязавшегося антигена | 1 г высушенного препарата дает около 4,5 мл геля Использовать для промывки раствор 1 мМ HCl, а затем для уравновешивания и набухания - боратный или гидрокарбонатный буфер Использовать гидрокарбонатный или обратный буфер Гидрокарбонатный буфер: 0,1 M NaHCO3, содержащий 0,5 NaCl Раствор должен содержать 5-10 мг антигена Два часа при комнатной температуре или ночь при +4 °С Гель промывается буфером, содержащим блокирующие соединения. Используются IM этаиоламин или 0,2 M глицин, рН 8,0 Используется буфер, в котором осуществлялось ковалентное связывание, затем 0,1 M ацетатный буфер, рН 4, содержащий 0,5 M NaCl, после, чего гель опять уравновешивается боратным или гидрокарбонатным буфером |
Получение Fab-фрагментов.
1. Готовят раствор, содержащий 0,1-3 мг Р2-фрагмента в 0,45 мл 0,1 M Na-фосфатиом буфере, рН 6,0. ·
2. Добавляют 0,05 мл 0,1 M 2-меркаптоэтанола в том же буфере, содержащем 5 мЛ\ ЭДТА.
3. Смесь инкубируют при 37 0C в течение 1,5 ч.
4. Тестирование антисывороток.
Антисыворотки, полученные даже от одного животного, значительно различаются по своей способности связывать антиген. Для сравнительной характеристики и оценки качества антисывороток проводят их тестирование, которое позволяет решить следующие две важные задачи: во-первых, произвести отбор именно тех сывороток, которые по своим свойствам удовлетворяют требованиям иммунохимического анализа, во-вторых, осуществить стандартизацию антисывороток при их промышленном производстве для иммуноферментных наборов.
Первичный отбор антисывороток проводят на основании нахождения их титра, который представляет собой интегральный параметр, характеризующий взаимодействие с антигеном. Более детальные сведения о сыворотке получают, определяя аффинность и концентрацию антител. Следующий этап - это установление антигенной специфичности антител, т.е. возможности взаимодействовать со структурно сходными антигенами.
Принципиальное различие этих этапов заключается в следующем: при определении титра исследуют связывание выбранной концентрации антигена при различных разведениях аитисыворотки. При определении аффинности и концентрации антител исследуют связывание антисыворотки с различными концентрациями меченого антигена. При изучении специфичности антисывороток в соответствующем разведении и при постоянной концентрации меченого антигена добавляют различные концентрации перекрестно реагирующего антигена.
Во всех случаях используют концентрации антигена либо близкие к минимально детектируемым в данном виде анализа, либо в том диапазоне, который соответствует их концентрации в Образце.
Определение титра аитисыворотки. Титр - это эффективная величина, характеризующая связывающую способность антител, зависящая от их концентрации и аффинности. Абсолютное значение титра также зависит от метода и условий проведения эксперимента и от начальной концентрации свободного антигена.
Количественно титр находят как предельное разведение сыворотки, при котором еще наблюдается положительный регистраруемый данным методом эффект взаимодействия антисыворотки с антигеном. Например, если титр устанавливают методом преципитации свободного антигена в геле и для первой сыворотки образование преципитата наблюдается при разведении в 2т раза, а для другой - в 2" раз, фп титр первой сыворотки равен 2т, а второй - 2", причем вторая антисыворотка менее активная, чем первая. Иногда оперируют понятием "50% -ный титр", подразумевая под этим, соответственно, разведение сыворотки, вызывающее 50% -ное связывание антигена. "Рабочим титром" называют то начальное разведение сыворотки, которое используют непосредственно в эксперименте.
Таблица 5.2. Схема тестирования сывороток
| Этап исследования | Условия | Цель |
| Титр Аффинность Специфичность | - постоянна - варьирует постоянна варьирует постоянна - постоянна варьирует | Отбор высокоактивных иммунных аитисывороток, определение конечного и рабочего титра Оценка аффинности и концентрации фракции высокоаффиниых антител Определение специфичности антител |
Титр антисыворотки сильно зависит от концентрации антигена, используемого для тестирования и от способа его определения. Например, одна и та же сыворотка может иметь титр 100 в тесте иммунопреципитации и 100 000 в тесте иммуноферментного анализа. Поэтому при тестировании сыворотки и определении титра лучше всего применять тот же метод, что и при анализе, а концентрацию антигена выбирать близкую к минимальной в том диапазоне, который выбран для анализа. Кроме того, следует учитывать, что в иммуноферментном анализе используют как гомогенные, так и гетерогенные методы определения концентрации антигена, которые могут сильно отличаться по структуре образующихся иммунных комплексов. В частности, в твердофазных методах вероятность образования циклических комплексов антиген - антитело значительно меньше, чем в гомогенных, а следовательно, и наблюдаемая аффинность антител в обеих системах будет разная.
При разработке методов ИФА обычно пользуются значением титра антисыворотки, определенным в непрямом методе, в котором на стенках лунок микроллаты первоначально сорбируют антиген и затем изучают связывание с ним иммунной сыворотки в последовательных разведениях. Связывание исследуемых антител с иммобилизованным антигеном регистрируют с помощью антивидового конъюгата к иммуноглобулиновой фракции сыворотки животного, используемого для иммунизации.
Результаты в этом случае обычно оценивают с помощью понятия "50% -ный титр". На рис. приведены кривые титрования антисывороток к инсулину, полученных иммунизацией морских свинок. Максимальный сигнал, регистрируемый по оптической плотности А продукта реакции окисления перекисью водорода 5-аминосалициловой кислоты, составляет ~1,4 оптических единиц. За титр сыворотки принимается ' такое разведение, при котором оптическая плотность, регистрируемая в ИФА, имеет значение, близкое к 0,7.
Обычно такой подход используется в качестве 1-го этапа оценки качества полученных иммунных сывороток и позволяет отобрать высокоактивные иммунные сыворотки. Однако для более глубокой оценки полученных антител проводят определение их аффинности. При разработке методов ИФА ряда антигенов, присутствующих в биологических жидкостях в низких концентрациях порядка Ю-10-IO11M, должны быть использованы антисыворотки, имеющие не только высокий титр, но и достаточное содержание антител, обладающих высокой константой связывания.
Аффинность антител. В основном в таких экспериментах применяются иммобилизованные антитела и антигены, меченные радиоактивной меткой.
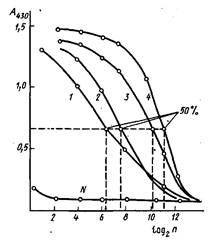
Титрование антисывороток к инсулину методом непрямого твердофазного ИФА: по оси абсцисс - разведение разбавленной в 100 раз сыворотки, по оси ординат - оптическая плотность при 430 им продукта пероксидазного окисления 5-аминосалициловой кислоты перекисью водорода. В качестве контроля - использована сыворотка крови неиммунизированного животного.
При использовании ферментных меток химическая структура меченого антигена может существенно отличаться от немеченого. В этих случаях полученные значения констант связывания характеризуют, как правило, взаимодействие в данной конкретной системе, вследствие - чего иммунная сыворотка, обладающая высокой аффинностью в реакции с конъюгатом одной структуры, может иметь значительно более низкие значения константы связывания с конъюгатом, полученным другим способом.
Если исследователь имеет дело с разработкой конкурентных методов ИФА, т.е. располагает набором иммунных сывороток и конъюгатом антиген-фермент, то важным этапом создания тест-системы является выбор пары антитело - конъюгат, характеризующейся Необходимой константой взаимодействия. Для проведения скрининга у-глобулиновую фракцию каждой антисыворотки иммобилизуют на поверхности микропланшета и изучают ее связывание с имеющимся набором конъюгатов. Эффективное значение связи является величиной, обратной значению концентрации конъюгата, при которой связывается 50% активных центров на носителе.
На рис. приведены кривые связывания иммобилизованных на полистироле антител к инсулину с конъюгатом инсулин - пероксидаза. Исследуемые сыворотки различаются по значениям эффективных констант равновесия. Для количественного определения инсулина могут быть использованы антисыворотка и конъюгат, эффективная константа связывания которых ~109 M-1. Для других тест-систем допустимое значение Кзф будет определяться требованиями, предъявляемыми к чувствительности и точности разрабатываемого метода.
Описанная процедура скрининга иммунных сывороток, как отмечалось выше, применима при наличии конъюгата антиген – фер.
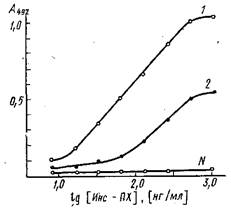
Связывание конъюгата инсулин - пероксидаза с адсорбированными на полистирольном планшете антителами против инсулина, выделенными из разных сывороток: по оси ординат - оптическая плотность А при 490 нм продукта пероксидазной реакции окислення о-фенилендиамина перекисью водорода. Константы связывания антител из сывороток / и 2 равны Ю'о н 109 соответственно; N-контрольная нормальная сыворотка.
Получение такого конъюгата для широкого круга антигенов представляется непростой задачей. Более универсальным реагентом являются антитела, меченные ферментом, поэтому остановимся на более общем подходе к определению аффинности антител в сыворотке или асците, основанном на твердофазном ИФА. Этот метод, предложенный Б. Фриге, позволяет определять константу связывания антител с антигеном при их взаимодействии в растворе.
Постановка метода включает две основных стадии:
1) проведение реакции антиген - антитело в растворе;
2) определение концентрации антител после установления равновесия с помощью метода твердофазного ИФА. Схема реакции в растворе в общем случае имеет вид
![]()
Обозначим равновесную концентрацию связанных антител как Bp, а концентрацию свободного антигена как Fj,, тогда можно записать следующее выражение:
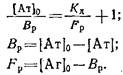
Если концентрации антител 0 и определять методом непрямого твердофазного ИФА, то при определенных условиях проведения эксперимента. будет выполняться соотношение / о=Л/Л0, где А и A0 - значения оптических плотностей, регистрируемых в ИФА, соответствующие концентрациям антител и о. Уравнение Клотца при этом условии может быть приведено к виду
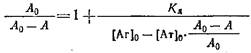
Таким образом, для определения Кл описанным выше методом необходимо знание начальной концентрации антител о. Однако практически нахождение Кл проводится в иммунных сыворотках, или асцитах, где точная концентрация антител |Ат] о неизвестна. Если проводить реакцию комплексообразоваиия в избытке антигена, то количество связавшегося антигена незначительно по сравнению с исходным и его концентрация после установления в системе равновесия будет близка к исходной ф е.0 да. Fp. Если эксперимент проводится так, что выполняется условие о > 10 о, то
![]()
полученные радиоактивной меткой.
Если представить экспериментальные данные в координатах A0/-=-1/0> то по тангенсу угла наклона прямой можно рассчитать Кд.
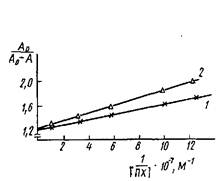
Определение константы диссоциации комплекса пероксидаза - антитела к пероксидазе в координатах Клотца: кривые 1 я 2 соответствуют значениям Cd1,1 ·10-9 и 2.2 ·10-9 M.
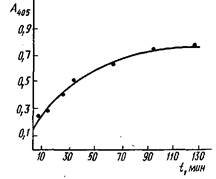
Кинетика связывания моноклональных антител с инсулином, адсорбированным иа полистирольном планшете для ИФА из раствора концентрации 1 мкг/мл. Комплекс инсулин - антитело выявлен меченными пероксидазой антимышинными IgG:
Таким образом, для практического осуществления' описанного метода необходимо, прежде всего, установить наличие линейной зависимости между концентрацией определяемых непрямым методом ИФА антител и регистрируемым значением оптической плотности. Для этого готовят серии разведений исследуемой иммунной сыворотки и изучают их связывание в непрямом методе ИФА. Обычно эти зависимости имеют, вид кривых с насыщением. Для проведения эксперимента выбираются разведения антисыворотки, лежащие в линейном диапазоне кривой. Для установления равновесной константы диссоциации комплекса Ar·At концентрацию антигена варьируют в диапазоне от 10-6 до 10-8 М. На рис. приведен график для определения Кл комплекса ПХ-Ат. Однако вычисленные этим методом значения констант диссоциации комплекса At •Ar являются эффективными, поскольку при выборе уравнения не учитывается влияние взаимодействия антител с антигеном, сорбированным на твердой фазе, на равновесие в растворе.
Экспериментально контроль влияния иммобилизованного антигена на равновесие в реакции Ar-At в растворе осуществляется сравнением сигналов, полученных на стадии твердофазного ИФА в двух соседних рядах лунок. Для этого содержимое лунок одного ряда переносится во второй свободный, обработанный аналогично первому, после чего сравнивают значения сигналов. Если наблюдаемые различия не превышают 10%, то можно полагать, что влияние иммобилизованного антигена на равновесия Ar-At в растворе незначительно.
Более точная оценка общего случая с учетом влияния иммобилизованного антигена может быть дана в рамках модели связывания лиганда с несколькими независимыми центрами связывания:
Если К* - константа связывания антител с иммобилизованным центром связывания, а,· - концентрация различных субпопуляций антител, связывающихся с иммобилизованным антигеном, то нетрудно показать, что в этом случае окончательное выражение уравнение Клотца будет иметь вид
![]()
Обозначим![]() как С. Параметр С для реакций ряда антигенов был найден экспериментально, значение его не превышает 2-2,5. При этом оценка С получена в предположении, что реакция антител с иммобилизованным антигеном достигает равновесия. Кинетика этого процесса представлена на рис., из которого видно, что время установления равновесия значительно больше используемого в эксперименте при определении константы. Поэтому полученное значение С является максимальным и максимальная ошибка, которая допускается при определении Ku, составляет 200-250%.
как С. Параметр С для реакций ряда антигенов был найден экспериментально, значение его не превышает 2-2,5. При этом оценка С получена в предположении, что реакция антител с иммобилизованным антигеном достигает равновесия. Кинетика этого процесса представлена на рис., из которого видно, что время установления равновесия значительно больше используемого в эксперименте при определении константы. Поэтому полученное значение С является максимальным и максимальная ошибка, которая допускается при определении Ku, составляет 200-250%.
Метод может быть использован для вычисления констант связывания как поликлональных, так и моноклональных антител.
Похожие работы
... количествах антитела только одного вида — моноклональные антитела. Подчеркнем, что моноклональные антитела гомогенны как по специфичности, так и по физико-химическим свойствам. Вопросы, связанные с получением поликлональных и моноклоиальных а 2. Структура и специфичность антигенов Понятие антигенная детерминанта включает в себя последовательность образующих ее химических функциональных групп ...
... . Гипервоспалительная реакция организма может вместе с микробными токсинами привести к повреждению клеток нарушению перфузии и в итоге к шоку полиорганнои недостаточности и смерти. Терапия сепсиса, от антибиоза к иммунной модуляции Концептуальная смена патофизиологического понимания септического синдрома находит свое отражение также в изменении терапевтического подхода, который теперь, помимо ...
... ; 6) диагностика простудных заболеваний и гриппа; 7) обнаружение рака молочной железы и матки; 8) диагностика сердечнососудистых заболевании. 3. Технические требования Идеальная аналитическая система для анализа на дому должна 1) быть простой и легкой в использовании; 2) включать как можно меньше стадий; 3) не требовать точного дозирования проб и реагентов; 4) ...
... анализ антигенов и антител с помощью меченых реагентов Методы этой категории отличаются очень высокой чувствительностью и экономичностью в расходовании реагентов. Наиболее распространенный из всех иммунологических методов — это, вероятно, иммуносорбентный анализ антител с применением лигандов, меченных радиоизотопами или ферментами; он позволяет исследовать большое число образцов в относительно ...

0 комментариев