Навигация
Стадия. Выделение госсипола в виде госсиполацетата
1 Стадия. Выделение госсипола в виде госсиполацетата.
Госсиполацетат - молекулярной комплекс состава C30H30O8* CH3COOH, легко гидролизуемое горячей водой.
Грубоизмельченную воздушно-сухую кору корней хлопчатника перколируют при пониженной температуре 1 л эфира, свободного от перекисей. Эфирный экстракт концентрируют при небольшом разрежении до объема 40-50 мл, добавляют 15 мл ледяной уксусной кислоты, хорошо перемешивают и, не закрывая колбы, оставляют в холодильнике для кристаллизации. При медленном испарении эфира выпадает госсиполацетат. Первую порцию зеленовато-желтых кристаллов отфильтровывают на стеклянном фильтре и промывают 10 мл смеси эфира и уксусной кислоты в соотношении 3:1.
Фильтрат и промывную смесь объединяют и оставляют в стакане при комнатной температуре, пока не испарится половина объема. В это время выпадает вторая половина госсиполацетата. Соединив вместе полученные осадки, их растворяют в 50 мл эфира, добавляют 5 мл уксусной кислоты и оставляют на сутки. Выпадает чистый госсиполацетат в количестве 3 гр.
2 Стадия. Получение свободного госсипола.
На холоду растворяют 3 г госсиполацетата в 50 мл эфира, свободного от перекисей, и переносят в коническую колбу, содержащую равный объем 0.4%-ного водного раствора дитионита натрия (неверно называемый гидросульфитом натрия).
Эфир отгоняют при температуре бани около 60°C под умеренным вакуумом. По мере испарения эфира на поверхности воды выделяется свободных госсипол в виде корочки. Для полноты гидролиза госсиполацетата эту операцию повторяют еще раз, т.е. отфильтрованный осадок снова растворяют в эфире, добавляют равный объем воды, эфир отгоняют. Полученный таким образом госсипол высушивают на воздухе. Получают 2 гр.
Для очистки всю порцию госсипола растворяют в 25 мл эфира и добавляют петролейный эфир до помутнения раствора. Раствор оставляют на кристаллизацию. Кристаллический госсипол - канареечно-желтый порошок, хранят в пробирке из темного стекла. Получают чистого госсипола 1-1.2 г, имеющего т. пл. 180-181°C.
5.4. ПОЛУЧЕНИЕ ЛЕЙКОЦИТАРНОГО АЛЬФА-ИНТЕРФЕРОНА
Способность лейкоцитов человека продуцировать интерферон была показана вскоре после открытия системы интерферона Айзексом /Франция/.
Методика заключается в следующем.
Из периферической крови доноров выделяют лейкоцитарную массу и подвергают культивированию в суспензии. Используют среду №1, в которую добавляют 0,0015 ед/мл инсулина и 100-200 ед/мл нативного интерферона. К лейкоцитам в концентрации (5-10)*106клеток/мл в качестве индуктора добавляют вирус болезни Ньюкасла с инфекционным титром не ниже 108/мл ТЦД50 в культуре куриных фиброластов. Продуцированный интерферон отделяют от культуральной среды путем центрифугирования.
ПОЛУЧЕНИЕ БЕТА -ИНТЕРФЕРОНА
Еще в 60-е годы было показано, что интерферон, провоцируемый клетками амниона человека, а также кожно-мышечными фибробластами, по своим свойствам отличается от лекоцитарного интерферона. В настоящее время для получения бета-интерферона используют диплоидные клетки человека. Супериндукцию осуществляют различными воздействиями - дихлоро-1-бета-D-рибафуранозилбенэимидазолом, хлороквином, нейтральным красным, УФ~радиацией и др.
ПОЛУЧЕНИЕ ГАММА-ИНТЕРФЕРОНА
Гамма-интерферон является продуктом Т-лимфоцитов человека. За последнее десятилетие благодаря усиленному изучению иммунного ответа и свойств иммуннокомпетентных клеток значительно расширились представления о функциях Т-лифоцитов, а также о продуктах, выделяемых Т-лимфоцитами - лимфокинах, обладающих свойствами биорегуляторов.
Гамма-интерферон, или иммунный интерферон, также является одним из активных регуляторов иммунного ответа, так как обладает супрессорной активностью в отношении продукции антител, вызывает активацию естественных киллеров.
Гамма -интерферон продуцируют активированные Т-лимфоциты.
Для получения больших количеств гамма-интерферона из периферической крови выделяют Т-лимфоциты и обрабатывают митогеном или антилимфоцитарной сывороткой. Например, к культуре с концентрацией лимфоцитов (I-2)*105 в 1 мл прибавляют стафилококковый энтеротоксин в концентрации 0,02 мкг/мл.
Культуры инкубируют в среде с человеческим альбумином. Интерферон выделяют из культуральной среды. Возможно повторное стимулирование культуры и повторное продуцирование интерферона.
ЧЕЛОВЕЧЕСКИЙ ЛЕЙКОЦИТАРНЫЙ ИНТЕРФЕРОН
Характеристика готового продукта,
Человеческий лейкоцитарный интерферон является видоспецифическим гликопротеидом, синтезируемым донорскими лейкоцитами в ответ на воздействие интерфероногена.
Специфичность препарата определяется следующими признаками:
А) противовирусной активностью. В разведении, соответствующем титру активности, препарат должен защищать культуру человеческих клеток от цитопатического действия индикаторного вируса, взятого в дозе 100 ТЦД50
Б) устойчивостью активности к действию нуклеаз-РНК-азы и ДНК-азы;
В) чувствительностью активности к действию трипсина - при концентрации фермента 300 мкг/мл в течение I часа при 37°С препарат полностью инактивируется;
Г) чувствительностью активности к действию специфической антисыворотки - антиинтерфероновая сыворотка в разведении, соответствующем титру должна снижать защитное действие интерферона, взятого я количестве 10 ед, в реакции нейтрализации.
Основные требования к препарату.
Препарат должен быть вирусологически стерильным, нетоксичным и безвредным.
В разведении, соответствующем титру активности, препарат должен защищать культуру человеческих клеток от цитопатического действия индикаторного вируса.
Сухой препарат - пористый порошок серовато-коричневого цвета, легко растворимый в 2 мл дистиллированной воды. Остаточная влажность не должна превышать 2%,
Раствор препарата должен иметь различные оттенки красного цвета и желтоватый оттенок.
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ПРЕПАРАТА
Кровь заготавливают на станциях переливания крови в соответствии с действующими инструкциями, в стерильные многокамерные мешки или флаконы, заполненные консервирующим раствором.
Пластикатные мешки центрифугируют 4 мин при 4°С и из них выжимают последовательно - плазму, а затем 40 мл верхнего слоя с поверхности клеточной фракции (эритромасса) или 40 мл верхнего слоя клеточной фракции (лейкомасса), которые используют в дальнейшем в качестве источника лейкоцитов для биосинтеза препарата.
Образец крови, плазмы, эритромассы или лейкомассы от каждого донора, должен контролироваться на отсутствие инфицирования сифилисом, гепатитом, СПИДом в соответствии с действующими инструкциями. При отрицательных результатах контроля эритромасса и лейкомасса могут использоваться для производства интерферона не позднее, чем спустя сутки после забора крови от донора. Хранение их допускается при температуре не выше 4°С.
Плазма или сыворотка донорской крови входят в состав культуральной смеси на всех стациях биосинтеза интерферона.
Культивирование и контроль проиизводственных штаммов вирусов, получение культур куриных и человеческих фибробластов.
В производстве интерферона в качестве интерфероногена используется вакцинный штамм "Н" вируса болезни Ньюкасла. Это представитель группы парамиксовирусов, для которых характерна сферическая форма вирусов, и спиральная структура нуклеокапсида. Вирус легко репродуцируется в куриных эмбрионах и культуре куриных фибробластов, оказывая цитоплазтическое действие. Вирус неопасен для человека, однако может вызвать воспалительные явления при случайном попадании массивной дозы в глаз.
Индикаторным вирусом служит штамм "Индиана" вируса везикулярного стоматита.
Это представитель группы рабдовирусов, также имеющих спиральную структуру нуклеокапсул, но инфекционный вирион по форме напоминает пулю. Вирус хорошо репродуцируется в куриных эмбрионах, а также в культурах куриных и человеческих фибробластов, оказывая цитопатическое действие.
Необходимо соблюдать осторожность при работе с этим вирусом.
Методы культивирования вирусов
Вирус болезни Ньюкасла культивируют в 9-10-дневных куриных эмбрионах. Эмбрионы просматривают через овоскоп, павшие отбраковываются, а у жизнеспособных карандашом обводятся границы воздушной полости.
При исходном титре вируса 108-109 ТЦД50/мл заражающая доза составляет 0,2 мл разведения 10-4 . Эта доза вводится в эмбрион шприцем через воздушную полость с соблюдением условий стерильности. Место прокола в скорлупе заливается парафином и эмбрионы инкубируются 2-е суток при 37°С.
После инкубации эмбрионы охлаждают при 4°С в течение 3-4 часов, затем в строго стерильных условиях вскрывают со стороны воздушной полости и визуально оценивают их жизнеспособность. Павшие - отбраковывают, а из остальных пастеровской пипеткой (с помощью вакуума или груши) отсасывают алантоисную жидкость, которая и служит в дальнейшем источником вируса.
Вируссодержащую аллантоисную жидкость контролируют на бактериологическую стерильность. Определяют инфекционный титр в культуре куриных фибробластов и титр гемагглютининов.
Контроль на стерильность. осуществляют высевом I мл аллантоисной жидкости из каждого флакона на питательные cpeды - сахарный бульон и среду Сабуро. Посевы инкубируют в течение 7 суток, на сахарном бульоне при 37°С, а на среде Сабуро - при комнатной температуре.
Инфекционный титр определяют в культуре фибробластов. В 3-х суточную культуру со сформировавшимся монослоем клеток вводятся различные разведения (от 10-7 до 10-10) алантоисной жидкости. Культуры инкубируют 3-е суток при 37°С и затем просматривают под микроскопом.
Максимальные разведения, оказывающие в культуре цитопатическое действие, принимаются за ТЦД вируса (титр цитопатического действия).
_Титр гемагглютининов определяется стандартным методом постановки реакции гемагллютинации с использованием куриных эритроцитов (0,5%).
Титр гемагглютининов не является ведущей характеристикой вирусов и постановка реакции гемагглютинации не является обязательной для каждой партии вируса.
В производстве допускается использование только бактериологически стерильного вируса с инфекционным титром 10-8-10-9/1 мл ТЦЦ50 и титром гемагглютининов 250 - 1000.
Вирус болезни Ньюкасла представляет большую ценность для производства, поэтому должны быть приняты меры к тому, чтобы сохранить его чистоту и интерфероногенные свойства. Категорически запрещается непрерывное использование пассирование вируса: в качестве исходного материала при заражении используют лучшую партию вируса, которую после контроля разливают по I мл в ампулы и лиофилизируют.
После лиофилизации эта партия в дальнейшем считается рабочим стандартом вируса.
Рабочий стандарт вируса контролируют описанными методами на бактериологическую стерильность, инфекционный титр и титр гемагглютининов. Затем в обязательном порядке вирус идентифицируют.
Идентификацию вируса болезни Ньюкасла проводят постановкой стандартной реакции торможения гемагглютинации с антисывороткой. Антисыворотка в разведении, соответствующем титру, но не ниже, чем 1:1000, должна полностью подавлять агглютинацию куриных эритроцитов /0,5%/ при дозе вируса, равной 4АЕ.
Получение первично-трипсинизированных, культур кожно-мншечной ткани куриных и человеческих эмбрионов.
Культуры кожно-мьшечной ткани куриных и человеческих эмбрионов широко используют в производстве интерферона для контроля вирусов, а также для определения отсутствия токсичности и противовирусной активности препарата. Успешная работа производства в значительной степени зависит от уровня ведения культур клеток.
Для получения культур клеток применяют стандартные методы, основанные на дезинтеграции ткани эмбриона трипсином. При выращивании культур следует обратить самое серьезное внимание на качество сред, сыворотки, вспомогательных растворов и чистоту посуды.
Получение культуры куриных фибробластов
Источником ткани являются 9-10-дневные куриные эмбрионы с соблюдением условий строгой стерильности эмбрион извлекают из скорлупы на стерильную чашку Петри. Отбирается кожно-мышечная ткань, переносится в колбу Эрленмейера и промывается раствором Хенкса с антибиотиками (50 ед/мл пенициллина + 100 ед/мл стрептомицина или 20 ед/мл мономицииа). Промывные воды сливают и ткань измельчают, размеры кусочков 1-5 мм. Затем ткань заливают подогретым до 37°С раствором трипсина (0,2%), разведенным раствором Хенкса (1:1). Колбу с тканью помещают на магнитную мешалку, включают вращение. Через 5 мин. вращение прекращают и после оседания кусочков ткани надосадочную жидкость сливают с соблюдением условий строгой стерильности. В колбу вновь заливают подогретую до 37°С смесь растворов трипсина и Хенкса. Суспензию перемешивают 5-7 мин. Затем вращение останавливают и после оседания крупных кусочков ткани надосадочную жидкость переливают в стерильные центрифужные стаканы с пробкой. Суспензий центрифугируют при 1250 об/мин, в течение 10 мин. Надосадочную жидкость отбрасывают, а осадок клеток суспендируют в культуральной жидкости следующего состава: среда №199 - 30%, гидролизат лактальбумина - 50%, нормальная бычья сыворотка - 20% и антибиотики.
Такую операцию трипсинизации повторяют 4-6 раз, но клетки собирают в один флакон с культуральной жидкостью.
После окончания сбора суспензию тщательно перемешивают и клетки подсчитывают в счетной камере Горяева. Суспензию разводят культуральной жидкостью до такой степени, чтобы в I мл содержалось 650 000 –750 000 клеток. Затем суспензию разливают в стерильные пробирки по I мл и инкубируют при 37°С в течение 2-3 суток, до образования монослоя клеток.
Технологический процесс изготовления лейкоцитарного интерферона подразделяют на 7 стадий и 12 операций,
Стадия 1- Выделение лейкоцитов.
Биосинтез интерферона проводят с использованием лейкоцитов, освобожденных от примеси эритроцитов. В тех случаях, когда примесь эритроцитов превышает 100 клеток на I лейкоцит, например, в эритромассе для их отделения необходимо применить фракционирование с последующим гемолизом лейкоцитсодержащей фракций. Если содержание эритроцитов меньше 100 клеток на I лейкоцит, ограничиваются только гемолизом.
Операция.1. Фракционирование.
В стерильные стеклянные колбы - отстойники грушевидной формы с герметично закрывающимися верхним и нижним отводами, емкостью не ниже 5 л заливают 2 л стабилизирующего раствора следующего состава: апирогенная дистиллированная вода - I л, глюкоза фармацевтическая - 20 г, аскорбиновая кислота - 0,25 г, хлористый кальций - 5 г, цитрат натрия трехзамещенный - 15 г. Стабилизирующий раствор при 20°С должен иметь плотность 1,05 г/мл. Раствор стерилизуется автоклавированием или фильтрацией и может храниться продолжительное время при температуре 4°С. Однако, концентрированный раствор цитрата натрия целесообразно автоклавировать отдельно и вводить непосредственно в отстойник.
В отстойник со стабилизирующим раствором вводят равный (2л) объем клеточной фракции. Суспензию тщательно перемешивают и добавляют раствор осадителя эритроцитов в количестве 1/10 от суммарного объема суспензии (около 400 мл).
В качестве осадителей используют декстран фармацевтический с молекулярной массой не ниже 80 000 Дальтон (исходный раствор 100г/л), поливиниловый спирт фармацевтический (исходный раствор 50 г/л или смесь 1:1 по объему). Растворы осадителей стерилизуют автоклавированием или фильтрацией и могут храниться продолжительное время при температуре +4°С,
Под действие осадителей происходит агрегация эритроцитов, что ускоряет их выпадение из суспензии, В результате происходит расслоение суспензии на 2 фракции - темно-окрашенную нижнюю (фракция эритроцитов) и светлую верхнюю (фракция лейкоцитов). Через нижний отвод отстойника фракцию эритроцитов сливают. Затем сливают и фракцию лейкоцитов. Клетки отделяют центрифугированием. Надосадочную жидкость отбрасывают, а осадок клеток ресуспедируют в питательной среде с конечной концентрацией 0,5% этилендиаминотетрауксусной кислоты (ЭДТА).
Операция 2. Гемолиз остаточных эритроцитов.
Для гемолиза используют 0,83%-ный раствор хлористого аммония в апирогенной дистиллированной воде, охлажденной до 4°С. Раствор стерилизируют автоклавированием. Клеточную суспензию заливают не менее чем 10 объемами гемолитика, выдерживают в течение 10 мин при 4°С, в затем клетки отделяют центрифугированием (600*Д, 10 мин, 4°С).
Надосадочную жидкость сливают и не используют на последующих стадиях. Осадок клеток суспендируют в питательной среде 199 или минимальной "игла", содержащей 3 ед/мл гепарина, 5% донорской плазмы или сыворотки, 0,1 трилона Б и 5 ед/мл мономицина, среда № I.
Операция 3. Подсчет жизнеспособных лейкоцитов.
Для определения количества жизнеспособных клеток используют 1%-ный водный раствор эозината натрия. Эозинатом, окрашиваются в красный цвет только погибшие клетки.
Отбирают 0,5 мл тщательно перемененной суспензии и объединяют ее с 0,5 мл раствора эозината. Выдерживают смесь 30 сек при комнатной температуре и разводят физраствором в 100 раз. Разведение вводят в счетную камеру Горяева и считают количество окрашенных и неокрашенных клеток под микроскопом с увеличением 100 во всей камере, количество жизнеспособных клеток (X) определяют по формуле:
X = А х 200 х 1100, где
А - количество неокрашенных клеток в камере.
Количество нежизнеспособных (окрашенных клеток) не должно превышать 3% от общего числа клеток в суспензии.
Стадия 2. Стимуляция интерфероногенеза - прайминг.
На этой стадии преследуют 2 основных цели; активизировать метаболизм лейкоцита (для этого в культуральную среду вводят нативную плазму и инсулин) и стимулировать интерфероногенез действием интерферона. При правильной постановке прайминг обеспечивает повышение выхода активности не менее, чем в 4 раза.
Операция 4. Составление культуральной среды.
Лейкоциты, освобожденные от примеси эритроцитов, суспендируют из расчета 10-20 млн клеток в I мл среды №1, в которую добавлены 0,0015 ед/мл инсулина и 100-200 ед/мл нативного интерферона. Суспензию переливают в плоскодонные колбы емкостью 5 л, заполняя только половину объема. В колбу помещают стержень из мягкого железа с некоррозирующим покрытием, который предварительно стерилизуют автоклавированием или прожиганием в пламени горелки.
Операция 5. Суспензионное культивирование.
Колбы с клеточной взвесью перекрывают стерильной алюминиевой фольгой и помещают в водяную баню из магнитно-проводящего материала (пластика любого типа или оргстекла), подключенную к ультратермостату. Ультратермостат должен обеспечивать устойчивое поддержания температуры в клеточной взвеси в пределах 37,5°С. Под баней помешают магнитные мешалки, вращение которых передается стержню в культуральной колбе. При скорости вращения 100 об/мин лейкоциты не травмируются, но устойчиво поддерживаются в суспензии.
Клетки инкубируют не менее 2-х часов (биологическое время). Если возникает необходимость, продолжительность прайминга можно увеличить до 12- часов. Однако в этом случат в культуральную среду необходимо добавить 0,005 М сукцината натрия.
Стадия 3. Индукция интерферона.
Для индукции используют бактериологический стерильный вирус болезни Ньюкасла с инфекционным титром не ниже 108/мл ТЦД50 в культуре куриных фибробластов. Вирус предварительно подогревают по 37,5°С.
Операция 6. Введение вируса-интерфероногена.
Культуральные колбы вскрывают под пламенем горелки и вирусосодержащую аллантоисную жидкость переливают в суспензию из расчета 10-100 ТЦД50 на I лейкоцит. Так, при содержании лейкоцитов 25 млрд. добавляют 250 млн вируса с интерфероногеным титром 109 ТЦД50. Колбу перекрывают алюминиевой фольгой с соблюдением условий стерильности и инкубируют в течение I часа при 37,5°С.
Стадия 4. Отделение индуцированных лейкоцитов.
На стадии индукции завершают подготовительные этапы интерфероногенеза.
Для улучшения переносимости препарата, после индукции необходимо удаление культуральной жидкости неадсорбировавшихся частиц вируса-индуктора и антигенов куриной аллантоисной жидкости. Для этих целей оказалось целесообразным отделение индуцированных лейкоцитов и переведение их в среду нового состава.
Операция 7. Отделение индуцированных лейкоцитов.
Суспензию индуцированных лейкоцитов центрифугируют при 600хД 15 мин 4°С, или сепарируют в условиях стерильности. Надосадочную жидкость отбирают в отдельную емкость для обеззараживания, а осадок клеток суспендируют в питательной среде следующего состава: среда № 199 или минимальная "Игла", 3 ед/мг гепарина, 5% плазмы или сыворотки донорской крови, мономицин 50 ед/мл, рН 7,2-7,4 /среда №2/.
Стадия 5. Биосинтез
Биосинтез интерферона проводят в стационарной культуре лейкоцитов. При этом происходит весьма прочное прикрепление лейкоцитов к поверхности культурного сосуда. Оказалось, что важнейшим параметром, определявшим выход активности, при стационарном культивировании является плотность посадки, то есть количество клеток на единицу поверхности. Экспериментально установлено, что оптимальным для интерфероногенеза является плотность в 5-7 млн лейкоцитов на I см поверхности. Показательно, что при такой плотности посадки лейкоциты создают пласт толщиной в 3 клетки. Хорошему прикреплению клеток способствует нанесение на внутренние поверхности культурального сосуда гидрофобного покрытия - силикона любой марки.
Для обеспечения питательной потребности культуры совершенно достаточно 0,1 л среды №2 на I млн лейкоцитов. Основой энергетического обмена для лейкоцитов является анаэробный гликолиз. Из-за дефектности ферментных систем начальных стадий цикла Кребса, окисление глюкозы в этих клетках завершается на стадии лактата и лишь небольшое количество (в пределах 3%) подвергается дальнейшему расщеплению. Поэтому, объем воздушной фазы в культуральном сосуде мало влияет на выход активности. Однако, заполнение средой культурального сосуда, более чем на половину его объема не рекомендуется.
Указанные выше рекомендации следует использовать при составлении клеточной взвеси в конкретных условиях.
Для каждого типа культурального сосуда необходимо подобрать оптимальные соотношения количества клеток и среды №2 (сохранив и газовую фазу), учитывая выходы активности и экономичность процесса биосинтеза.
Операция 8. Стационарное культивирование индуцированных лейкоцитов.
В матрицы, со строгим соблюдением стерильности, заливают рассчитанное количество среды №2 и вводят необходимое количество лейкоцитов. Перекрывают матрицы стерильными пробками, суспензию клеток тщательно перемешивают и устанавливают матрицы в соответствующе положение (норма "ребро") на стеллажи термального помещения с температурой 37°С. Культивирование продолжают 18-20 часов. Допускается роллерное культивирование лейкоцитов на стации биосинтеза при соблюдении вышеуказанных принципов.
Операция 9. Отделение отработанных лейкоцитов.
После завершения синтеза интерферон-содержащую культуральную среду подвергают центрифугированию или сепарированию с соблюдением условий стерильности для отделения отработанных клеток.
Надосадочную жидкость собирают в стерильные бутыли емкостью –10 л. Затем, для инактивации вируса - интерфероногена в каждой бутыли доводят величину рН до 2,5 добавлением при тщательном перемешивании (пипеткой, постепенно) 20%-ного раствора соляной кислоты. Правильность доведения величины рН необходимо контролировать с помощью потенциометра любой системы. Из каждом бутыли отбирают образец (10 мл) для проведения контролей, после чего бутыль перекрывают стерильной резиновой пробкой и запечатывают, на бутыль приклеивают этикетку с указанием номера серии и даты изготовления. Перед розливом по ампулам доводят рН раствора до 7,0-6,5.
Операция 10. Розлив и лиофильная сушка.
В ампулы и флаконы емкостью 5-10 мл препарат разливают по 2 мл. Во флаконы емкостью 500 мл по 50 мл.
Препарат вводят мерно с помощью дозатора или бюретки со строгим соблюдением условий стерильности. Ампулы или флаконы с препаратом перекрывают стерильными марлевыми (2 слоя) тампонами и устанавливают вертикально в кассеты сушильного аппарата. Кассеты с препаратом подвергают замораживанию при З6-40°С в течение 48-72 часов,
Лиофилизацию проводят в вакуумсушильных аппаратах любой системы.
Препарат хранят в сухом, защищенном от света месте при температуре от +4 до 10°С. Срок годности препарата 1,5 года с момента изготовления.
7. ТАБЛИЦА противовирусных ПРЕПАРАТОВ
| № п/п | Структурная формула | Название, синонимы | Систематическое название | Методы получения | Анализ | Разное |
| 1 |
| Ремантадин (полирем, флумадин) | альфа-Метил-1-адамантил-метиламина гидрохлорид | |||
| 2 |
| Дейтифорин | 1-Норборнилэтил-амина гидрохлорид | |||
| 3 |
| Адапромин | альфа-Метил-1-адамантил-етиламина гидрохлорид | |||
| 4 |
| Арбидол | этилового эфира 6-бром-5-гидрокси-1-метил-4-диметил-аминометил-2-фенилтиометил-индол-3-карбоновой кислоты гидрохлорид, моногидрат | |||
| 5 |
| Бонафтон | 6-бром-1,2-нафтохинон | [10], [11] | ||
| 6 |
| Оксолин | 1,2,3,4-тетраоксо-1,2,3,4-тетрагидро-нафталина дигидрат | |||
| 7 |
| Теброфен | 3,5,3׳,5׳-тетрабром-2,4,2׳,4׳-тетраокси дифенил | |||
| 8 |
| Риодоксол | 2,4,6-трийодрезорцин | |||
| 9 |
| Флореналь | бисульфитное соединение 2-флуоренонил-глиоксаля | |||
| 10 |
| Метисазон | тиосемикарбазон N-метилгуанина | |||
| 11 |
| Идоксуридин (перецид, офтан-IDU, iduviran) | 5-йод-2׳-дезоксиуридан | |||
| 12 |
| Ацикловир (ацивир, виролекс, зовиракс, цевирин) | 9-(2-гидрокси) этоксиметилгуанин | |||
| 13 |
| Ганцикловир (цимевен, cymevene) | 9-(1,3-дигидрокси-2-пропоксиметил) цинин | |||
| 14 |
| Фармцикловир (фамвир, famvir) | 2-[-(2-амино-9H-пурин-9-ил)этил]-1,-1-пропиндиола диацетат | |||
| 15 |
| Рибамидил (виразол, рибавирин) | 1-бета-Д-рибофуринозил-1H-1,2,4-тиазол-3-карбоксамид | |||
| 16 |
| Зидовудин (озидотимидин, ретровир) | 1-(3׳-азидо-2׳-дезоксирибозил) тимидин | |||
| 17 |
| Фланозид | 7-бета-Д-глюкопиранозид-8-(3-метилбут-2-енил)-4׳,5,7-триоксилфливанон | |||
| 18 |
| альпизарин | 2-С-бета-Д-(глюкопиранозид)-1,3,6,7-тетраоксиксантон | |||
| 19 |
| Мегосин | 1,1׳,6,6׳-тетраокси-5,5׳-диизопропил-3,3׳-диметил-7,7׳-диоксо-8,8׳-диметиламиноэтан-сульфокислоты динатриевая соль-2,2׳-динафталина | |||
| 20 |
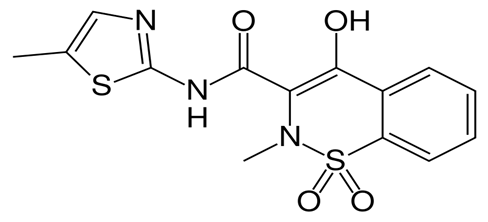
| Госсипол | 2,2׳-Ди-(1,6,7-триокси-3-метил-5-изопропил-8-нафтальдегид | |||
| 21 | Полудон | полиаденил-уридиловая кислота | ||||
| 22 |
| Камедон (camedon) неовир | натриевая соль 10-метиленкарбоксилат-9-акридина | |||
| 23 |
| Тилорон | 2,7-бис-[2-(диэтиламино)этокси]-флуорен-9-он | [7], [8], [9] |
ЛИТЕРАТУРА
1. Машковский М.Д. Лекарственные препараты. Т.2. – Москва «Медицина», 1993.367с.
2. Харкевич Д.А.Фармакология. – Москва «Медицина», 1996.425с.
3. БМЭ/ Под ред. Б.В. Петровского. – М. «Сов. Энциклопедия», 1976. БСЭ/Под ред. Прохорова. – М. «Сов. Энциклопедия», 1976.673с.
5. Машковский М.Д. Лекарственные препараты. Т.2. – Харьков «Торсинг»,1997.423с.
6. Михайлов Клиническая фармакология. – М. «Медицина»,1983, 258с.
7. Andrews. Edwin R, Fleming Roberts W, Girisar J. Martin, Kihm James C. ,Wenstup David L, Mayer Gerald D. «J. Med. Chem», 1974, 17, №8 882 – 886 (англ). (РЖХ, 8ж326, 1975).
8. О синтезе 2,7-бис-[2-(диэтиламино)этокси]-флуорен-9-он. Богатский А. В. Грень А. И. Литвинова Л. А. Лемпарт Г. В. «Доклад АН УССР» 1976г, Б, №7 610 – 612 (ред. англ.). (РЖХ, 7ж141, 1977).
9. Новые пути синтеза хлоргидрата тилорона. Burke Sister M., Jeullie Madeleine M. «Synth. Communs», 1976, 6, №5 371 –376 (англ). (РЖХ, 11ж209, 1977).
10. Получение 6-бромнафтохинона-1,2 с нитрозодисульфонатом калия.«Z. Chem». 1973г, 13, №6, 216 (нем). (РЖХ, 6ж203, 1974).
11. Бонафтон – 14С. Кивокурцева Л. Н., Булот А. Д., Боброва Н. С. «Меченные биологически-активные вещества» (Москва), 1982г, №4, 54-59. (РЖХ, 1ж188, 1983).
12. Прикладная иммунология. Под редакцией Сохина А.А. и Чернушенко Е.Ф.- Киев, 1994
13. Современные аспекты применения интерферонов и других иммуномодуляторов. Сборник научный трудов.- Москва, 1994 г.
14. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология.- Москва, 1993 г.
СЛОВАРЬ ТЕРМИНОВАдсорбция – поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости.
Белки – природные высокомолекулярные органические соединения, построенные из остатков 20 аминокислот, которые соединены пептидными связями в длинные цепи.
Вирусы (от лат. Virus – яд), мельчайшие неклеточные частицы, состоящие из нуклеиновой кислоты (ДНК и РНК) и белковой оболочки (капсида).
Вирион – полностью сформированная вирусная частица, состоящая из нуклеиновой кислоты и белковой оболочки (капсида). Хранит и переносит генетический материал вируса от одной клетки к другой.
Вирулентность – степень болезнетворности (патогенности) данного микроорганизма.
Гликопротеиды (мукопротеиды), сложные белки, содержащие углеводные компоненты. К гликопротеидам относятся многие белки плазмы крови (иммуноглобулины, трансферрины и др.), гормоны и др.
Инфекция – внедрение и размножение в организме человека или животного болезнетворных микроорганизмов, сопровождающееся комплексом реактивных процессов; завершается инфекционным заболеванием, бактерионосительством или гибелью микробов. Источник возбудителя инфекции заражает здоровых при соприкосновении, через рот (с водой и пищей), воздух (с капельками слюны и слизи), членистоногих переносчиков.
Ингибиторы – химические вещества, подавляющие активность ферментов. Используют для изучения механизма действия ферментов, для лечения нарушений обмена веществ, а также в качестве пестицидов.
Интерферон – защитный белок, вырабатываемый клетками млекопитающих и птиц в ответ на заражение их вирусами; неспецефический фактор противовирусного иммунитета.
Капсид – белковая оболочка вируса, предохраняющая его нуклеиновую кислоту от внешних воздействий. Состоит из отдельных одинаковых структурных единиц – капсомеров.
Транскрипция - ферментативный процесс передачи генетической информации одной цепи ДНК для синтеза комплиментарной нуклеотидной последовательности в структуре мРНК
Трансляция -процесс использования генетической информации мРНК для синтеза белка соответствующей аминокислотной последовательности
Липиды – обширная группа природных органических соединений включающая жиры и жироподобные вещества. Содержатся во всех живых клетках, один из основных компонентов биологических мембран.
Нуклеиновые кислоты – высокомолекулярные органические соединения, образованные остатками нуклеотидов. Различают ДНК или РНК кислоты. Выполняют функции передачи и хранения генетической информации, учувствуют в механизмах, при помощи которых она реализуется в процессе синтеза клеточных белков.
Нуклеозиды – гликозиды в состав которых входят пуриновое или пиримидиновое основание и углевод рибоза или дезоксирибоза. Содержится в нуклеиновых кислотах и нуклеотидах.
Паразитизм – форма взаимоотношений между организмами различных видов, из которых один (паразит) использует другого (хозяина) в качестве среды обитания и источника питания, нанося ему вред.
Репликация - процесс самоудвоения нуклеиновых кислот. Осуществляется полуконсервативным способом, когда двуспиральная ДНК деспирализуется и каждая ветвь индуцирует синтез комплементарной себе ветви при участии ДНК- или РНК-полимеразы. Ферментативный процесс репликации разделяют на три этапа: инициация, элонгация (рост цепи) и терминацию.
Сенсибилизация – повышение чувствительности организма животного и человека к воздействию каких-либо раздражителей.
Субстрат – химическое вещество подвергающееся превращению под действием фермента.
Углеводы – обширная группа природных органических соединений. Входят в состав клеточной оболочки и других структур, участвуют в защитных реакциях организма.
Ферменты – биологические катализаторы, присутствующие во всех живых клетках.
Пирогенные вещества (греч. pyr – огонь + gennao – создавать, производить; син. пирогены) – биологически активные вещества экзогенного (бактериального и вирусного) и эндогенного (клеточно-тканевого) происхождения, обладающие свойством вызывать перестройку уровня регуляции температурного гомеостаза, приводящую к повышению температуры тела и развитию лихорадки.
Пролиферация (от лат. proles – потомство и ferre – приносить, производить) – новообразование клеток в организме путем их размножения делением. Процессы деления, лежащие в основе пролиферации – амитоз и митоз. Представление о возможности образования клеток из неоформленной бластомы или “живого вещества”, а не путем пролиферации, в современной науке признаны лишенными основания. Пролиферация лежит в основе физиологической регенерации клеток, происходящей в разных тканях на протяжении всей жизни индивидуума, но с особой интенсивностью и закономерностью имеющей место в кроветворной ткани, эпителиальных покровах. Источником пролиферации при этом служат либо специальные недифференцированные материнские клетки, либо камбиальные элементы.
Простагландины – биологически активные вещества, представляющие собой производные полиненасыщенных жирных кислот, молекула которых содержит 20 углеродных атомов.
Противовоспалительные средства – лекарственные средства, подавляющие проявления воспалительных процессов.
Регенерация (позднелат. regeneratio – возрождение, возобновление) – обновление структур организма в процессе жизнедеятельности и восстановление тех структур, которые утрачены в результате патологических процессов.
Репарация – полная или неполная регенерация внутриклеточных структур, клеток, участков ткани или органа, поврежденных в результате какого-либо патологического процесса.
Таксисы (греч. taxis – построение, расположение) – двигательные реакции свободно подвижных низших растений, простейших животных, отдельных клеток многоклеточных организмов и микроорганизмов в ответ на действие раздражителя. Движение по направлению к раздражителю называется положительным таксисом, от раздражителя – отрицательным; движение не ориентированное по отношению к раздражителю, обозначают как фоботаксис.
Фагоцитоз (phagocytosis; греч. phagos пожирающий + kytos вместилище, здесь – клетка + -osis) – процесс узнавания, активного захвата и поглощения микроорганизмов, разрушение клеток и инородных частиц специализированными клетками иммунной системы. Объектом фагоцитоза являются микробы, чужеродные и измененные собственные клетки или их ферменты, комплексы антиген-антитело и др. Неотъемлемую часть фагоцитоза составляет направленное движение – хемотоксис – фагоцитов к месту локализации чужеродных частиц.
Цитостатические средства (cytostatica; греч. kytos вместилище, здесь – клетка + statikos останавливающий; син. цитостатики) – лекарственные средства, подавляющие деление клеток; используется главным образом для лечения злокачественных опухолей.
Эндокринная система – система, состоящая из специальных структур, расположенных в центральной нервной системе, различных органах и тканях, а также желез внутренней секреции, вырабатывающих специфические биологически активные вещества (гормоны). Наряду с нервной системой эндокринная система участвует в регуляции функций различных систем, органов и метаболических процессов.
Протромбин – предшественник фермента троибина, содержащийся в плазме крови. Под действием протромбина растворенный в крови белок фибриноген превращается в сгустки фибрина, тромбообразующие сосуды. Как и ряд других факторов свертывания крови (факторы VII; IX; X), протромбин синтезируется в печени под влиянием витамина К. Снижение содержания этих факторов в крови, определенное по протромбиновому времени, сопровождается выраженной кровоточивостью и возникает вследствие тяжелых заболеваний печени, недостатка в организме витамина К или нарушения его всасывания в кишечнике, при передозировке или отравлении антикоагулянтами – антагонистами витамина К.
Хромосома-(от греч. хрома – цвет, краска и сома - тело) термин предложен в 1888 году немецким морфологом В.Вальдейером, который обозначал внутриядерные структуры эукариотической клетки, хорошо окрашивающиеся основными красителями. Основной носитель наследственного материала (комплекса генов) в эукариотической клетке. Химическая организация хромосом основана на ДНК и белках, образующих нуклеопротеиновый комплекс. ДНК является материальным носителем свойств наследственности и изменчивости и содержит биологический алгоритм развития клетки, организма. Белки составляют около 65% массы хромосом и выполняют структурирующую и регуляторную функции.
Эукариоты -(от греч. eu - хорошо, полностью и karyon - ядро, орех) - организмы, обладающие сформировавшимся клеточным ядром, ограниченного от цитоплазмы оболочкой. Генетический материал заключен в хромосомах. Характерен половой процесс размножения
Похожие работы
... сконто, дилерские. Заключение В ходе написания курсовой работы было проведено маркетинговое исследование группы нестероидных противовоспалительных средств с углублённым товароведческим анализом лекарственного препарата Мовалис, Определение положения препарата и фирмы-производителя на отечественном рынке. Данный препарат является высокоэффективным оригинальным продуктом немецкой фирмы Берингер ...
... unit, единица формирования колоний) на 30%, в то время как классическая форма тобрамицина снижала CFU лишь на 10%. Таким образом, изучение фармакокинетики липосомальных лекарственных препаратов в эксперименте (на этапах создания) и клинике (на этапах применения) представляется важной составляющей компонентой практического внедрения последних достижений, а фармакокинетические исследования могут, ...
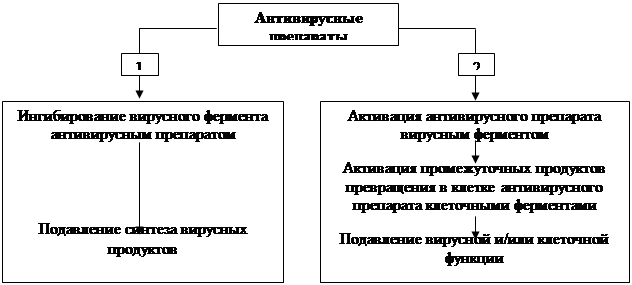
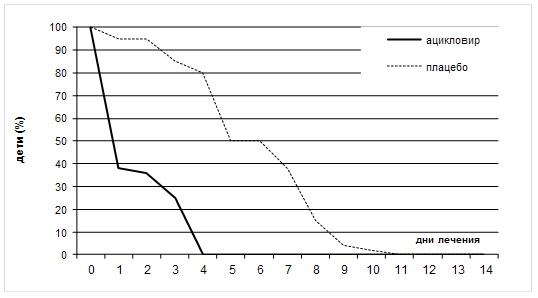
... также вирусов гриппа А и В, вируса гепатита В и ВИЧ) без предварительной активации. Препарат высоко токсичен, что ограничивает его применение в лечении герпетической инфекции только случаями резистентности герпеса к ацикловиру и его аналогам. Другие препараты, указанные в таблице 6, имеют меньшую клиническую эффективность, поэтому их применение возможно при недоступности современных антивирусных ...
... самая «безобидная» таблетка представляет для больной печени дополнительную нагрузку, поэтому в острый период болезни применять лекарства нужно с особой осторожностью. Как правило, острые вирусные гепатиты самопроизвольно заканчиваются выздоровлением с исчезновением вируса из организма, и нет необходимости проводить специфическое лечение. Это справедливо всегда при гепатитах А и Е, в 90% случаев ...
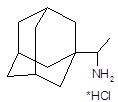
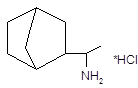
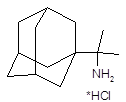
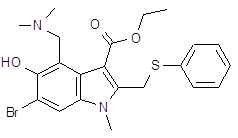

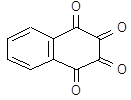
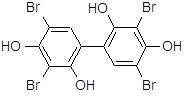
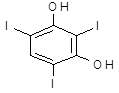
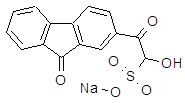
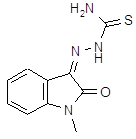
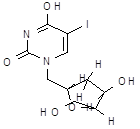
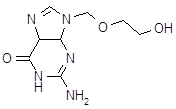
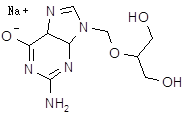
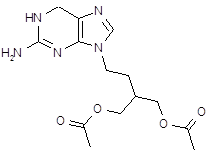
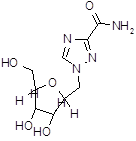
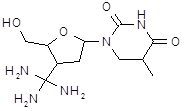
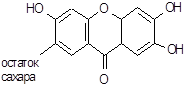
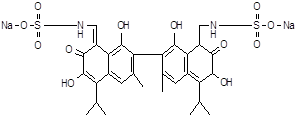
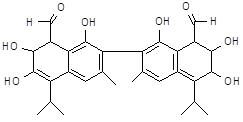
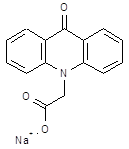
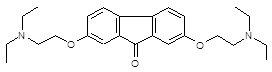

0 комментариев