РЕФЕРАТ
НА ТЕМУ: РОЛЬ НЕРВНОЙ СИСТЕМЫ В ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
2009г.
РОЛЬ НЕРВНОЙ СИСТЕМЫ В ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
Туберкулезные микобактерии, попав в организм, тотчас же вызывают реакцию, развивающуюся в значительной мере под влиянием нервной системы. Осевшие туберкулезные палочки раздражают чувствительные окончания интерорецепторного аппарата, что вызывает рефлекторное расширение прилегающей к месту раздражения капиллярной кровеносной сети и развитие гиперемии со всеми последующими, весьма сложными изменениями морфологического и обменного характера, обусловленными особенностями иннервации и спецификой обмена веществ данной ткани. Первичный рефлекторный процесс представлен нервной дугой, замыкающейся в симпатических узлах, спинном мозгу, продолговатом мозгу или гипоталамической области, и находится под контролем корковых центров, которые обусловливают сложную координирующую динамику возбуждения и торможения.
Перераздражение клеток коры мозга и рецепторного аппарата очага воспаления сопровождается нарушением нормальных физиологических процессов и развитием изменений дистрофического характера. Этому же способствуют и возникающие при хроническом туберкулезе дегенеративные изменения в нервных волокнах, что обнаружено в блуждающем нерве и его ядрах (В. Г. Штефко). Степень тяжести воспалительных изменений зависит от ряда причин, первое место среди которых занимают функциональные особенности нервной системы, ее чувствительность к токсину, сила раздражения, обусловленная количеством проникших бактерий, и способность их к размножению в условиях той или другой ткани.
В дальнейшем при неблагоприятном течении воспалительной реакции распространение процесса, сопровождающееся увеличением зоны токсического раздражения рецепторного аппарата, еще более отягощает течение туберкулеза за счет не только перераздражения центральной нервной системы, но и непосредственного угнетения физиологических процессов ее токсинами. Такое положение, длительно существующее, может часто привести к необратимым изменениям.
В последнее время широко проводятся основанные на учении И. П. Павлова исследования по терапии инфекционных заболеваний путем уменьшения процессов возбуждения в центральной нервной системе усилением торможения. Исследования в этом направлении указывают на возможность эффекта от таких мероприятий и при туберкулезной инфекции.
Наши опыты показывают, что воспалительная реакция на туберкулезную инфекцию в брюшной полости морских свинок несколько уменьшается при кормлении их малыми количествами бромистого натрия в течение нескольких дней до заражения и после него. Однако надо считать, что для успешной разработки этого направления необходимы серьезные исследования тонких клеточных процессов, обусловливающих реакции возбуждения и торможения в клетках центральной нервной системы.
Морфологические изменения воспалительной реакции при туберкулезе хорошо изучены. Исследования показывают, что клеточная реакция на месте оседания туберкулезных микобактерий возникает уже с момента их проникновения в ту или другую ткань.
Реакция в разных тканях на туберкулезные микобактерий несколько различна, будучи обусловлена их специфическими особенностями (характером васкуляризации, спецификой обмена и т. п.). В отдельных случаях это имеет настолько выраженный характер, что при небольшом количестве бактерий или небольшой их вирулентности туберкулезный процесс в некоторых органах не развивается. Исследования показали, что внутривенное заражение животных, обеспечивающее равномерное «обсеменение» всего организма, дает, однако, различную пораженность органов туберкулезом — наиболее бывают поражены легкие и лимфатические внутригрудные узлы (3. А. Лебедева).
В развитии воспаления установлена большая роль клеток соединительной ткани (по другим авторам, ретикуло-эндотелиальной, активной мезенхимы). Клетки этой ткани, составляя основу всех органов и эндотелиально-капиллярный барьер и принимая участие в обменных процессах организма и кроветворении, обладают, кроме того, тремя исключительно важными в иммунологическом отношении свойствами — способностью к фагоцитозу, бактериолизу и морфологическим превращениям.
По И. И. Мечникову, исход инфекции — встречи организма с микробом — определяется Функциональной активностью этой ткани и в особенности активностью бактериолиза. Последнее обстоятельство в отношении ряда бактерий является решающим; однако по отношению к туберкулезным палочкам, обладающим исключительно большой резистентностью, разрушение их в полной мере наблюдается не у всех животных. Ярким примером полного лизиса туберкулезных палочек, обусловливающего полный иммунитет, является гусеница пчелиной моли в фагоцитах которой наблюдается полное разрушение захваченных ими бактерий (С. И. Метальников).
У других животных с менее выраженной силой внутриклеточных ферментативных процессов, по И. И. Мечникову, обусловливающих пищеварительную функцию клеток, разрушение бактерий происходит слабее, но влияние фагоцитоза не остается бесследным и в этих случаях. Туберкулезные микобактерии, пробывшие некоторое время в фагоцитах, если заметно и не разрушаются, то все же, как показали наши опыты, значительно ослабляются. Мы наблюдали, что реакция этой ткани на туберкулезные микобактерии у животных, резистентных к туберкулезу (например, у крыс), складывается выгоднее, чем у животных, чувствительных к нему (у морских свинок). Так, при введении туберкулезных микобактерии крысам в брюшную полость развивающийся экссудат содержит значительно больше клеточных элементов. Преобладают наиболее стойкие к токсинам и наиболее способные к их разрушению лимфомоноцитарные элементы; появляются они скорее, чем у чувствительных к туберкулезу животных. Способность к фагоцитозу и бактериолизу у них также значительно больше, чем у морских свинок. Клинические наблюдения показали более высокую фагоцитарную активность лейкоцитов у больных с доброкачественным течением туберкулеза (Г. Е. Платонов, 3. Н. Шаврова, Μ. Μ. Плисецкий и др.).
Наши опыты показывают, что воспалительная реакция при заражении животных вирулентным, сильно токсическим штаммом туберкулезных микобактерии отличается от таковой при апатогенном штамме; это особенно выражается в низкой фагоцитарной и бактериолитической деятельности клеток экссудата. При этом клетки, захватившие микобактерии туберкулеза, скоро подвергаются дегенеративным изменениям и погибают. Полиморфноядерные лейкоциты (микрофаги) оказываются более чувствительными к туберкулезному токсину, погибая уже через 24 часа; более устойчивы в этом отношении моноцитарные и эпителиоидные клетки. Устойчивость клеток к бактерийным токсинам находится в связи с активностью их внутриклеточных ферментов.
Значение этого фактора подтверждается и наблюдениями над культурой ткани, показавшими, что лейкоциты больных фиброзными формами туберкулеза обладают повышенной стойкостью к туберкулезному токсину.
При образовании бугорков отмечается ряд последовательных изменений, механизм смены которых до настоящего времени еще полностью не разгадан; несомненно, решающее значение в этой смене имеет реактивность нервной системы и чувствительность к сложным веществам, образующимся в очаге воспалительной реакции.
Процесс начинается с появления инфильтрата в гиперемированном участке ткани за счет иммиграции лейкоцитов через стенку капилляров с развитием в той или иной степени фагоцитоза и бактериолиза.
Через 1—2 дня лейкоциты претерпевают дегенеративные изменения, а на 3-й день в образовании воспалительного инфильтрата принимают участие клеточные элементы, образующиеся за счет пролиферации местных соединительнотканных элементов: лимфоциты, моноциты, эпителиоидные клетки и т. п. Такие превращения наблюдаются и в культуре ткани, зараженной туберкулезом (А. А. Максимов, А. Д. Тимофеевский и др.).
Место оседания туберкулезных микобактерий окружается клетками мононуклеарного типа с образованием гигантских клеток. Несколько позже этот крупноклеточный инфильтрат окружается слоем лимфоцитов и молодых фибробластов. Образовавшийся таким образом «туберкулезный фолликул» подвергается обычно в центре коагуляционному некрозу с распадом на глыбки белкового вещества из распадающихся ядер и протоплазмы лейкоцитов.
Воспалительная реакция на туберкулезные микобактерий протекает в основном по экссудативному или продуктивно-фиброзному типу. Это определяется, видимо, специфической чувствительностью нервной системы и наличием в последнем случае в клетках ферментов, обеспечивающих достаточно полное разрушение туберкулезных микобактерий.
Установлено, что фосфатиды туберкулезных микобактерий вызывают типичные морфологические туберкулезные изменения в организме с эпителиоидными и гигантскими клетками, а жировосковая их фракция — казеозные изменения. Естественно предположить, что при наличии в тканях соответствующих ферментов, обладающих большой активностью разрушения этих веществ, это должно привести к уменьшению развития изменений, вызываемых этими веществами.
В связи с этим как для понимания различных морфологических проявлений развития воспалительной реакции организма на туберкулезную инфекцию, так и для выяснения факторов заживления исследование ферментативных реакций является при этом существенным средством.
Рассмотрение материалов, посвященных изучению иммунитета, показывает, что среди разных факторов, обусловливающих ту или иную сопротивляемость макроорганизма инфекции, огромное значение имеют ферментативные процессы, от активности которых зависит функциональное состояние всех органов и организма в целом.
Самые сильные токсины — столбнячный, змеиный, дифтерийный и др. легко обезвреживаются ферментами: так, введение их через рот не вызывает смертельных явлений, возникающих при введении в ток крови, где ферменты менее, активны. Фагоцитированные бактерии являются для клеток питательным субстратом, подвергающимся ферментативному расщеплению. От интенсивности клеточных ферментов и соответствия их «набора» составным частям бактерий зависит судьба микроба — либо микроб погибает, либо остается невредимым, и начинает преобладать процесс его деятельности — размножение. Образующиеся токсины, как показали наши опыты, угнетают основные физиологические процессы макроорганизма.
На характер и исход «защитных» реакций организма при туберкулезе оказывают значительное влияние ферменты, расщепляющие специфические жиры и фосфатиды туберкулезных бактерий, под действием которых образуется собственно специфическая ткань (эпителиоидные, гигантские клетки, казеоз и т. п.).
Малая устойчивость к туберкулезу у некоторых животных отчасти объясняется отсутствием у них специфических липаз и фосфатов, способных расщеплять необычные жировоски и фосфатиды туберкулезных микобактерий.
Наибольшее значение имеют окислительные ферменты, так как, помимо питания организма, они принимают решающее участие в основных процессах иммунитета— в бактериолизе и разрушении токсинов (А. Н. Бах и В. А. Энгельгардт).
Решающую роль оксидаз в. разрушении туберкулезных палочек доказал Н. Ф. Гамалея и подтвердили наши опыты.
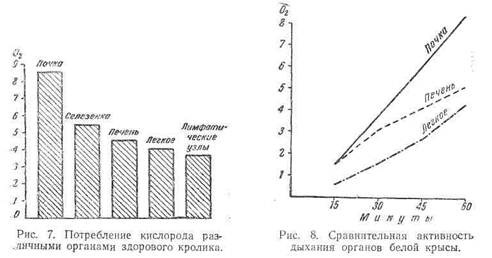
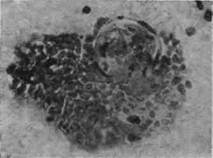
Мы смогли обнаружить чрезвычайно интересный и парадоксальный факт, что легкие, «купающиеся» в кислороде вдыхаемого воздуха, обладают наравне с лимфатическими узлами, самой низкой активностью окислительно-восстановительных процессов, в чем и кроется, повидимому, одна из причин пораженное легких туберкулезом (рис, 7).
Этому способствует и малая активность других ферментов в них — каталазы, липазы и протеолитических ферментов.
Окислительные процессы в легких уступают таковым в других органах и по скорости течения, как показывают приведенные ниже данные (рис. 8).
На диаграмме весьма убедительно выделяется наименьшая активность дыхания легочной ткани как по величине, так и по скорости его в почечной ткани максимум поглощения кислорода почти вдвое выше чем легких, уже через 15—20 минут.
Это имеет большое иммунобиологическое значение, так как определяет скорость разрушения бактерийных токсинов, чем предотвращается их вредящее действие на ткани. Такое же явление обнаружено и по отношению к другим, не менее важным в иммунологическом и физиологическом отношении ферментам — фосфатазе и дезаминазам.
При исследовании ферментов, расщепляющих фосфатиды, оказалось, что фосфатаза легких мышей действует быстрее, чем фосфатазы кролика и морской свинки (по отношению к моно- и диэстеразам).
Выявилась и другая важная особенность. Оказалось, что легкие морских свинок и мышей содержат довольно много лецитиназы (и фосфатазы), но активность этих ферментов у свинок угнетается присутствием даже небольших количеств жирных кислот туберкулезных палочек, что не наблюдается у мышей, эти энзимы легких кролика занимают промежуточное место. Легкие мышей, в отличие от легких морских свинок, содержат фермент, расщепляющий фосфатиды туберкулезных палочек, способствуя тем самым их разрушению.
Весьма интересны данные, характеризующие с ферментативной стороны лимфатические узлы как ткань, на фоне которой начинается туберкулез. По ряду ферментативных показателей лимфатические узлы являются малоактивными, приближаясь к легким (Г. Е. Платонов). Видимо, этим и объясняется неполнота бактериолиза в них, что делает возможным длительное пребывание в них палочек и распространение инфекции. Так, по интенсивности окислительных процессов, приближаясь к легким, лимфатические узлы в 2—3 раза слабее, чем почки (органа с большей резистентностью к туберкулезу). Оказалась менее активной, чем в легких, и липаза, хотя можно было предполагать обратное, учитывая литературные данные о липолитической активности лимфоцитов, составляющих основную массу (до 70—90%) клеточного состава лимфатических узлов.
В связи с таким значением ферментативных процессов в сопротивляемости организма представляет значительный интерес исследование их в тканях во время воспалительной реакции при туберкулезе.
Ряд таких проведенных нами опытов по исследованию развития туберкулезной инфекции в легких и лимфатических узлах в динамике, начиная с первых часов, позволяет не только установить наличие значительных нарушений в них, но и выявить определенную закономерность фазовость этих изменений.
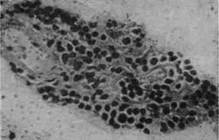
Первая фаза воспалительной реакции при туберкулезе характеризуется значительным угнетением ферментативных процессов. В морфологическом отношении она отличается в основном лимфоидным характером, что особенно ясно наблюдается в наших опытах по исследованию динамики развития реакции лимфатических узлов на туберкулезную инфекцию. Длительность этой фазы, как и последующих, вариирует в зависимости от ткани, токсических свойств туберкулезных бактерий и их количества. В это время особенно наблюдается снижение окислительных процессов и фосфатазы по сравнению с нормой, что начинается с первых часов инфекции и вызывается токсинами туберкулезных палочек и продуктами их распада. В лимфатических узлах через 2 дня после заражения распавшиеся туберкулезные палочки при окраске гематоксилин-эозином представлены в виде желтобурого пигмента — меланина. В легких явления разрушения туберкулезных палочек наблюдаются позже — на 8-й день и позже.
Однако лизис туберкулезных микобактерий не всегда приводит к их полному разрушению. При гибели клеток и накоплении продуктов рас пада, благоприятствующих их развитию, появляются вновь хорошо окрашивающиеся фуксином типичные туберкулезные микобактерий.
Угнетение дыхания в первую фазу реакции организма на инфекцию объясняется, как показали наши опыты, действием туберкулезных токсинов. Можно предполагать, что такое свойство туберкулезных токсинов является и причиной пролиферации соединительнотканных элементов, принимающих участие в образовании бугорка, как выражение компенсаторной реакции этой ткани на асфиксию, развивающуюся в участках ткани с осевшими туберкулезными микобактериями. Одновременно развивающийся высокий гликолиз при пониженных окислительных процессах в этой стадии развития бугорка способствует накоплению молочной кислоты в тканях — ацидозу.
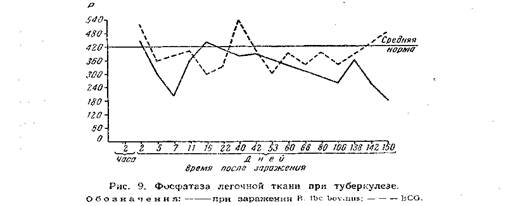
Асфиктическое и ацидотическое состояние в бугорке вызывают гибель фагоцитов и тканевых клеток, прилегающих к центрам формирующихся бугорков. Это подтверждается и рядом гистологических исследований, показывающих наличие дегенеративных изменений в фагоцитах уже на 3-й день (ядро утрачивает структуру, бледно красится и т. д.), С первых же дней заражения и до конца болезни снижается фосфатаза легких, особенно при вирулентном штамме (рис. 9).
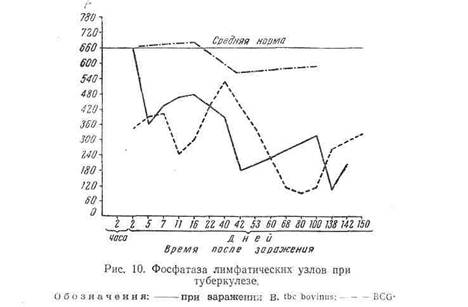
Особенно значительное угнетение фосфатазы наблюдается в лимфа тических узлах средостения, начиная с первых же часов заражения кроликов и далее до конца — через 150 дней, когда наблюдалось уже большое разрушение (рис. 10). Обращает внимание лишь небольшое уменьшение активности фосфатазы в опыте при очень малой дозе апатогенного штамма BCG.
Все это характеризует первую фазу развития бугорка, длящуюся от 12 до 15 дней, причем переход в следующую, вторую, фазу зависит от итога ферментативных процессов в этот начальный период; при благоприятном комплексе ферментативных процессов происходит полное разрушение бактерий и восстановление нормальной жизни инфицированного участка.
Это имеет место или при весьма активных ферментах ткани, или при слабом угнетении дыхания токсинами, например, при малой патогенности микроба (особо вирулентные микробы, как показывают наши опыты, вызывают сильное угнетение дыхания).
При весьма высокой индивидуальной или видовой активности клеточных ферментов токсины быстро разрушаются, чем купируется и их патогенное, туберкулообразующее действие. Такое объяснение подтверждается и опытами сравнительного изучения влияния туберкулезных токсинов на дыхание различных органов. Оказалось, что токсин, сильно угнетающий дыхание клеток легких, меньше угнетает дыхание сильных в ферментативном отношении клеток печени (Η. Ε. Прокопенко, Г. Е. Платонов и 3. С. Васильева). При малоактивных клеточных ферментах микобактерии и их токсины не разрушаются и вызывают долго длящуюся воспалительную реакцию с последующим разрушением тканей.
Снижение окислительных процессов и фосфатазы в первой фазе реакции ведет к ослаблению разрушения туберкулезных микобактерии и их продуктов, в частности их липоидной фракции, накопление которой, вероятно, и вызывает переход лимфоидной фазы в эпителиоидную. Способность липидов туберкулезных микобактерии вызывать образование эпителиоидных клеток доказана рядом современных опытов.
Первая, лимфоидная, фаза в случае функционально-ферментативной недостаточности (т. е. при неспособности разрушать туберкулезные микобактерии и их липиды до конца) переходит в эпителиоидную с формированием некротических очагов с новыми условиями среды как для бактерий, так и для клеточных процессов.
Чаще всего первая фаза при большой вирулентности микобактерии, при сильном угнетении дыхания и связанном с ним большом гликолизе переходит во вторую фазу развития бугорка с уже значительными клеточными нарушениями в органе. Во второй фазе в лимфатических узлах особенно ясно выступает эпителиоидный характер клеточной реакции.
Вторая фаза характеризуется усилением тканевого дыхания, гликолиза и фосфатазы и начинается с момента полного развития бугорка и всасывания из него в окружающую ткань продуктов начального аутолиза клеток бугорка, погибших в первую фазу его развития.
Усиление окислительных процессов в туберкулезной ткани происходит как за счет стимулирования этих процессов продуктами распада и образующимися метаболитами, что доказано нашими опытами, так и за счет значительной пролиферации под их же влиянием сильно дышащих и сильно гликолизирующих соединительнотканных элементов, составляющих ткань бугорка.
Наступающее усиление окислительных процессов вначале удовлетворяется за счет усиленного подвоза кислорода кровью по расширенным сосудам. Но скоро усиление обмена приводит к увеличению проницаемости капиллярной стенки, что способствует проникновению белков плазмы в межклеточные пространства и как бы блокирует клетки воспалительного участка органа от проникновения кислорода, питательных веществ и препятствует выведению метаболитов, так как в белковой среде диффузионные процессы протекают слабее. Плохая васкуляризация бугорка также способствует кислородному голоданию.
Повышение в этот период темпа окислительных процессов при отставании притока кислорода вызывает в конце концов понижение окисления, сопровождающееся накоплением в бугорке недоокисленных промежуточных продуктов обмена. Возникшие условия благоприятствуют развитию аноксемического состояния и аноксибиотических процессов — усилению гликолиза и образованию молочной кислоты.
Накопление кислых продуктов, для нейтрализации которых путем окисления не хватает кислорода, увеличивается из-за нарушения нейтрализации их путем использования щелочных резервов плазмы вследствие трудности диффузии через богатый белками экссудат. Возникает, таким образом, местный ацидоз, который еще более осложняет развитие туберкулезного очага за счет связанных с ним процессов. Наши исследования показывают, что рН бугорка равен 4,5—5,0.
Обменные процессы в воспаленном очаге в известной степени делаются независимыми от всего организма, как бы осумковываются. Содержание сахара в очаге быстро уменьшается и через 60—90 часов достигает 6 — 15 мг%; содержание же молочной кислоты увеличивается до 125 мг%.
Уже давно отмечалось изолированное положение бугорка вследствие особенностей его строения — кольцевой зоны из лимфоидных элементов и почти полного отсутствия васкуляризации.
При изучении срезов, изготовленных из бугорков, изолированных от окружающей, не пораженной туберкулезом ткани, отмечена большая активность их клеточного дыхания, значительно превосходящая усиленное дыхание окружающей бугорок ткани. Причину такой активности клеточного дыхания можно объяснять как стимуляцией клеток бугорка его метаболитами, так и особенностью клеточных элементов, составляющих бугорок и по активности своих ферментов приближающихся к эмбриональным.
Не менее интенсивные и закономерные данные, облегчающие понимание патогенеза туберкулеза, получены и при исследовании гликолиза в процессе развития туберкулеза; они показали, что первой фазе пониженного клеточного дыхания здесь соответствует фаза усиленного гликолиза.
Усиленный гликолиз с 17-го дня после высыпания бугорков и при дальнейшем их развитии сменяется фазой угнетения, соответствующей фазе усиленного клеточного дыхания. Угнетение доходит до более низких величин, чем гликолиз у здоровых животных.
Здесь также весьма демонстративно выделяется гликолиз в бугорке. В то время как в окружающей легочной ткани отмечается снижение гликолиза, в бугорках он достигает очень высоких цифр. Такую высокую гликолитическую способность клеток в бугорке едва ли можно объяснить только действием туберкулезных метаболитов или туберкулезных токсинов на его клеточные элементы, как это было сделано на основании наших опытов по отношению к дыханию. Единственно возможным объяснением является отнесение клеток бугорка к элементам эмбрионального типа, которые отличаются этим свойством.
Внутри бугорков в этих случаях развивается значительный ацидоз, вызывающий активацию тканевой катептической протеиназы, до того инактивной по отношению к высокомолекулярным протеинам клеток. Возникающая вследствие асфиксии гибель клеток приводит к еще большему освобождению ферментов, вызывающих аутолиз, — стимулируют протеолиз и образующиеся при усиленном гликолизе лактаты. Способствует этому и гемовазорная реактивность ткани, обусловливающая как иммиграцию легко распадающихся здесь клеток — лейкоцитов, так и скорость развития стаза в крово- и лимфообращении воспалительного фокуса.
Вследствие гибели части клеток бугорка, в особенности полиморфноядерных лейкоцитов, содержащиеся в них протеолитические ферменты поступают в межклеточные щели туберкулезной ткани и вызывают расщепление белков органов с образованием аминокислот и т. п. Образующиеся таким образом продукты гидролиза являются хорошим субстратом для роста туберкулезных микобактерий, отличающихся малоактивными ферментами, вследствие чего неизменные белки тканей являются для них плохой питательной средой.
Доказано, что в туберкулезной ткани такие протеолитические ферменты имеются в лейкоцитах и эпителиоидных клетках. Наши исследования легочных протеаз показывают, что их оптимум действия наблюдается в кислой среде, что имеет место как раз в воспалительной ткани; нами же было показано нарастание способности легких к аутолизу при туберкулезе (Г. Е. Платонов).
Накопление продуктов распада и нарастающий ацидоз как результат всей суммы процессов воспалительной реакции вызывают расширение сосудов окружающей ткани, гиперемию и прилив лейкоцитов.
Эта фаза ввиду ее особенностей ферментативных процессов определяет качество продуктов распада, не только отражающееся на местной реакции, но и обусловливающее общую сенсибилизацию, ведущую к той или иной степени гиперергии. Такая гиперергия сказывается и на повышенной реактивности местных мезенхимальных и нервных элементов, усложняя дальнейшее развитие туберкулеза в виде различных комбинаций экссудативных процессов.
При гиперергическом воспалении происходят значительные изменения в сосудах (А. И. Абрикосов, А. И. Струков), увеличивается их проницаемость (до эритродиапедеза), что обусловливает массивный отек, быстро вызывающий стаз и изоляцию от общего кровообращения довольно значительных участков ткани, а это способствует развитию некроза и каверн.
При неблагоприятном течении реакции в конце второй фазы наблюдается все большее развитие некротических и казеозных очажков, что сопровождается снижением, окислительных процессов и количества фосфатазы до величин, значительно ниже нормальных. С этого времени можно выделить третью фазу реакции на туберкулезную инфекцию, начинающуюся с момента смены высокого тканевого дыхания второй фазы снижением, что в опытах с патогенным штаммом происходит около 130-го дня после заражения.
Это снижение ферментативных процессов возникает вследствие ряда причин, прежде всего вследствие значительного нарушения нормальной трофической регуляции нервной системы, вызываемого как дегенеративными изменениями нервных элементов в зоне очага, так и нарушениями реактивности центральной нервной системы. Наши прежние исследования говорят о том, что с развитием туберкулезной инфекции в ткани головного мозга происходит повышенное образование ацетилхолиноподобных веществ, что свидетельствует об изменении реактивности центральной нервной системы.
Уменьшение активности ферментов в пораженных тканях вызывается и непосредственным действием токсинов туберкулезных микобактерий, количество которых к этому времени увеличивается вследствие появления в туберкулезных очагах большого количества продуктов распада, благоприятствующих их размножению.
Снижение же активности ферментов может быть обусловлено значительным разрушением клеток в этой фазе развития туберкулеза, которая в патогистологическом отношении совпадает с полным развитием распада в туберкулезных очагах. В этой фазе развития туберкулезной ткани большую роль играет ослабление окислительных и усиление протеолитических процессов, причем вся местная и общая интоксикация идет за счет продуктов неполного окисления распадающихся белков.
Во все время развития туберкулеза другие ферменты, очевидно, играют меньшую роль. Наши исследования показывают небольшие изменения при туберкулезе, например, амилазы; несколько больше увеличивается содержание липазы легких. Это может способствовать накоплению в бугорчатой ткани жирных кислот, а образующийся при расщеплении жиров глицерин легко «сгорает». Накопление жирных кислот вследствие их неблагоприятного влияния на микобактерий может иметь положительное значение для организма. При недостаточной интенсивности окислительных процессов происходит «накопление» глицерина в ткани, что превышает пригодность органа как «среды» для размножения туберкулезных микобактерий.
Варианты интенсивности и характера ферментативных процессов клеток воспаленного очага обусловливают различные исходы воспалительной реакции.
Особенно большую роль в развитии экссудатизных форм имеет накопление недоокисленных продуктов неполного белкового гидролиза, оказывающих парализующее действие на вазоконстрикториый аппарат.
При возникновении воспалительных очагов одновременно с ауголитическими процессами могут действовать антиферментативные факторы. Такие антипротеолитические вещества различны по химической природе: антипротеолитическим действием обладают липоиды, кальций и др. Наоборот, иод, насыщая непредельные соединения липоидов, уменьшает их антипротеолитическое действие, вследствие чего аутолиз или наступает, или увеличивается, если он уже имелся. На основании этих данных при лечении туберкулеза иодом нужна осторожность.
Очевидно, что тормозящее действие на аутолиз будут оказывать как липоиды, притекающие с периферии к бугорчатой ткани, так и подобные им вещества, образующиеся из распадающихся клеточных элементов самого очага. В дальнейшем при остановке аутолиза возможна при помощи этих же веществ и петрификация, так как кальциевые соединения, проникающие путем осмоса и диффузии из сыворотки крови, дают с этими липоидами нерастворимые кальциевые мыла.
Процессу петрификации способствует накопление в очаге фосфора, количество которого, например, в лимфатических узлах, достигает во второй, эпителиоидной, фазе максимальных цифр (до 120 мг%) вследствие распада нуклеинов. Фосфорные соединения легко образуют нерастворимые соли с соединениями кальция, как приносимыми извне, так и выделяющимися при распаде его белковых соединений.
При длительном хроническом отсутствии или недостатке кислорода {при плохой васкуляризации или угнетающем действии токсина на дыхание) развиваются ткани с высокой гликолитической способностью, похожие на эмбриональные и опухолевые элементы.
В ряде случаев дыхание и гликолиз в бугорке идут по типу эмбриональных клеток, когда окисление протекает так быстро, что гликолиз снижается, продукты гидролиза полностью окисляются и протеолиз не велик. Очевидно, здесь можно предполагать доброкачественное течение туберкулеза, без распада, интоксикации и т. п.
В других случаях окисление в туберкулезной ткани не поспевает за потребностью продуктов гидролиза в окислении; то же наблюдается и при недостаточном поступлении кислорода.
Таким образом, очевидно, форма и течение туберкулеза, определяемые характером развития бугорка, зависят в значительной мере от ферментативных процессов клеток последнего, таких мезенхимальных элементов, которые служат для его образования и реактивности нервной системы.
Исход бугорка — фиброз—казеоз—каверна — зависит от сложного взаимоотношения окислительных и гидролитических процессов, обусловливаемых соответствующими ферментами его клеток. Настоятельной задачей является раскрыть наиболее благоприятную их комбинацию.
Анализ происходящих изменений позволяет считать, что в терапевтическом отношении в значительной мере решающей является первая, лимфоидная, фаза, в которой определяется поворотный момент к заживлению — полное разрушение микобактерий и предотвращение некроза с последующим большим распадом. Отсюда вытекает и терапевтическая задача, которая сводится к стимуляции бактериолиза, разрушению токсинов и задержке распада.
Это состояние может быть существенно улучшено усилением окислительных процессов и активированием фосфатазы, что побуждает к испытанию ряда веществ, обладающих, как показывают опыты, подобным действием (препараты железа, марганца, фосфора и др.).
Применяющийся при определенных формах туберкулеза стрептомицин, помимо бактериостатического действия, оказывает в этой фазе благоприятное влияние и благодаря задержке аутолиза и усилению дезаминирования, а тем самым и дезинтоксикации, что благоприятствует также развитию соединительной ткани (В. И. Пузик и др.).
По мере выяснения и уточнения ведущих ферментативных факторов, лежащих в основе защитной реакции организма на туберкулезную инфекцию, возникает возможность полного понимания патогенеза и нахождения способов воздействия, терапевтического выправления функций, нарушенных инфекцией.
Использованная литература:
1. Внутренние болезни / Под. ред. проф. Г. И. Бурчинского. ― 4-е изд., перераб. и доп. ― К.: Вища шк. Головное изд-во, 2000. ― 656 с.
Похожие работы
... парабиоза (Ю.М. Уфлянд, 1952), происходит под влиянием фармакологических и физиотерапевтических воздействий, направленных на перестройку метаболизм нейронов и восстановление их синаптической передачи. Локализация морфологических изменений в нервной системе. Полиомиелит нельзя рассматривать как избирательное заболевание спинного мозга. Поражается серое вещество не только спинного, но и головного ...
... , лептоспироз и др.) и вторичными (вертеброгенные, после детских экзантемных инфекций, инфекционного мононуклеоза, при узелковом периартериите, ревматизме и др.). По патогенезу и патоморфологии заболевания периферической нервной системы подразделяются на невриты (радикулиты), невропатии (радикулопатии) и невралгии. Невриты (радикулиты) – воспаление периферических нервов и корешков. По характеру ...
... , как корь, ветряная оспа, токсоплазмоз. Реже вторичные энцефалиты развиваются после профилактических прививок. Энцефалиты – тяжелые заболевания и наряду с менингитами составляют основную группу инфекционных болезней нервной системы. Болеют энцефалитом люди разного возраста. К общемозговым симптомам относят головную боль, головокружение, рвоту, судороги, нарушение сознания – от его легкого ...
... рефлексы (гиперрефлексия) могут быть при общем повышении возбудимости нервной системы (неврозах и неврозоподобных заболеваниях). При хорошем функциональном состоянии нервной системы у спортсменов наблюдаются рефлекторные реакции средней живости. Большое значение имеет исследование функции черепно-мозговых нервов. Так, состояние центрального и периферического зрения форма и величина зрачков, ...
0 комментариев