Навигация
Содержание продуктов перекисного окисления липидов в плазме крови беременных женщин
Федеральное агентство по образованию
ФГОУ ВПО Сибирский федеральный университет
Институт фундаментальной биологии и биотехнологии
Кафедра биохимии и физиологии человека и животных
В.С. Выборова
студентка V курса
Содержание продуктов перекисного окисления липидов в плазме крови беременных женщин
(дипломная работа)
Допустить к защите:
Зав. кафедрой, д.м.н., проф. А.А. Савченко
Научный руководитель:
Канд. биол. наук, проф.
Н.М. Титова
Красноярск 2008
Содержание
Введение
Глава 1. Обзор литературы
1.1. Активные формы кислорода – классификация и свойства
1.2. Перекисное окисление липидов
1.3. Антиоксидантная система
Глава 2. Материалы и методы
2.1 Объект исследования
2.2. Определение содержания малонового диальдегида
2.3. Определение содержания диеновых коньюгатов
2.4. Статистическая обработка результатов
Глава 3. Результаты исследований и обсуждение
3.1. Содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин
3.2. Содержание диеновых коньюгатов и малонового диальдегида и в плазме крови женщин в разные периоды беременности
Выводы
Список литературы
Summary
Введение
В последние годы широко обсуждается роль активных форм кислорода (АФК) и инициируемых ими свободнорадикальных процессов при различных патологических процессах, а так же при беременности. В нормальных условиях активность этих процессов находится на невысоком уровне, но при стрессовых ситуациях происходит усиленное образование АФК, под действием которых происходит избыточная и неконтролируемая активация процессов перекисного окисления липидов (ПОЛ), что в конечном итоге может привести к патологическому состоянию, которое сопровождается дисбалансом ферментативных и неферментативных компонентов системы антиоксидантной защиты. Физиологическая беременность может сопровождаться существенными изменениями в про/антиоксидантном статусе.
Характерным проявлением окислительного стресса является интенсификация процессов перекисного окисления липидов, индикатором которой служит увеличение содержания хотя бы одного из его продуктов. Данные о содержании продуктов ПОЛ в биологических объектах могут нести в себе информацию о глубине и степени патологического процесса. В качестве количественных маркеров наиболее часто используются такие интермедиаты ПОЛ, как диеновые конъюгаты (ДК), а также один из его конечных продуктов – малоновый диальдегид (МДА).
Цель данной работы – определение содержания ДК и МДА в плазме крови у женщин в разные периоды беременности.
В задачи работы входило:
1. Определить содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин.
2. Определить содержание ДК в плазме крови женщин в динамике беременности.
3. Определить содержания МДА в плазме крови женщин в динамике беременности.
Работа выполнена на базе кафедры биохимии и физиологии человека и животных Института фундаментальной биологии и биотехнологии Сибирского Федерального университета и Хакасского республиканского центра планирования семьи.
Глава 1. Обзор литературы.
1.1. Активные формы кислорода – классификация и свойства.
Термин активные формы кислорода (АФК) объединяет целый ряд образующихся в организме промежуточных и побочных продуктов восстановления молекул кислорода, таких как супероксидный (О2-), гидроксильный (НО·), пергидроксильный (НО2∙), пероксильный (RO2∙) и алкоксильный (RO∙) радикалы, оксид азота (NO∙), пероксинитрит (ONOO-), гипохлорит (HOCl), перекись водорода (H2O2) и др. Помимо продуктов восстановления О2, к АФК относят также озон (О3) и синглетный кислород 1О2, то есть кислород, находящийся в возбужденном (синглетном) состоянии [Владимиров, 1998; Осипов, Азизова, Владимиров, 2003]. Все АФК, кроме синглетного кислорода, представляют собой разные химические соединения: молекулы (Н2О2), свободные радикалы (ОН, НО2), ион-радикалы (О2-). Поэтому термин активные формы кислорода следует считать собирательным, он подчеркивает высокую реакционную способность промежуточных продуктов восстановления молекулы кислорода, кислородных радикалов и их прекурсоров.
Радикалы кислорода образуются в ходе процессов, связанных с транспортом электронов по дыхательной цепи. В обычных условиях на генерацию АФК расходуется от 1 до 5% потребляемого кислорода. Однако эта величина может существенно возрастать при изменении кислородного бюджета организма – при гипероксии или гипоксии. В результате последовательного восстановления молекулярного кислорода происходит образование супероксидного аниона, перекиси водорода, гидроксильного радикала.
Супероксидный анион-радикал (О2-). Среди кислородных свободных радикалов ему отводят наиболее значительную роль, так как считается, что именно он является родоначальником многих других активных форм кислорода. Супероксидный радикал (СОР) образуется при присоединении одного электрона к молекуле кислорода в основном состоянии [Chen, Warden, Stenken, 2004]. Химическая активность О2- в значительной степени зависит от физико-химического состояния окружающей его клеточной или внеклеточной среды. В водных растворах О2- способен окислять аскорбиновую кислоту, адреналин и тиоловые соединения, выступая как слабый окислитель [Хавинсон, Баринов, Арутюнян 2003]. Значительно более выражены восстановительные свойства супероксидного радикала. В присутствии ионов негемового железа СОР достаточно активно восстанавливает его из трехвалентного в двухвалентное состояние. Это свойство СОР чрезвычайно важно, поскольку двухвалентное железо играет большую роль в образовании агрессивных липидных и гидроксильных радикалов [Владимиров, 1998]. Супероксидный радикал также может восстанавливать содержащие трехвалентное железо комплексы (цитохром с, ферри-ЭДТА) и нитросиний тетразолий [Auchere, Rusnak 2005].
Образование супероксида в организме в основном происходит при работе митохондриальной и микросомальной цепей переноса электронов, в результате «утечки» электронов с восстановленных элементов этих цепей на молекулярный кислород [Осипов, Азизова, Владимиров, 2003], при активации фагоцитирующих клеток крови и тканевых макрофагов [Владимиров, 1998], в ходе энзиматических реакций при действии, так называемых «перекись продуцирующих ферментов», моно-и диаминооксидаз, моно-и диоксигеназ, при окислении гемоглобина и миоглобина, а также любых, склонных к аутоокислению биомолекул: аскорбиновой кислоты, восстановленного глутатиона, биогенных аминов [Хавинсон, Баринов, Арутюнян, 2003].
Супероксиданион-радикал – пусковое звено каскада радикальных реакций, приводящих к возникновению большинства АФК и продуктов перекисного окисления липидов. Он участвует в синтезе хемотаксических пептидов, усиливает митогенстимулированную пролиферацию лимфоцитов, ингибирует действие эндотелиального фактора расслабления, может повреждать мембраны эритроцитов, ингибировать Са-АТФазу, синтез РНК и белка эндотелиальных клеток, окислять белки сыворотки, в тоже время его непосредственная цитотоксичность невелика [Воейков, 2004].
Для регуляции уровня О2- в клетках служит высокоспецифичный фермент-антиоксидант – супероксиддисмутаза (СОД), которая обладает существенной способностью ускорять реакции дисмутации радикала с образованием молекул перекиси водорода и кислорода.[Okado-Matsumoto, Fridovich, 2003]
О2- + О2- + 2Н+ → Н2О2 + О2
Пероксид водорода. Н2О2 не является свободным радикалом. Образование О2- в любой биологической модельной системе сопровождается накоплением Н2О2, образующимся в результате дисмутации (неферментативно или в присутствии супероксиддисмутазы) [Дубина, 2004]. Поэтому в организме повышение концентрации Н2О2 наблюдается при активации процессов, которые связаны с генерацией супероксидного радикала: при состояниях метаболического взрыва фагоцитирующих клеток; при усиленной деятельности митохондриальных и микросомальных электронтранспортных цепей; при повышении активности оксидазных ферментов.
Будучи стабильным продуктом восстановления кислорода, Н2О2 обладает свойствами слабого окислителя. Эти свойства проявляются, в частности, в присутствии ионов металлов с переменной валентностью в восстановленной форме [Осипов, Азизова, Владимиров, 2003], в результате чего образуется высокоактивный гидроксильный радикал:
Н2О2 + Fe2+ → Fe3+ + OH- + OH
В отсутствии каталазы и ионов металлов переменной валентности пероксид водорода довольно стабилен и вследствие своей незаряженной ковалентной структуры воспринимается клеткой, как молекула воды. Благодаря этому Н2О2 может легко проникать в клетки и ткани, при этом наличие нейтральных аддуктов пероксида водорода (например, гистидина) обеспечивает проникновение внутрь клеток даже в присутствии каталазы. Считается, что биологическая активность Н2О2 существенно зависит от её концентрации. Так, при низких (микромолярных) уровнях Н2О2 является относительно слабореактивной. Однако с ростом концентрации агрессивность пероксида водорода увеличивается и при достаточно высоком (миллимолярном) уровне Н2О2 обладает цитотоксическим действием и может вызывать гибель фибробластов и других типов клеток, включая гепатоциты и эндотелиальные клетки. В сублетальных концентрациях пероксид водорода существенно изменяет статус эндотелиальных клеток, что проявляется в ингибировании транспорта анионов через мембрану, увеличении внутриклеточной концентрации Са2+, активации фосфолипаз и фосфоинозитидного обмена, повреждает Сu,Zn-СОД, тем самым снижая антиоксидантную защиту клеток [Меньщикова с соавт., 2006].
Клетки млекопитающих достаточно устойчивы к воздействию пероксида водорода, благодаря наличию глутатионпероксидазной и каталазной ферментативных систем, первая из которых эффективно работает при малых концентрациях перекиси, вторая – при высоких.
Гидроксильный радикал (НО∙). Одноэлектронное восстановление Н2О2 приводит к образованию гидроксильных радикалов, обладающих чрезвычайно высокой реакционной способностью. Разложение Н2О2 в присутствии ионов двухвалентного железа является основным путем образования НО∙ (реакция Фентона) [Владимиров, Арчаков, 2003]:
H2O2 + Fe2+ → Fe3+ + OH- + HO∙
Другой путь образования гидроксильного радикала – это реакция разложения гипохлорита, которая также протекает с участием Fe2+ [Осипов, Якутова, Владимиров 2003; Якутова с соавт., 2004]:
НОCl + Fe2+ → HO + Cl- + Fe3+
Установлено, что образование гидроксильного радикала возможно при разложении гипохлорита также и железонезависимым путем
HOCl +O2- → HO + Cl- + O2-
Вследствие высокой химической активности время жизни ОН-радикалов в клетке составляет около 10-9 с, а расстояние, которое они успевают пройти за это время от места их образования, не превышает 100 нм. Таким образом, клеточная топография повреждающего действия ∙ОН-радикалов и, как следствие этого, характер эффекта повреждения будет зависеть от места их образования. Например, возникновение ОН-радикалов вблизи молекулы ДНК с высокой вероятностью приведет к модификации основания и взрыву одной из цепей ДНК [Kira, Sato, Inoue 2003].
Обладая наиболее высоким в живой природе редокс-потенциалом (Е0=+2.7В), и будучи вследствие этого чрезвычайно агрессивным, ∙ОН оказывает действие практически на любую биологическую молекулу. Но наибольший ущерб клетке наносят его реакции с ДНК, белками и полиненасыщенными жирными кислотами внутриклеточных и плазматических мембран, что определяет сильнейшее мутагенное и цитотоксическое действие гидроксильного радикала [Melov, 2003].
Важно отметить, что в организме нет специальных ферментативных систем, обладающих способностью инактивировать гидроксильный радикал. Низкомолекулярные соединения, такие как урацил, мочевая кислота, салицилаты, глюкоза, диметилсульфоксид, обладают способностью ингибировать ∙ОН-радикал только при достаточно высоких концентрациях [Зенков, Ланкин, Меньщикова, 2004]. Таким образом, при целом ряде патологических состояний, сопровождающихся избыточным образованием АФК и, соответственно, гидроксильного радикала, организм становится практически беззащитным перед повреждающим действием этого соединения. Предотвращение повреждений клеточных структур осуществляется только за счет снижения концентрации радикалов предшественников ОН, в частности, супероксиданион-радикала и пероксида водорода.
Синглетный кислород (1О2). Образуется при изменении спина одного из электронов π-орбитали в молекуле кислорода. Источником синглетного кислорода являются реакции фотосенсибилизированного окисления биологических субстратов [Осипов, Азизова, Владимиров, 2003]. При нефотохимических реакциях образование 1О2 возможно в результате неферментативной дисмутации супероксидных радикалов, протекающей с образованием перекиси водорода в присутствии ионов металлов с переменной валентностью:
О2- + О2- + Н2 → Н2О2 + 1О2
А также при взаимодействии некоторых сильных окислителей, например гипохлорита с Н2О2 и ферментативно – в реакциях восстановления цитохрома с [Maiorino, Zamburlini, Roveri, 2005]. В отличие от молекулы О2, синглетный кислород обладает высокой химической активностью, особенно по отношению к молекулам, содержащим участки повышенной электронной плотности (ненасыщенные жирные кислоты, ароматические аминокислоты, основания). Типичным для 1О2 являются реакции взаимодействия с двойной связью. Это свойство 1О2 особенно важно для инициирования перекисного окисления ненасыщенных липидов в биологических мембранах [Меньщикова с соавт., 2006]. Кроме того, синглетный кислород, как и гидроксильный радикал, вызывает окисления сульфгидрильных групп в белках, декарбоксилирует аминокислоты, расщепляет нуклеиновые кислоты [Eisenberg, Taylor, Guerrero 2002]. Энергичное образование 1О2 в клетке может приводить к её повреждению или даже к гибели [Осипов, Азизова, Владимиров, 2003].
Одним из наиболее эффективных гасителей синглетного кислорода в клетке является β-каротин, одна молекула которого способна потушить около 1000 его молекул прежде, чем он подвергнется окислительной деструкции [Владимиров, Арчаков, 2003].
Гипохлорит (НОСl). Хлорноватистая кислота – сильнейший окислитель, образуется в нейтрофилах при участии гем-содержащего цитоплазматического фермента миелопероксидазы [Klebanoff, 2006]. Миелопероксидаза окисляет ионы солей хлористоводородной кислоты, Сl- в присутствии Н2О2 в ходе реакции:
Н2О2 + Сl- + Н+ → НОСl + Н2О
НОСl не является свободным радикалом, но выступает как один из наиболее сильных окислителей.
НОСl атакует простейшие амины, сульфгидрильные группы в белках и хлорированные пуриновые основания в ДНК [Хавинсон c соавт., 2003]. НОСl может взаимодействовать с замещенными арил-аминами (например, с анилином, 1-нафтиламином и 1-нафтолом) даже при физиологических уровнях, образуя долгоживущие продукты, которые связываются с ДНК и являются генотоксичнымим для клеток человека [Осипов, Азизова, Владимиров, 2003].
Похожие работы
... о динамике изменения активности ферментов. ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Исследование активности основных карбоксипептидаз в тканях крыс разного возраста, испытавших пренатальное воздействие этанола 3.1.1. Исследование активности карбоксипептидазы Н в тканях пренатально алкоголизированных крыс разного возраста Согласно данным дисперсионного анализа пренатальное воздействие ...
... узловым зобом. //Материалы V Российского Форума «Мать и Дитя», Москва,2003, 44–45 20. Габелова К.А., Арутюнян А.В., Зубжицкая Л.Б. Фиксированные иммунные комплексы и NO-синтетазная активность плаценты при гестозе // Вестн. Росс. Ассоц. акуш.-гин. – 2000. – №1. – С. 22-24. 21. Гармашева Н.Л., Константинова Н.Н. Патофизиологические основы охраны внутриутробного развития человека. Л.,1985.,159 ...
... при данной патологии достигает 32‰ и превосходит общий показатель в 2 раза. Эта проблема чрезвычайно актуальна, так как обуславливает серьезные последствия. У большинства женщин, перенесших гестоз, формируется хроническая патология почек, гипертоническая болезнь и эндокринные нарушения. А дети от таких матерей, как правило, имеют нарушения физического и психоэмоционального развития, при этом ...
... ферментов, уменьшается также разрушение фосфолипидов как источников субстратов для перекисного окисления). Во многих ситуациях использование антиоксидантной активности антигипоксантов является более рациональным, чем применение антиоксидантов, поскольку профилактика заболевания (в данном случае предотвращение образования свободных радикалов антигипоксантами) обычно эффективнее его лечения ( ...
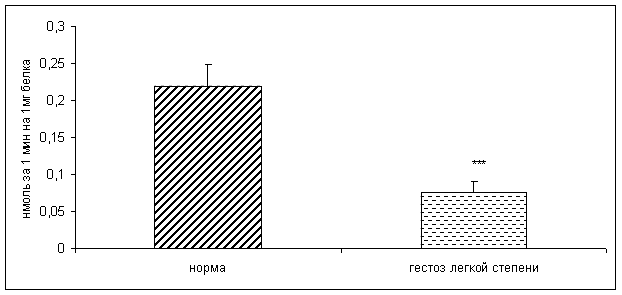
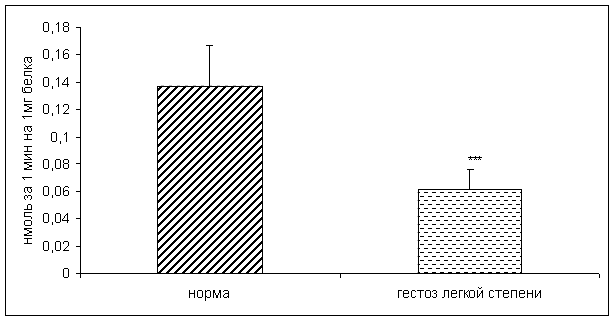
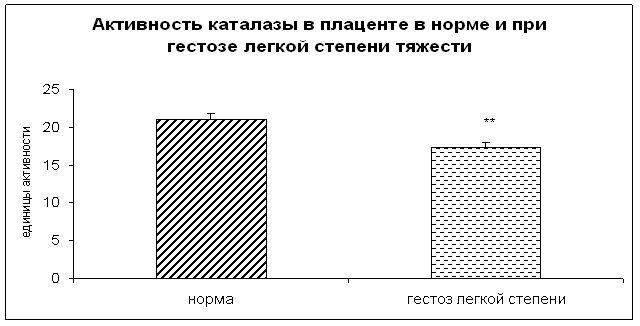
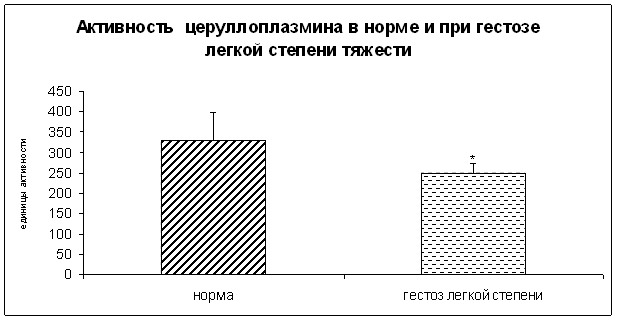

0 комментариев