Навигация
Этиловый спирт в фармацевтической промышленности
МИНИСТЕРСТВО ОХРАНЫ ЗДОРОВЬЯ УКРАИНЫ
ДОНЕЦКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМ. ГОРЬКОГО
кафедра медицинской и фармацевтической химии
КУРСОВАЯ РАБОТАПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
на тему: «Этиловый спирт в фармацевтической промышленности»
Выполнила:
Студентка 4 курса, 5 группа
Россоловская А. П.
Научный руководитель: ассистент каф.
медицинской и фармацевтической
химии Романова Л.А.
Донецк 2006г.
Содержание
Вступление
1. Этанол
2. Этиловый спирт в фармацевтической промышленности
3. Хранение спирта и спиртосодержащих препаратов
Заключение
Вступление
Органические растворители объединяют группу химических соединений, находящихся обычно в жидкой фазе при температуре 0-250 °C, химически относительно инертных и отличающихся высокой испаряемостью. В химико-фармацевтической промышленности их используют в качестве растворителей и разбавителей, при экстрагировании, как реагенты в химических процессах. [2]
Стабилизаторы химических веществ используются в процессе изготовления и длительного хранения лекарственных препаратов, к ним так же относятся и органические растворители. Этот вид стабилизации имеет большое значение для лекарственных форм, подвергающихся различным видам стерилизации, особенно термической. Стабилизаторы этой группы угнетают процессы гидролитического или окислительно-восстановительного разложения лекарственных веществ. Противомикробные стабилизаторы (консерванты) используют для предохранения лекарственных препаратов от микробного воздействия. [9]
Стабильность является важным показателем качества лекарственных средств, поскольку обеспечивает сохранность их терапевтических или профилактических свойств в системе распределения. С одной стороны она зависит от внешних факторов: температуры и влажности окружающего воздуха, условий обращения с препаратами, с другой – от химических и физических свойств фармацевтических субстанций, от состава (прописи), свойств вспомогательных веществ и условий изготовления дозированных лекарственных форм, особенностей их упаковочно-укупорочной системы. [1] Таким образом, стабильность препарата – это способность биологически активного вещества сохранять физико-химические, медико-биологические и фармакологические свойства в течение определенного времени с момента выпуска, называемого сроком хранения, предусмотренного нормативно-технической документацией. [9], [3]
Стабилизаторы могут замедлять или ускорять нежелательные химические реакции, создавать определенные значения pH растворов, повышать растворимость лекарственных веществ или удерживать их во взвешенном состоянии. Выбор стабилизатора, в первую очередь зависит от природы лекарственных веществ.
Среди требований, предъявляемых к стабилизаторам, можно отметить: терапевтическую индифферентность, хорошую растворимость в растворителе, эффективность в применяемых концентрациях, химическую чистоту и доступность. [3]
Рассмотрим один из органических растворителей, который используется в качестве стабилизатора для лекарственных средств – этиловый спирт.
1. Этанол
Химическое название: этиловый спирт, метилкарбинол, винный спирт, часто просто «спирт».
Формула:
С2H5OH или CH3—CH2—OH.
Молекула этанола:
 [4]
[4]
Фармакологическая группа: Антисептики и дезинфицирующие средства.
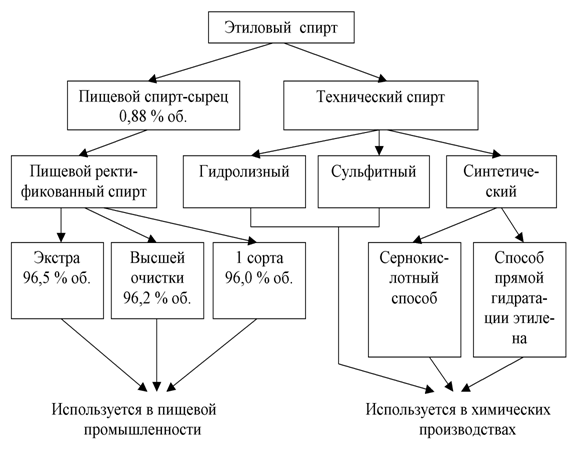
Характеристика: Прозрачная бесцветная подвижная, летучая жидкость с характерным спиртовым запахом и жгучим вкусом. [12] Различают этиловый спирт 95, 90, 70 и 40 % -н ы й. Если концентрация спирта не указана, предусматривают 95 % -н ы й спирт. [6]
Свойства: Легко воспламеняется, горит синеватым бездымным пламенем.
| Молекулярная масса | 46,069 а.е.м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается во всех соотношениях с бензолом, водой, глицерином, диэтиловым эфиром, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | 1,3611 (температурный коэффициент показателя преломления 4,0•10-4, справедлив в интервале температур 10—30 °C) |
[4]
Фармакология: Фармакологическое действие – антисептическое, дезинфицирующее, местнораздражающее. Коагулирует белки. Активен в отношении грамположительных и грамотрицательных бактерий и вирусов. Наибольший антисептический эффект на коже и слизистых достигается при использовании 70% растворов. Обладает дубящим действием на кожу и слизистые оболочки. [12]
При нанесении алкоголя на кожу или слизистые оболочки вначале ощущается холод, а затем жжение и появляется гиперемия. Чувство холода быстро сменяется жжением, а затем угнетением, что ведет к уменьшению болезненности и ослаблению чувствительности.
На слизистые оболочки алкоголь действует сильнее, чем на кожу. В слабых концентрациях (2—3%) он вызывает гиперемию слизистой оболочки ротовой полости и саливацию, а в желудке—гиперемию, умеренное жжение, усиление секреции желез. Переваривающая сила желудочного сока при слабых концентрациях алкоголя (1—2%) усиливается, а при больших концентрациях (20—30%) резко ослабевает. Усиление секреции желудочного сока наиболее значительно при 5—10%-ной концентрации алкоголя; при 20%-ной концентрации одновременно с понижением секреции увеличивается отделение слизи. Двигательные функции желудка и кишечника существенно не изменяются, и только от больших доз алкоголя может наступить замедление перистальтики.
В концентрированных растворах (70—90%) алкоголь вызывает сильное раздражение с выделением большого количества слизи, причем вполне возможно омертвение поверхностных слоев слизистой оболочки. При продолжительном употреблении алкоголя развивается гастроэнтерит с нарушением секреторной и моторной деятельности и резким ослаблением процессов пищеварения. [6]
Получение:
1. Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих сахара (свёкла и т. п.), в присутствии ферментов, например, зимазы – фермента дрожжей. [4]
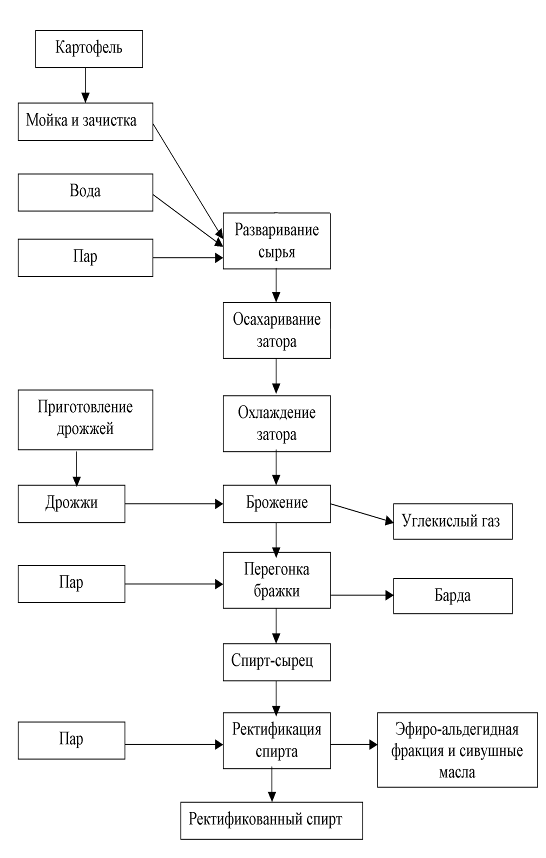
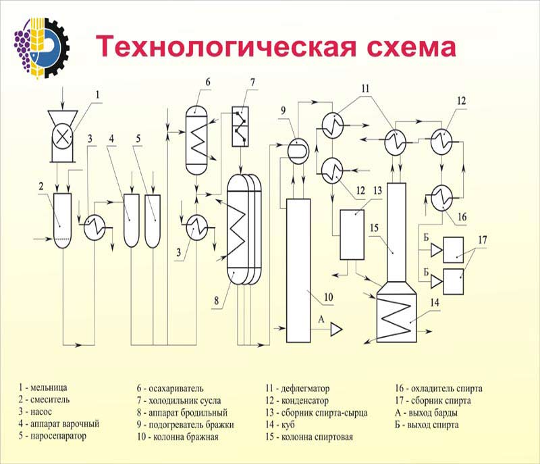
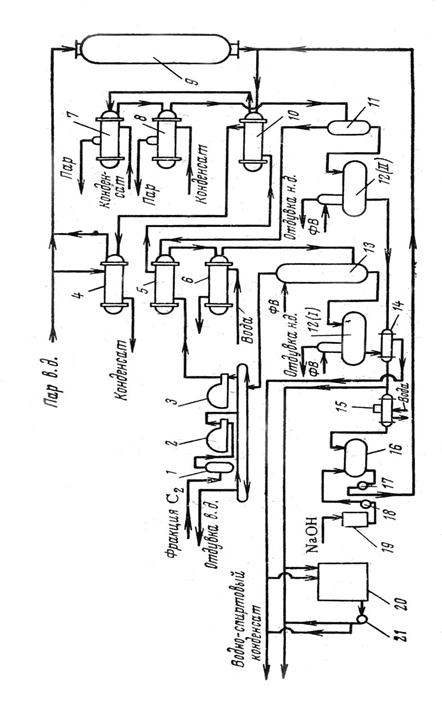
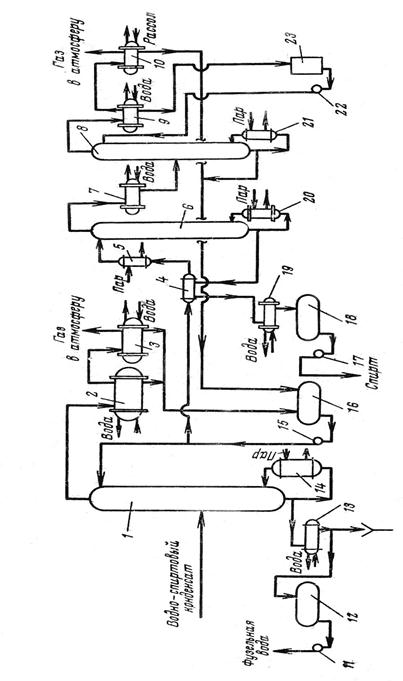
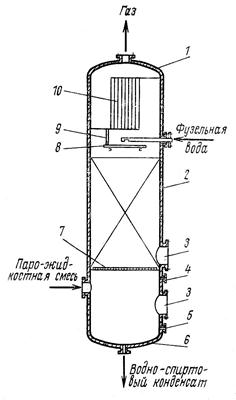
Этиловый спирт – в фармацевтической промышленности применяется спирт, получаемый путем сбраживания крахмалсодержащего сырья – в основном, картофеля. Сброженное сусло содержит 8 – 10% спирта. Путем перегонки из нее получается спиртовой сырец, содержащий до 88% спирта. В спирте – сырце всегда содержатся примеси – 0,3 – 0,4%, которые ухудшают вкусовые качества спирта, придают ему неприятный запах и которые очень вредны для здоровья человека. К ним относятся летучие органические кислоты (уксусная, молочная, масляная); сивушные масла (высшие спирты – пропил, изобутил); эфиры (уксусно-этиловый, масляно-этиловый) и альдегиды (уксусный и другие). В связи с этим спирт - сырец подвергается многократной перегонки называемой ректификацией, в результате которой содержание примесей уменьшается в 300 раз. При этом дополнительно происходит укрепление спирта до 95 – 96%. [7]
Качество спирта-ректификата регламентируется ГФ Х и ГОСТом 5962-51. [3]
Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, древесины и прочее. Реакция эта довольно сложна, её схему можно выразить уравнением:
C6H12O6 → 2C2H6OH + 2CO2
Для получения этилового спирта издавна пользуются различными сахаристыми веществами, например, виноградным сахаром, или глюкозой, которая путем "брожения", вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт.
С6Н12О6 ® 2С2Н5ОН + 2СО2
В результате брожения получается раствор, содержащий не более 20% этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
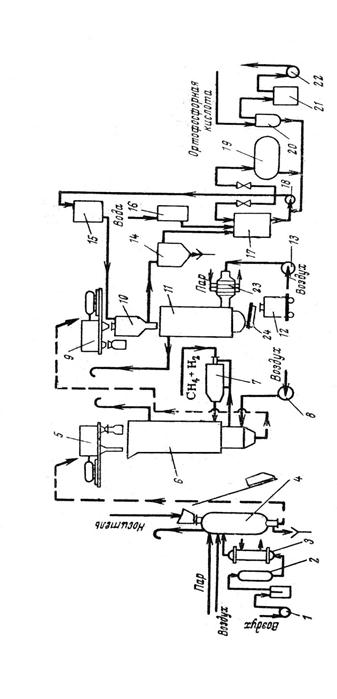
2. В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
а) прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH
б) гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH
(образование этилсерной кислоты)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Эта реакция осложняется образованием диэтилового эфира. [4]
Применение: Для изготовление настоек, экстрактов и лекарственных форм для наружного применения — обтираний, компрессов. [12] Алкоголь входит в состав многих противочесоточных линиментов и употребляется как растворитель и вспомогательное средство при изготовлении фармацевтических препаратов. [6] Как обеззараживающее и подсушивающее средство, растворитель для лекарственных средств. Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Растворитель для пищевых ароматизаторов.
Этанол может использоваться как топливо. Широко применяется как растворитель в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях. [4]
Этиловый спирт, применяемый для технических целей, специально загрязняют дурно пахнущими веществами. Такой спирт называют денатуратом (для этого спирт подкрашивают, чтобы отличить его от чистого спирта).
Как наркотическое средство алкоголь назначают внутрь и внутривенно. Как болеутоляющее, противобродильное и антисептическое средство его назначают при остром расширении желудка, сильных бродильных процессах, судорожных коликах и атонии кишечника, а также как болеутоляющее средство при воспалении мозга, судорожном кашле, при чуме собак. [6]
Противопоказания: Гиперчувствительность.
Побочные действия: Угнетение ЦНС (нейротоксичный и психотропный эффект): действие на нервные стволы и тела нейронов. В последствии наблюдается снижение уровня психической активности, интеллекта, скорости психомоторных процессов, различные вегетативные нарушения. [2], [12]
Похожие работы
... и другом случае одинаков и может быть представлен следующей схемой: гексозы—фосфорные эфиры—гексоз-фосфотриозы—фосфоглицериновая кислота—пировиноградная кислота—уксусный альдегид—этиловый спирт. В основе производства этилового спирта из клубней картофеля лежат два биохимических процесса: ü гидролиз (осахаривание) крахмала, содержащегося в сырье, и сбраживание образующихся сахаров в спирт ...
... процесса, более высокий выход спирта. Недостатками прямой гидратации является частая замена катализатора и использование более дорогих концентрированных этиленовых фракций. Процесс синтеза этилового спирта прямой гидратацией этилена технически более прогрессивен, чем сернокислотной гидратацией, поэтому он получил значительно большее распространение в промышленности. Характерной особенностью ...
... от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта: 12 34 1 2 Метилпропанол – 2 Бутанол - 2 СН3 – СН – СН2 –СН3 Н3С – С – СН3 ОН ОН Число структурных изомеров в ...
... объёмы внешнеэкономических операций в области машин и оборудования, товаров химической промышленности, причём возобновляется международное сотрудничество с Россией и странами СНГ. Для Украины очень большое значение имеют внешнеэкономические связи со странами СНГ. Сложившаяся в предыдущие годы тенденция относительно устойчивого развития экономики государств – участников СНГ и благоприятная ...




0 комментариев