Федеральное агентство по здравоохранению и социальному развитию
Саратовский медицинский колледж Росздрава
Контрольная работа
Учебная дисциплина Фармацевтическая химия
2009 год
1. Теоретическая часть
Методы количественного анализа производных пиразола
1) Йодометрическое определение, обратный метод в присутствии ацетата натрия, спирта или хлороформа (антипирин).
2) Йодометрическое определение, прямое титрование (анальгин)
3) Кислотно-основное титрование в неводной среде (амидопирин, бутадион)
Методы установления подлинности никотинамида, никодина, изониазида
Общие реакции на замещенный цикл пиридина.
1. Пиролиз. При нагревании кристаллических веществ, производных пиридина с карбонатом натрия, образуется пиридин, обнаруживаемый по характерному запаху.
2. Цветная реакция с лимонной кислотой и уксусным ангидридом. При нагревании препарата с кристаллической лимонной кислотой и уксусным ангидридом возникает вишневое окрашивание.
Никотинамид. 1) Щелочной гидролиз при нагревании. Образуется аммиак.
2) Нагревание безводного препарата с безводным натрия карбонатом. Образуется пиридин, обнаруживаемый по характерному запаху.
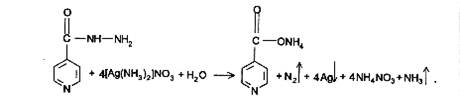
Изониазид. 1) Реакция окисления изониазида аммиачным раствором серебра нитрата и меди сульфата. Если реакцию проводить в нейтральной среде, сначала образуется комплексная соль, а затем (при нагревании) процесс переходит в окислительно-восстановительный с выделением металлического серебра.
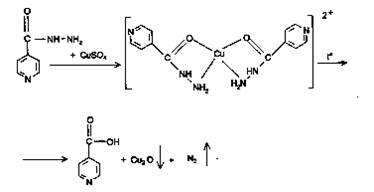
2) Реакция с меди сульфатом происходит в 2 этапа. За счет кислотных свойств изониазида сначала образуется комплексная соль голубого цвета. При последующем нагревании происходит окисление препарата с получением желто-зеленого, а затем грязно-желтого окрашивания с одновременным выделением пузырьков газа.
Производные хинолина. Его формула, источники получения
Хинолин (бензопиридин) — конденсированная система, образованная ароматическим бензольным ядром и пиридиновым циклом:
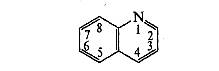
Хинолин представляет собой основание (рКа = 4,9), более сильное, чем анилин (рКа = 4,6), и более слабое, чем пиридин (рКа = 5,2). Как основание хинолин протонируется по атому азота, образуя с минеральными кислотами ограниченно растворимые и устойчивые соли.
Хинолин обладает бактерицидным, антисептическим и жаропонижающим действием, но в медицине не применяется из-за высокой токсичности (низкого значения терапевтического индекса). В настоящее время синтезированы многочисленные производные хинолина с различной фармакологической активностью и среди них хинин, являющийся противомалярийным средством.
К числу природных соединений, производных хинолина, относится большая группа алкалоидов, содержащихся в растениях семейства рутовых, мареновых (в основном в двух родах этого семейства: парнолистниковых, сложноцветных).
Хинное дерево произрастает в Южной Америке (дикорастущее) и культивируется в Индии. В коре этих растений (в «хинной корке») насчитывается более 20 алкалоидов (их содержание колеблется от 2 до 15%). Хинная корка известна как противомалярийное средство с начала XVII в.
Наибольшее значение имеют 4 алкалоида, выделенные из хинной корки, - хинин, хинидин, цинхонин и цинхонидин. Их структурной основой служат две гетероциклические системы: хинолин и хинуклидин (конденсированная система, состоящая из двух пиперидиновых циклов). Эти циклы связаны между собой вторичной спиртовой группой.
Источник получения хинина и его солей — хинная корка «аптечная» и «фабричная». Первую получают главным образом из Cinchona Succiruba, где содержится около 2 % хинина. «Фабричные корки» получают в основном из Cinchona Ledgeriana и Cinchona Calisaya, от 7 до 15 %. Поскольку в растительном сырье алкалоиды находятся в виде солей хинной кислоты, измельченную хинную корку обрабатывают смесью известкового молока со щелочью. Образовавшиеся основания извлекают бензолом: хинин отделяют в виде малорастворимого сульфата, который очищают дальнейшей перекристаллизацией.
Хинина сульфат вновь переводят в основание. Из основания получают хинина дигидрохлорид и гидрохлорид.
Напишите формулу дротаверина гидрохлорида, укажите свойства, применение, условия хранения
Дротаверина гидрохлорид (Но-шпа) – Drotaverini hydrochloridum (No-spa),
1-[(3,4 – диэтоксифенил)метилен]-6,7-диэтокси-1,2,3,4-тетрагидроизлхинолина гидрохлорид.
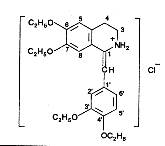
Зеленовато-желтый кристаллический порошок со слабым запахом. Раствори в оде и спирте.
Действие: Вазодилататор (сосудорасширяющее средство). Миотропный спазмолитик. Применяется при спазмах желудка и кишечника, спазматических запорах, приступах желчно-каменной болезни, язвенной болезни желудка и двенадцатиперстной кишки.
Лекарственные формы: таблетки, раствор для инъекций.
Хранение. Список Б
Отличия рибофлавина от рибофлавина мононуклеотида
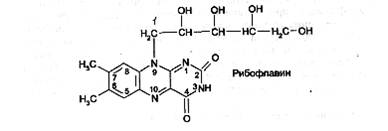
Витамин В2 (рибофлавин) представляет собой 6,7-диметил-9-(В-1' -рибитил) -изоаллоксазин:
Кроме рибофлавина, в медицинской практике применяют его коферментную форму - рибофлавина мононуклеотид: 7,8-диметил-10-(1-О-рибитил)-изоаллоксазин-5'-фосфат натрия, или рибофлан – 5 – монофосфат натрия:
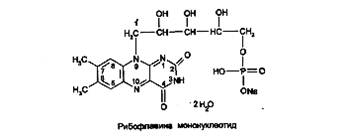
Рибофлавин и рибофлавина мононуклеотид - желто-оранжевые кристаллические порошки со слабым специфическим запахом. Мало растворимы в воде, практически нерастворимы в спирте, эфире, хлороформе, растворимы в растворах щелочей. Водные растворы препаратов имеют желтовато-оранжевый цвет с интенсивной флюоресценцией в УФ-свете.
Являются лабильными химическими веществами, легко разлагаются на свету.
Рибофлавин и его производные обладают характерными спектрами поглощения в УФ-области и оптической активностью в щелочной или слабо щелочной среде (в кислой и нейтральной средах оптически неактивен). При определении оптической активности рибофлавина в присутствии 0,1 М спиртового раствора калия гидроксида величина удельного вращения регламентируется в пределах от -110° до -130°. В среде 0,1 М раствора натрия гидроксида величина удельного вращения составляет -170°. Если к щелочному раствору препарата добавить раствор кислоты борной в количестве, необходимом для нейтрализации щелочи, поменяется направление оптической активности, а величина удельного вращения возрастет до +370°.
Рибофлавин и его производные как полифункциональные вещества обладают определенными кислотно-основными и восстановительными свойствами, а также способностью к гидролитическому расщеплению.
Рибофлавин и его производные — амфотерные соединения. Кислотные свойства связаны главным образом с наличием имидной группы. Очень слабыми кислотными свойствами обладают и спиртовые гидроксильные группы рибитильного остатка. За счет амид-ного фрагмента молекулы рибофлавина образуют комплексные нерастворимые соединения с солями А§+, Со2+, Нg2+ и с солями других тяжелых металлов.
Как основание рибофлавин растворяется в ледяной уксусной кислоте и минеральных кислотах, образует осадки с общеалкалоидными осадительными реактивами.
Окислительно-восстановительные свойства рибофлавина и его производных связаны с наличием сопряженной изоаллоксазиновой системы. Восстановление рибофлавина приводит к образованию бесцветного лейкорибофлавина, который может окисляться до характерно окрашенного рибофлавина.
Химичеcкое строение рибофлавина обусловливает различные типы окисления в зависимости от условий проведения процесса. Рибофлавин окисляется при действии различных окислителей (калия перманганат, калия дихромат и др.).
При окислении препарата концентрированной Н2SО4 образуется продукт красного цвета.
При действии на препарат раствора периодата натрия окисляется рибитильный фрагмент молекулы (реакция Малапрада). Данная реакция лежит в основе одной из методик количественного определения лекарственного вещества:
Выделившуюся в результате реакции кислоту муравьиную оттитровывают (потенциометрически или в присутствии индикатора) стандартным раствором натрия гидроксида.
По другой методике после действия периодатом к раствору прибавляют натрия йодид и кислоту серную. Выделившийся в результате реакции иод оттитровывают стандартным раствором натрия тиосульфата.
Разбавленный раствор рибофлавина в воде имеет яркую зеленую флюоресценцию при подсвечивании в УФ-свете, исчезающую при добавлении как раствора кислоты, так и раствора щелочи.
Добавление гидросульфита натрия приводит к исчезновению и флюоресценции, и окрашивания.
При действии кислоты и УФ-света образуется люмихром (производное изоаллоксазина), а при действии щелочи — люмифлавин (производное изоаллоксазина):
Количественное определение.
Химическая структура рибофлавина позволяет применять для его количественного определения различные методики химического и физико-химического анализа:
1) УФ-спектрофотометрию (Д.тах = 267 нм);
2) спектрофотометрию в видимой области (А,тах = 444 нм);
3) флуориметрические методики;
4) периодатное окисление (реакция Малапрада);
5) метод ацетилирования.
2. Ответ на тестовые задания
8 – В
17 – В
24 – Б,В
33 – В
44 – Г
56 – Б
67 – А
74 – В
85 - А
3. Витамины пиримидинового ряда (тиамин)
Введение
Термин «витамин» (буквально «амин жизни») предложен Функом, выделившим фракцию из водного экстракта рисовых отрубей, обладающую выраженными основными свойствами (1911—1912). В 1934 г. Вильяме из 1 т рисовых отрубей выделил несколько граммов витамина В12 а в 1936 г. доказал его строение.
Организм животных и человека нуждается в поступлении витамина В1 (тиамина) извне с продуктами питания. Тиамин содержится в отрубях хлебных злаков (особенно в рисовых отрубях), дрожжах.
Тиамин, всасываясь из кишечника, фосфорилируется и превращается в тиамин-пирофосфат (дифосфат). В этой форме он является коферментом декарбоксилаз, участвующих в окислительном декарбоксилировании кетокислот (пировиноградной, α-кето-глугаторовой).
Тиамин является двукислотным основанием и поэтому образует 2 рода солей — хлориды и гидрохлориды (бромиды и гидробромиды). Фосфотиамин и кокарбоксилаза - сложные эфиры тиамина и фосфорной кислоты, т.е. коферменты.
Эти препараты — белые порошки с характерным запахом, хорошо растворимы в воде, имеют кислую реакцию среды (как соли слабых органических оснований с сильными минеральными кислотами).
Бенфотиамин — синтетический лекарственный препарат, близкий по строению к тиамину и его коферментным формам. В отличие от препаратов-предшественников практически нерастворим в воде.
1. Стабильность. Реакции подлинности
Тиамин и его производные принадлежат к очень неустойчивым соединениям витаминов. Так, тиамин под действием кислорода воздуха превращается в тиохром и тиаминдисульфид.
Разрушение тиамина вызывают также восстановители, сильно кислая или щелочная среда, свет (особенно УФ-лучи), повышение температуры. В растворах тиамина значение рН не должно превышать 4. За пределами оптимальной области рН повышение температуры больше способствует разложению препарата, чем присутствие кислорода.
Реакции подлинности.
Специфическая общегрупповая реакция подлинности тиамина и его препаратов — образование тиохрома. Сущность испытания заключается в постепенном окислении тиамина в щелочной среде (всего затрачивается 3 эквивалента щелочи) с образованием трицикличе-ского производного тиамина (тиохрома), способного давать синюю флюоресценцию в среде бутанола или изоамилового спирта при УФ-облучении.
Реакция идет в несколько стадий. На 1-й стадии происходит частичная нейтрализация препарата как соли галогеноводородной кислоты (1-й эквивалент щелочи):
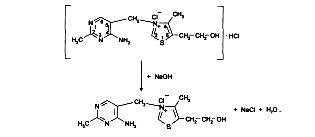
На 2-й стадии образовавшийся тиамина хлорид нейтрализуется (2-м эквивалентом щелочи) как соль четвертичного аммониевого основания до тиамина гидроксида:
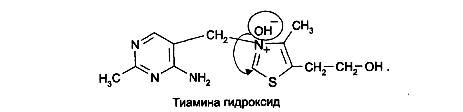
Образовавшийся тиамина гидроксид изомеризуется в псевдооснование тиамина:
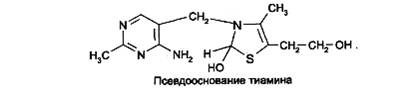
При действии 3-го эквивалента щелочи происходит раскрытие тиазолового кольца с образованием тиольной формы тиамина, которая при дегидратации превращается в циклическую форму тиаминтиола. Окисление последнего приводит к образованию тиохрома:
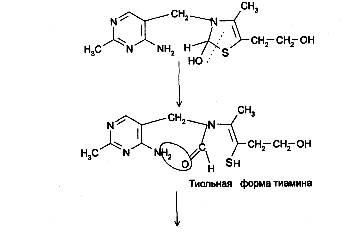
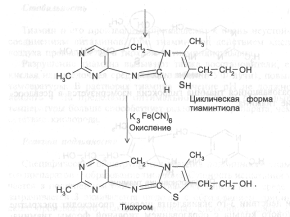
Тиохром образуют также фосфотиамин и кокарбоксилаза, но не бенфотиамин.
Как соли азотистых оснований препараты тиамина взаимодействуют с общеалкалоидными осадительными реактивами (реактивы Вагнера, Драгендорфа, Майера, гетерополикислотами — кремневоль-фрамовой, пикриновой, танином и др.) с образованием характерно окрашенных осадков.
2. Методы количественного определения
Химическая структура лекарственных веществ, производных витамина В1, позволяет применить различные методы их химического и физико-химического количественного определения:
1)кислотно-основное титрование (в водной и неводной средах);
2)осадительное титрование (аргентометрия);
3)физико-химические методики (спектрофотометрические, ФЭК, нефелометрические);
4)гравиметрия.
Тиамина бромид количественно определяют гравиметрически в виде комплекса препарата с кремневольфрамовой кислотой.
Для количественного определения тиамина бромида применяют также аргентометрическую методику. Определение проводят в 4 стадии. На 1-й стадии осуществляют нейтрализацию тиамина бромида как NН- кислоты 0,1 М раствором натрия гидроксида.
Далее (2-я стадия) готовят индикатор — железа (III) тиоцианат. Для этого к определенному объему 0,1М раствора аммония тиоцианата добавляют раствор железоаммониевых квасцов.
На 3-й стадии сумму бромидов оттитровывают 0,1М раствором серебра нитрата.
На заключительной, 4-й стадии оттитровывают полученный на 2-й стадии железа (III) тиоцианат 0,1 М раствором серебра нитрата.
Объем 0,1 М раствора серебра нитрата, пошедшего на титрование непосредственно тиамина бромида, рассчитывают по разнице между общим объемом титранта и объемами растворов натрия гидроксида и аммония тиоцианата.
Количественное определение тиамина хлорида проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты (как соли двукислотного основания). Для связывания галогенид-иона добавляют ртути (II) ацетат.
Заключение
Недостаток тиамина ведет к нарушению углеводного обмена, а затем и к другим нарушениям метаболизма (в мышечных тканях накапливаются пировиноградная и молочная кислота), функции нервной системы (проявляются полиневритом и мышечной слабостью), к заболеванию бери-бери, парезам, параличам, кожной патологии.
Применяют препараты тиамина при невритах, невралгиях, радикулите, кожных заболеваниях, а также для профилактики и лечения авитаминоза В1.
Потребность человека в тиамине составляет примерно 1 мг в день.
Препараты витамина В1: тиамина бромид (хлорид) и его коферментные формы — кокарбоксилазы гидрохлорид, фосфотиамин и бенфотиамин.
В настоящее время препараты тиамина получают синтетически.
Список литературы
1) www.medkurs.ru
2) www.xumuk.ru
3) Фармацевтическая химия: учебное пособие / под ред. А.П. Арзамасцева. – 3 –е изд., испр. – М.: ГЭОТАР – Медиа, 2006.
4) Глущенко Н.Н., Плетнева Т.В., Попков В.А, Фармацевтическая химия – М.: Академия, 2004.
5) Сборник приказов для фармацевта – 2002.
Похожие работы
... активность тиамина и некоторых его производных. За последние 20 лет наряду выяснением механизма основных реакций, в которых каталитическую роль играет ТДФ, стали накапливаться данные о высокой биологической активности других некоферментных производных тиамина. Отчетливо наметились два направления исследований: возможное, участие различных фосфорных эфиров витамина в активном переносе ...
... . Имея в своём составе двойные связи, они могут принимать участие в переносе, как водорода, так и кислорода в тканях и клетках. В опытах на крысах было установленно участие витамина А в обмене аминокислот содержащих серу. При введении животным меченого метионина наблюдалось отложение радиоактивной серы в тканях А-авитаминозных животных в значительно больших количествах по сравнению с нормальными. ...
... два водорода, переходит в нафтогидрохиноновую. Эта реакция в присутствии кислорода воздуха обратима. Реакция восстановления нафтохинонов (окрашенных веществ) сопровождается их обесцвечиванием. Витамины К способны непосредственно взаимодействовать с кислородом, присоединяя его в положении 2, 3 молекулы нафтохинона. Продуктом окисления является эпоксид: Эпоксид витамина К1 Эпоксиды ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
0 комментариев