Навигация
Строение, свойства и биологическая роль биотина и тиамина
Биотин
Исторические сведения
Более 60 лет назад Wilidiers показал, что для обеспечения жизнедеятельности Дрожжевых клеток в искусственную питательную среду необходимо внести какое-то органическое вещество (фактор роста). Этот фактор роста он предложил назвать «биосом» (от греч. «bios»—жизнь). Изучение природы «биоса» привело к заключению, что «биос» представляет собой комплекс факторов роста, отличающихся друг от друга по физико-химическим свойствам. Экстракты, содержащие «биос», при обработке уксуснокислым свинцом разделялись на две биологически активные фракции. Фракция, выпадавшая в осадок, была названа «биос I», а фракция, остававшаяся в растворе, получила название «биос II». В 1928 г. «биос I» выделен из чая и идентифицирован как инозит. В 30-х годах «биос II» подвергался тщательному изучению и был разделен на две фракции—«биос IIа» и «биос IIв»—путем адсорбции последней на животном угле.
Kogi предложил назвать «биос IIв» прото «биосом II» или биотином, а фракцию «биос IIа»—«биосом III». В 1935—1936 гг. Kogi и Tonnies впервые выделили кристаллический биотин из желтка яиц. Для этой цели они использовали 250 кг желтков яиц и получили 100 мг биотина с температурой плавления 148°. Позже было найдено, что некоторые виды Rhizobium требуют для своего роста какое-то органическое вещество, присутствующее в культурах Azotobacter в гидролизованных дрожжах и других естественных источниках. Это вещество получило название «коэнзим Р». Сравнительное изучение действия на рост Rhizobium «коэнзима Р» и кристаллического препарата биотина показало, что оба вещества обладают одинаковыми биологическими свойствами.
В 1931 г. Gyorgy (Gyorgy, 1954) в опытах на крысах обнаружил, что ряд естественных источников содержит вещество, предохраняющее животных от заболевания, вызываемого избытком белка яиц, и предложил назвать его витамином H. 1939 г. он получил препарат витамина Н из печени. В процессе изучения физико-химических свойств препаратов витамина Н и распространения его в естественных источниках возникла мысль об идентичности витамина Н и биотина. Экспериментальная проверка показала, что наиболее очищенные препараты витамина Н полностью заменяют коэнзим Р при испытании на культурах Rhizobium tritolii и биотин при испытании на дрожжах. С другой стороны, коэнзим Р или биотин полностью заменял витамин Н при испытании на животных. Таким образом, витамин Н и биотин полностью идентичны. Дальнейшие исследования дали возможность установить химическое строение биотина и осуществить его синтез.
2. Химические и физические свойства биотина
В 1941 г. du Vigneaud и сотрудники выделили из печени кристаллический препарат метилового эфира биотина, из которого путем омыления щелочью был получен свободный биотин. Эмпирическая формула его была определена как C10H16O3N2S. На основании изучения продуктов распада биотина эти авторы пришли к выводу, что структура витамина соответствует 2/-кeтo-3,4-имидaзoлидo-2-тeтpaгидpoтиофен-н-валериановой кислоте.
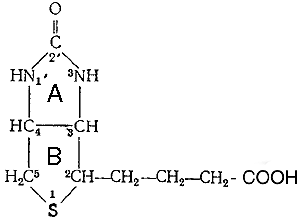
Молекула биотина состоит из имидазолового (А) и тиофенового (В) колец. Гетероцикл можно рассматривать как тиофеновое кольцо, связанное с уреидной группировкой. Приведенная структура биотина была подтверждена полным его химическим синтезом. В молекуле имеется три асимметрических атома углерода, что обусловливает существование 8 стереоизомеров.
Биотин образует игольчатые кристаллы с температурой плавления 232°. D поперечном сечении кристалл представляет собой ромб, острые углы которого равны 55°. Длина осей: а—5,25Ǻ, b—10,35Ǻ, с— 21,00Ǻ. Плотность кристаллов 1,41. Молекулярный вес биотина на основе химической формулы равен 214. Нa на основе рентгеноскопического анализа 245±6. При исследовании кристаллической структуры биотина установлено, что алифатическая цепь находится в цис-положении по отношению к уреидной циклической группировке.
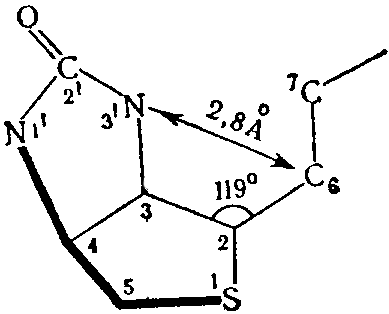
На основании данных, полученных методом рентгеноскопической кристаллографии Traub (1959) считает возможным образование внутримолекулярной водородной связи, которая возникает между кислородом карбонильной группы и одним из кислородных атомов карбоксильной группы в результате близкого расстояния между N-3’ и С-6 равного 2,4Ǻ; все остальные расстояния в молекуле составляют более 3,4Ǻ. Образование такой связи должно изменять распределение зарядов в уреидном кольце со смещением, кэтоэнольного. равновесия .к энолу, что: приводит к изменению химической реактивности N-1. Наличие водородной связи в известной мере определяет биологическую активность биотина и его производных. В 1965 г. установлена структура и относительная конфигурация каждого асимметрического центра биотина, а в 1966 г. абсолютная стереохимия витамина.
Биотин хорошо растворим в воде и спирте, трудно растворим в эфире, углеводородах парафинового ряда и несколько лучше в циклогексане, бензоле, галогенизированных углеводородах, спиртах и кетонах (ацетон). Биотин устойчив к действию ультрафиолетовых и рентгеновых лучей. Он разрушается под влиянием перекиси водорода, соляной кислоты, едких щелочей, формальдегида и сернистого газа. Он не изменяется под действием молекулярного кислорода, серной кислоты, гидро-
ксиламина. В ультрафиолетовых лучах для биотина не обнаружено специфического поглощения.
2.1 Аналоги и ингибиторы. Молекула биотина обладает большой специфичностью. Это подтверждается тем, что из 8 известных стереоизомеров только один—биотин—обладает биологической активностью. Удаление или замена каких либо атомов или групп атомов приводит к полной потере активности (дегидробиотин, гемоглобин, норбиотин). Только одна группа производных, полученных окислением атома серы (сульфобиотин и биотинсульфоксид) или заменой серы кислородом (оксибиотин) или двумя атомами водорода (дестиобиотин), проявляет биологическую активность. Сульфобиотин заменяет потребность в биотине у некоторых дрожжей но оказывается
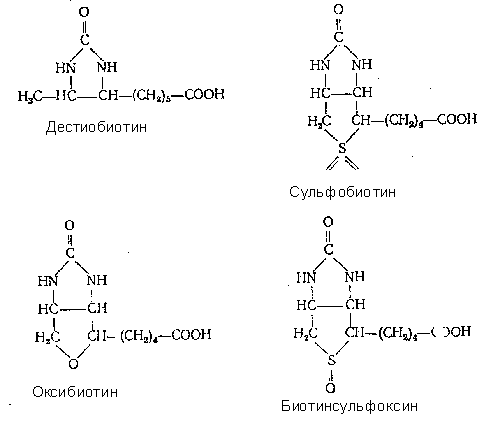
антагонистом витамина для L. casei, E. coli и Neurospora.
Известны аминокислотные производные биотина, среди которых наиболее изучен биоцитин, обладающий высокой активностью для многих микроорганизмов. Биоцитии выделен в кристаллическом виде из дрожжей. В 1951 г. расшифрована его структура. Оп представляет собой пептид биотина и лизина, а именно:
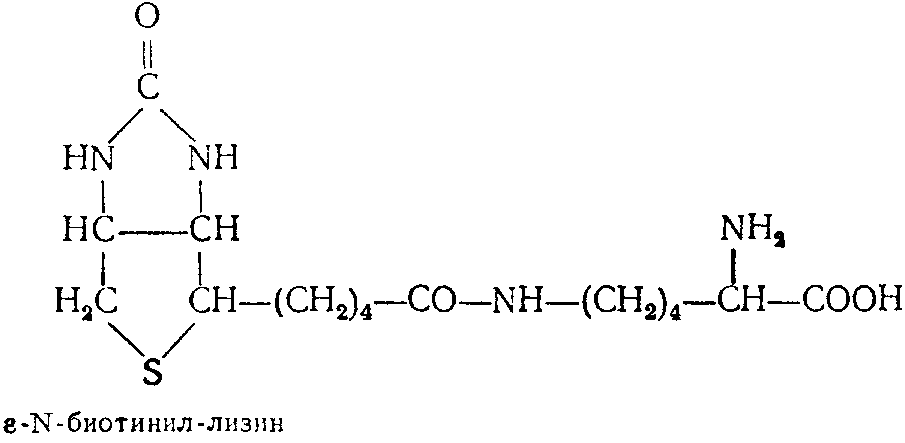
В 1952 г. осуществлен синтез биоцитина. Степень использования биоцитина разными микроорганизмами резко различается. Возможной причиной этого может быть наличие или отсутствие биоцитиназы, которая расщепляет биоцитин с освобождением свободного биотина.
По данным Traub (1959), биологическая активность биотина и его аналогов обусловлена внутримолекулярной связью, что позволяет объяснить причины наличия или отсутствия биологической активности для большинства изомеров и производных биотина. Так, образование водородной связи исключено у всех других оптических изомеров, кроме D-биотина, а также у производных с более длинной или укороченной боковой цепью, что приводит к полной потере биологической активности (гомобиотин, норбиотин). Неактивность гуанидиновых аналогов биотина, биотинола, оксибиотинола также объясняется отсутствием у них водородной связи. Некоторые производные биотина, которые образуются без нарушения водородной связи, сохраняют биологическую активность (дестиобиотин, оксибиотин, биоцитин и ряд аминокислотных производных биотина).
В настоящее время выяснена причина патологических изменений, возникающих при кормлении животных сырым яичным белком. В нем содержится авидин—белок, который специфически соединяется с биотином (введенным внутрь с пищевыми продуктами или синтезированным кишечными микроорганизмами) в неактивный комплекс и тем самым препятствует его всасыванию. Авидин содержится в яичном белке курицы, гуся, утки, индейки и лягушки. В 1942 г. он получен в кристаллическом виде и оказался глюкопротеидом с молекулярным весом 70000. Авидин стехиометричёски связывает эквимолярные количества биотина, образуя прочный комплекс, который не расщепляется ферментами пищеварительного тракта. Комплекс авидина с биотином термически устойчив и полностью диссоциирует только в автоклаве при 120° за 15 минут. С авидином соединяется DL-оксибиотин и некоторые другие аналоги биотина, но сродство авидина к биотину намного больше, чем к его производным. Изучение взаимодействия биотина и его производных с авидином показало необходимость уреидной группы в молекуле витамина, тогда; как карбоксильная группа и атом серы не являются необходимыми для образования комплекса. Авидин является универсальным ингибитором биотина. Его способность связывать биотин широко используется при изучении механизма участия этого витамина в процессах обмена веществ: торможение той или иной биохимической реакции авидином является существенным доводом в пользу возможности участия в ней биотина. Авидин применяется для получения экспериментальной биотиновой недостаточности у животных.
Распространение биотина в природе
Биотин широко распространен в природе. Он обнаружен у микроорганизмов. растении и животных. Содержание его определено в различных систематических группах животных: простейших, насекомых, рыб, земноводных, птиц, млекопитающих. Наиболее высокий уровень биотина обнаружен в личинках насекомых и наименьший — у пресмыкающихся. Рекордное количество (6,81 мкг/г) найдено в печени акулы. Содержание биотина в организме животных не зависит от принадлежности животного к определенной систематической группе. Анализ тканей показал большое различие в содержании биотина в органах одного и того же животного. Наиболее богаты витамином печень, почки, надпочечники; сердце и желудок содержат среднее, а мозговая ткань, легкие и скелетные мышцы—минимальное количество биотина.
Ниже приведено содержание биотина в различных продуктах животного и растительного происхождения.
Содержание биотина в пищевых продуктах (В. В. Филиппов, 1962)
| Продукты животного происхождения | Биотин в мкг на продукта | Продукты животного 100 г происхождения | Биотин в мкг на 100 г продукта |
| Печень свиная | 250 | Рисовые отруби | 46 |
| » говяжья | 200 | Рожь, цельное зерно | 46 |
| Почки свиные | 180 | Земляные орехи | 40 |
| Сердце быка | 8—50 | Пшеничная мука | 9—25 |
| Яйцо (желток) | 30 | Цветная капуста | 17 |
| Сардины (консервы) | 24 | Шампиньоны | 16 |
| Ветчина | 10 | Горошек зеленый | 6 |
| Камбала | 8 | Бананы | 4,4 |
| Мясо курицы | 6 | Дыня | 3,6 |
| » говядины | 5 | Лук свежий | 3,5 |
| Молоко коровье | 5 | Капуста белокочанная | 2.5 |
| Сыр | 4 | Морковь | 2,5 |
| Сельдь | 4 | Апельсины | 1,9 |
| Телятина | 1,5—2 | Яблоки | 0,9 |
| Соя, бобы | 60 | Картофель | 0,5—1,0 |
Наиболее богаты витаминами свиная и говяжья печень, почки, сердце быка, яичный желток, а из продуктов растительного происхождения—бобы, рисовые отруби, пшеничная мука и цветная капуста. В животных тканях и дрожжах биотин находится преимущественно в связанном с белками виде, в овощах и фруктах—в свободном состоянии.
Похожие работы
... энергии затруднено. Гетероферментативное молочнокислое брожение — процесс более сложный, чем гомоферментативное: сбраживание углеводов приводит к образованию ряда соединений, накапливающихся в зависимости от условий процесса брожения. Одни бактерии образуют, помимо молочной кислоты, этиловый спирт и углекислоту, другие — уксусную кислоту; некоторые гетероферментативные молочнокислые бактерии могут ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
... – переносят в кишечник новорожденного железо, витамины и другие важные соединения. Сывороточный белок α-лактоглобулин имеет специфическую функцию: он необходим для процесса синтеза лактозы. Казеин. Среднее количество его в молоке составляет 81% от общего содержания белков в молоке. Химически чистый казеин – белое аморфное вещество без запаха и вкуса – практически не растворяется в воде. ...
... России страдает от недостатка в питании витаминов и других функциональных веществ. Все большее распространение получают различные заболевания, снижается средняя продолжительность жизни. Химический состав плодов и овощей отличается большим разнообразием, он определяет цвет, вкус, запах, пищевую ценность продукта, сохраняемость и функциональные свойства. Энергетическая ценность большинства видов ...

0 комментариев