Навигация
С кислотами и солями (реакция обмена)
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
b) (NH4)2SO4 + Ba(NO3)2 → BaSO4 + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH (t)→ NaCl + NH3 + Н2O
Глава 3. Возможности вариативного построения урока «Соли аммония»
Одно из современных направлений педагогического творчества оптимизация учебно-воспитательного процесса и нормализация нагрузки учащихся. Для того чтобы повысить эффективность урока, учителю при подготовке к нему необходимо правильно оценить познавательные возможности класса, затем на этом основании сформулировать общие и специфические для данного класса цели и задачи урока, выбрать оптимальный методический путь для их достижения.
Для иллюстраций возможностей вариативного построения урока выбрана тема «Соли аммония». Это самый обычный, рядовой урок, каких много в школьном курсе химии. Его содержание в основном отвечает тексту § и в учебнике IX класса, а не требует значительных дополнений.
Урок «Соли аммония» завершает первую часть темы «Подгруппа азота», где описаны азот и его соединения со степенью окисления —3. При изучении материала урока учащиеся опираются на недавно приобретенные знания о составе, строении и свойствах аммиака, об образовании и строении иона аммония, закрепляют эти знания и используют их в новых связях. Кроме того, необходимо привлечь теоретические знания о типах химических реакций, о строении вещества, процессе электролитической диссоциации, условиях течения реакций обмена между электролитами в растворах до конца и опорные понятия: соль, кристаллическая решетка, ион, катион, анион, электролит, полное и краткое ионные уравнения, обратимая химическая реакция, качественная реакция, возгонка, окислительно-восстановительный процесс. I. Цели образования. Расширить представления учащихся о солях, ознакомив их с солями катиона — аммония;
Ш. Цели развития. Совершенствовать умения обобщать, конкретизировать, делать выводы, различать сущность и ее внешние проявления, применять теоретические знания для составления прогнозов и объяснений, пользоваться известными алгоритмами деятельности.
Основным принципом методики проведения урока должна стать реализация внутрипредметных связей, т. е. привлечение теоретических (в том числе и мировоззренческих) знаний школьников для прогнозирования фактов, или объяснения их сущности. Следовательно, все методические варианты урока в той или иной степени должны включать самостоятельные работы учащихся. Это определяется в первую очередь уровнем познавательной самостоятельности, достигнутым большинством учеников класса. Кроме того, важны и другие условия. Так, организованность и творческие возможности класса зависят от того, в начале или конце учебного дня проводится урок, какой ему предшествовал и т. п. Все эти факторы учителю необходимо учитывать при выборе методики проведения конкретного урока.
Основной метод — беседа с демонстрацией ,6пытов, включающая индивидуальное или групповое выполнение лабораторных опытов.
В начале урока можно провести опрос, для того чтобы обобщить уже известный учащимся материал о соединениях азота; повторить сведения о происхождении (генезисе) иона аммония и механизме его образования; выявить признаки сходства между аммиаком и ионом аммония пo составу и строению, взаимосвязь между ними. Два ученика выполняют у доски следующие задания: 1. Запишите уравнения химических реакций, при которых образуется ион аммония, и схему механизма образования этого иона. 2. Сравните состав и строение аммиака я иона аммония; определите, возможно ли наличие у них общих свойств (окислителя или восстановителя).
Пока учащиеся готовятся к ответу, учитель проводит фронтальный опрос: сколько электронов образует внешний электронный слой атома азота?
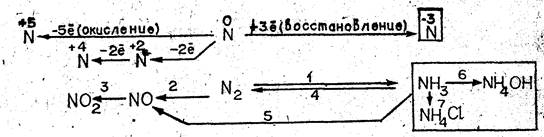
Какие предельные степени окисления азота вам известны? Назовите промежуточные степени окисления азота 1. На основе ответов учащихся учитель записывает на доске схему взаимосвязи соединений азота, а ниже — другую схему, соответствующую первой, используя формулы соединений азота и отражая в ней свойства уже изученных веществ. Порядок записи показывают номера над стрелками в схеме (см. рис. 1).
Затем учитель предлагает следующим двум учащимся записать уравнения реакций, соответствующие превращениям 1—3 и 4, 5, отметив условия их протекания и рассмотрев как окислительно-восстановительные процессы (превращения 6, 7 будут описаны первым учеником, вызванным к доске).
Из ответов первых двух учащихся следуют выводы: 1. Катион аммония образуется при соединении молекулы аммиака с протоном молекулы кислоты; новая ковалентная связь возникает, по донорно-акцепторному механизму. 2. Аммиак и ион аммония имеют одинаковый качественный и близкий количественный состав, следовательно, между ними возможна взаимосвязь; азот в этих соединениях имеет степень окисления —3, значит, они могут проявить только восстановительные свойства.
Из записей на доске учитель оставляет те, которые относятся к генезису и строению иона аммония, а также правую часть схемы превращений и продолжает беседу. Учащиеся прогнозируют состав соединений, содержащих катион аммония, и приводят в качестве примера гидроксид и соли аммония. На доске записываются тема урока и формулы галогенидов, сульфата, нитрата, карбоната аммония. На основе анализа общей формулы учащиеся прогнозируют проявление у изучаемых соединений общих свойств солей, особенных — характерных только для солей аммония (причина — наличие катиона. NH) и единичных (индивидуальных), свойств, отсутствующих у других солей. Эти свойства обусловлены сочетанием иона аммония с определенным анионом.
Учащиеся прогнозируют сходство в свойствах солей калия и аммония, указывают на ионный характер кристаллической решетки, хорошую растворимость солей в воде. Рассмотрение образцов солей подтверждает выводы. Необходимо подчеркнуть различие: соли аммония, имеют сложный катион, состоящий из двух элементов, поэтому кроме сходных свойств должны быть и отличительные.
По заданию учителя учащиеся перечисляют общие свойства солей: 1) соли — электролиты, в водных растворах диссоциируют на ионы; 2) для солей характерны реакции обмена, идущие в направлении образования практически нерастворимых соединений, газов, малодиссоциирующих веществ. Если ученики назову» третье общее свойство — способность к гидролизу, можно позднее кратко рассмотреть; его особенности и выявить отличие солей аммония от солей калия.
Учащиеся записывают уравнения реакций электролитической диссоциации, отмечают наличие одинакового катиона (NH) — причину общности свойств солей аммония. Затем она называют варианты реакций обмена: соль кислота, соль — соль, соль — щелочь. Приводя конкретные примеры для реакций первого варианта, учащиеся учитывают, что сильная кислота вытесняет слабую из соли, а практически нелетучая, летучую. Учитель может продемонстрировать опыт взаимодействия твердого хлорида аммония с концентрированной серной кислотой. Записывая уравнение реакции, отмечаем, что ион аммония сохраняется, следовательно, эта реакция не является характерной именно для солей аммония.
Затем учащиеся, пользуясь таблицей растворимости солей, обсуждают возможные варианты реакций «соль — соль». Подчеркивают, что такие реакции должны привести к образованию практически нерастворимых солей, содержащих анион исходной соли аммония. Следовательно, это могут быть качественные реакции на хлорид-анион, сульфат-анион. Запись уравнений реакций лучше начать краткого ионного, отражающего, сущность процесса, а затем представить соответствуют ему уравнения в молекулярной форме (от сущности к явлению). Катион аммония сохраняется и в этих реакциях, поэтому они, как и предыдущие, могут быть рассмотрены как общая для солей (по типу).
Учащиеся проводят фронтально лабораторные опыты или выполняют групповые задания по двум или более вариантам. Рассматривая вариант реакции обмена «соль — щелочь», ohi называют предполагаемые продукты .реакция определяют, почему она может идти до конца, какие условия этому способствуют. Oни прогнозируют образование гидроксида аммония отмечают его неустойчивость и подчеркнет, что разложению этого вещества на аммиак и воду будет способствовать нагревание смещение химического равновесия). Ион аммония при этом разрушается, так как он имеет сложный состав и строение в отличие от ионов щелочных металлов. По краткому ионному уравнению видно, что данное свойство — особенное, характерное для всех солей аммонии. Учитель предлагает конкретизировать краткое ионное уравнение.
Затем обсуждаются способы доказательства и выделения аммиака. Учитель отмечает практическое значение реакции.
Рассмотрение следующего особенного свойства солей аммония можно начать с проблемной постановки опыта разложения хлорида аммония. Учитель показывает опыт в обычной г пробирке, дает задание учащимся описать наблюдаемые явления и провести аналогию с процессом возгонки иода (VIII класс). Явления сходны внешне, но будет ли одинаковой их сущность? Учитель демонстрирует опыт разложения хлорида аммония с последующим разделением аммиака и хлороводорода. Учащиеся убеждаются в различии сущности процессов возгонки иода и нашатыря. Первый — физическое явление, второй — химическая реакция, так как хлорид аммония подвергается термической диссоциаций, образуя новые вещества. Отсюда следует вывод: различная сущность может одинаково проявляться внешне, поэтому важно познавать именно сущность явлений. Разложение при нагревании—особенность солей аммония, обусловленная сложным составом и строением катиона, но природа аниона не влияет на этот процесс. Так, при разложении соли летучей кислоты (NH4C1) обратится два газа, которые затем вновь соединяются. Соль нелетучей кислоты (МН4)зР04 выедет один газ — аммиак. Важно отметить применение в практике термического разложения солей аммония: хлорид-нитрата и гидрокарбоната.
По мере изучения свойств солей аммония важно дополнять схему превращений соединяй азота.
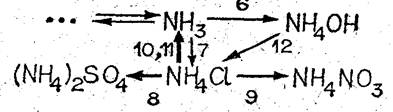
В задание необходимо включить запись уравнений соответствующих реакций.
Закрепление можно провести при выполнении заданий 2 а За к § 17. Задания 1, 36, 5 и 4 учащиеся выполнят дома. Очень важно разъяснить им домашнее задание, кратко ознакомить с планом изложения материала в § 17, подчеркнуть соответствие его логике объяснения на уроке.
Если класс пришел на урок после контрольной работы по другому предмету или в нем имеется значительное число слабоуспевающих учеников, учителю не приходится рассчитывать на высокий уровень познавательной самостоятельности учащихся, и тогда изучение нового материала можно начать без предварительного опроса. Рассмотрение нового материала может быть организовано как индивидуальная или групповая работа с учебником, сопровождаемая выполнением демонстрационных и лабораторных опытов.
Планируя урок, необходимо учитывать, что слабоуспевающие школьники успешнее усваивают объяснение учителя в том случае, если оно построено в логике соответствующего параграфа учебника и с его текстом на уроке проведена работа. Поэтому второй методический вариант урока конструируют на основе плана изложения, принятого в учебнике, в логике «от явления к сущности», учитывая необходимость постоянного руководства учебным процессом со стороны учителя.
Учитель может разделить текст параграфа на отдельные последовательно изучаемые фрагменты и предложить учащимся задания, направляющие работу. После выполнения каждого задания они должны продумать запись в тетради.
I. Прочтите абзац 1. Рассмотрите образцы кристаллических солей аммония и калия, а также их растворы. Перечислите черты сходства; укажите их причины.
И. Прочтите абзацы 2, 3, 4. Проведите реакцию взаимодействия хлорида аммония с нитратом серебра и сульфата аммония с хлоридом бария. Назовите общие свойства солей, характерные для солей аммония. Изменяется ли при этих реакциях ион аммония?
III. Прочтите с. 39 до конца и абзацы 1, 2 на с. 40. В чем особенность, взаимодействия солей аммония со щелочами? Как доказать выделение аммиака? Почему эта реакция может применяться как качественная на катион аммония? Как доказать, что свойство реагировать со щелочами с образованием аммиака и воды является особенным, т. е. характерным для всех солей аммония? Какое применение оно находит в лаборатории? Экспериментально докажите наличие катиона аммония в растворах хлорида и сульфата аммония.
V. Составьте схему превращений, связывающую аммиак, гидроксид аммония и соли аммония.
Каждое задание учащиеся вначале выполняют самостоятельно, затем учитель проводит необходимые демонстрационные опыты и обсуждает с учениками запись в тетради — фрагмент общего конспекта параграфа, вносит некоторые дополнения. В окончательном виде конспект урока может быть примерно таким:
1. Соли аммония сходны с солями щелочных металлов (калия): в твердом состоянии имеют ионную кристаллическую решетку, хорошо растворяются в воде. Причины сходства: одинаковый заряд и близкий радиус ионов аммония и калия.
2. Общие для всех солей свойства солей аммония: способны к электролитической диссоциации в водном растворе, вступают в реакции обмена «соль — кислота», «соль — соль» (приводятся уравнения реакций). Ион аммония при этих реакциях не изменяется.
3. При взаимодействии солей аммония со щелочами также идет реакция обмена, но ион аммония разрушается- образуется аммиак, вода и новая соль. Эго свойство характерно для всех солей аммония и является особенным для них. Реакцию используют в лаборатории как качественную на ион аммония и для получения аммиака. (Уравнения реакций.)
4. Хлорид аммония при нагревании возгоняется: разлагается на аммиак и хлороводород, которые вновь соединяются на холодных стенках пробирки (химическое явление). Термическая диссоциация — разложение солей аммония при нагревании — особенное свойство, характерное для всех солей аммония. При этом ион аммония разрушается.
Похожие работы
... разработки К сожалению, провести весь курс занятий, логически связанных между собой, оказалось невозможным, и были апробированы только некоторые формы организации элективных курсов по изучению темы «Экологический мониторинг водных объектов». Занятие №1. Водные ресурсы планеты В ходе эволюции вода создала окружающую нас природу, живой мир, да и самого человека: именно водная среда ( ...
0 комментариев