Навигация
Клеточная селекция растений
2. Клеточная селекция растений
Сомаклональная вариабельность. Метод культуры изолированных клеток, тканей и органов растений in vitro, широко используемый для решения многих фундаментальных вопросов клеточной биологии, физиологии и генетики растений, в настоящее время находит все большее применение и при создании новых биотехнологий. Начиная с первых работ по культивированию растительных клеток, тканей и органов особый интерес у исследователей вызвал вопрос о том, какие клеточные изменения могут происходить в изолированных клетках, растущих на искусственных питательных средах, и причины, их вызывающие. С разработкой техники получения растений-регенерантов из каллусной ткани появилась возможность получать новые формы растений, отличающиеся как по фенотипическим, так и по генетическим признакам от исходных растений. Такое разнообразие среди клеточных линий и растений-регенерантов получило название «сомаклоны», хотя еще в 70–80-е годы нашего столетия было принято называть растения, регенерировавшие из каллусной ткани, «калликлонами», а из протопластов – «протоклонами».
Генетическая природа и механизм возникновения сомаклональной изменчивости пока мало изучены. Однако четко можно выделить зависимость возникновения сомаклональных вариантов, прежде всего, от генетической гетерогенности соматических клеток исходного экспланта, генетической и эпигенетической изменчивости, индуцируемой условиями культивирования in vitro, а также от генотипа и исходного экспланта.
Дифференцированные клетки в нормальном растении могут иметь разную степень плоидности, но для отдельных видов характерно наличие только диплоидных клеток. Однако в процессе онтогенеза могут возникать клетки с разной плоидностью. Например, экспериментально доказано, что в меристемных тканях, наряду с фактором видового постоянства числа хромосом, почти у 80% покрытосеменных растений в процессе дифференцировки в соматических клетках может происходить эндоредупликация хромосом и формирование тканей различного уровня плоидности. Для вегетативно размножаемых и апомиктичных растений характерно образование с высокой частотой анеуплоидных клеток. Усиление хромосомных перестроек, приводящих к появлению химерности и миксоплоидии у растений, наблюдается при изменении условий произрастания, особенно при их резком ухудшении: засоление почв, повышенные или пониженные температуры, применение гербицидов или пестицидов, минеральных удобрений в повышенных дозах и др. Эти и другие часто встречающиеся в практике факторы могут приводить к физиологическим нарушениям, связанным, в первую очередь, с появлением аномальных митозов и формированием клеток с числом хромосом, отличающимся от такового в материнской ткани.
Цитологические исследования показали, что вариабельность, индуцируемая условиями культивирования in vitro, связана с генетическими изменениями. Прежде всего одним из основных источников появления фенотипических вариантов являются различные кариологические изменения и перестройки. Однако выявить, какие из них будут иметь фенотипический эффект и наследоваться как стабильная мутация генов, часто сложно. Как грубые, так и тонкие хромосомные изменения – мелкие деления, дупликации, транслокации, инверсии – могут вызвать существенные фенотипические изменения как в растениях-регенерантах, так и в последующем потомстве. Хромосомные изменения часто наблюдаются при мейозе. Анализ мейоза клетки в регенерантах показал такие интенсивные перестройки хромосом, как транслокация, инверсия, субхроматидный обмен, частичная утрата хромосом. Это является доказательством того, что большая часть фенотипических изменений обусловлена генетическими механизмами.
Сомаклональную изменчивость можно проследить на молекулярном уровне, оценивая тонкие перестройки ядерной ДНК.
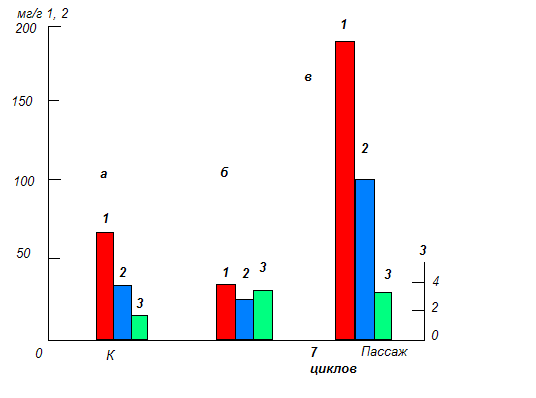
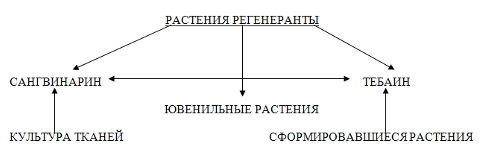
Кроме сомаклональной вариабельности, связанной с наследуемыми перестройками генома, отмечены фенотипические изменения («эпигенетические»), которые могут стабильно передаваться дочерним клеткам, но не проявляться в растениях-регенерантах или их половом потомстве (Приложение 1).
Высокая степень разнообразия сомаклонов зависит от исходного генотипа, природы и стадии развития экспланта. Например, у различных злаков степень изменчивости среди сомаклонов может значительно различаться: у пшеницы (2n=6х=42) из 192 исследованных растений-регенерантов 29% были анеуплоидами, у гексаплоидного овса (2n=6х=42) выявлены цитоге-нетические изменения с такой же частотой, а для кукурузы частота возникновения анеуплоидных растений не превышала 2–3%. Образование полиплоидных и анеуплоидных растений может наблюдаться и у других видов, например, на картофеле. Причем частота появления новых вариантов у диких видов значительно ниже, чем у дигаплоидных линий культивируемого картофеля.
Тип исходного экспланта также влияет на появление сомаклональных вариантов, отличающихся количественными и качественными признаками. Для картофеля, например, аномальные растения получены в 12% случаев при использовании в качестве первичного экспланта мезофильных тканей листа, а в случае использования лепестков или оси соцветий частота формирования растений с фенотипическими отклонениями от нормы составила 50%.
Условия культивирования и, в частности, нарушение гормонального баланса питательной среды – одна из причин возникновения генетического разнообразия культивируемых клеток вследствие нарушения клеточного цикла, в частности митоза. От соотношения фитогормонов, входящих в состав питательных сред, во многом зависит цитогенетическая структура клеточных популяций. Однако морфологическая и цитогенетическая разнокачественность клеточных популяций может возникнуть и вследствие влияния отдельных компонентов питательной среды: некоторых минеральных солей, сахарозы или другого источника углеродного питания, витаминов, растительных экстрактов, а также от режима выращивания. Длительное культивирование клеток in vitro также способствует повышению генетического разнообразия сомаклонов. Причем для некоторых видов показано, что, несмотря на присутствие в культуре клеток разной плоидности, регенерировавшие растения были преимущественно диплоидными. Это явление было объяснено тем, что в процессе культивгирования отбирались растения-регенеранты с более или менее нормальной морфологией, которые регенерировали, как правило, в первую очередь.
Различные типы морфогенеза – соматический эмбриогенез или органогенез–также могут по-разному сказываться на генетических изменениях и, соответственно, на фенотипе растений. Экспериментально установлено, что при соматическом эмбриогенезе время прохождения цикла клетка – растение значительно короче, чем при органогенезе, поэтому степень сходства получаемого материала и исходного родительского генотипа может быть значительно выше.
Сомаклональные варианты имеют, несомненно, практическое применение в сельскохозяйственной практике, в силу появления форм, отличающихся от родительских по различным биохимическим, качественным и количественным признакам, а также цитогенетическим характеристикам. Например, получены сомаклоны картофеля сорта Зарево, отличающиеся высокой урожайностью, повышенной устойчивостью к заболеваниям, более высоким содержанием в клубнях протеина и крахмала. Причем наследование важных признаков при размножении клубнями сохранялось в течение трех лет полевых испытаний (В.В. Сидоров и др., 1984, 1985). Для растений табака получены через каллусную культуру сомаклоны, устойчивые к вирусу табачной мозаики, а для сахарного тростника» получен новый сорт, характеризующийся высокой урожайностью и повышенной устойчивостью к заболеваниям, в частности к болезни Fiji. В настоящее время метод культуры тканей начал широко использоваться в селекции не только кормовых и технических культур, но и декоративных и лекарственных растений. Примером тому может служить новый сорт пеларгонии Velvet Rose, полученный через каллусную культуру.
Таким образом, полученные положительные результаты свидетельствуют о необходимости более эффективного внедрения различных приемов получения сомаклональных вариантов в практику селекционной работы, и наиболее реальным является применение сомаклональной изменчивости для улучшения или «доработки» уже существующих сортов или линий по отдельным недостающим признакам.
Селекция растений на клеточном уровне. Значительный интерес представляет вопрос об использовании клеточной селекции в комплексе с получением сомаклонов. Одна из наиболее сильных сторон культуры in vitro в создании технологий для сельского хозяйства – возможность на основе сомаклональных вариаций или индуцированных мутаций отбирать в жестких селективных условиях клетки, характеризующиеся искомыми признаками.
Для проведения клеточной селекции используют следующие приемы:
— прямая (позитивная) селекция, при которой выживает лишь определенный искомый мутантный тип клеток;
— непрямая (негативная) селекция, основанная на избирательной гибели делящихся клеток дикого типа и выживания метаболически неактивных клеток, но требующая дополнительной идентификации у них мутационных изменений;
— тотальная селекция, при которой индивидуально тестируются все клеточные клоны;
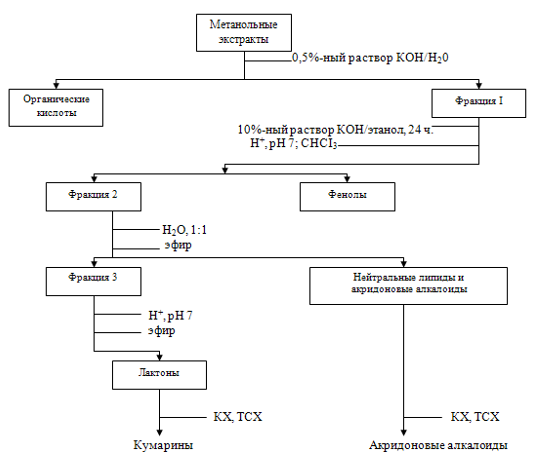
— визуальная селекция и неселективный отбор, когда вариантная линия может быть идентифицирована среди всей популяции клеток визуально или при использовании биохимических методов (тонкослойная или жидкостная хроматография, радиоиммунный анализ, микроспектрофотометрия и др.).
Из перечисленных выше приемов клеточной селекции прямая селекция является наиболее распространенным методом и используется главным образом для выделения растений-регенерантов, устойчивых, например, к гербицидам, антибиотикам, токсинам, тяжелым металлам, солям и другим антиметаболитам.
Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензионные культуры или изолированные протопласты. Выбор объекта зависит от наличия разработанных технологий применительно к различным видам растений, а также от конечных целей исследования.
Каллусная ткань представляет собой легко доступный материал, который наиболее часто используют для клеточной селекции. Как правило, работу проводят на первичной или пересадочной каллусной ткани, которая не утрачивает способности к регенерации на протяжении ряда субкультивирований. Однако при работе с каллусными культурами многие исследователи отмечают существенные недостатки данного объекта, медленный рост ткани, неравноценное для всех клеток действие токсических веществ, которые применяются в качестве селективного фактора, а также потеря регенерационной способности в процессе культивирования каллусных клеток. Несомненно, проводить селекцию целесообразно на уровне одиночных клеток (суспензионная культура, протопласты). Однако для многих видов растений не разработаны эффективные технологии и способы культивирования одиночных клеток. Поэтому, несмотря на перечисленные выше недостатки использования каллусных культур, этот способ селекции остается для некоторых видов растений пока единственным.
Получение стабильно устойчивых линий – процесс длительный. Как правило, селекция начинается с получения достаточного количества каллусной массы из изолированных растительных эксплантов, использующейся в дальнейшем для определения концентрации селективного фактора (построение дозовой кривой), при которой наблюдается одновременно рост каллусной ткани, и в то же время часть каллусных колоний погибает. Выбранная концентрация селективного фактора признается оптимальной и используется в дальнейших экспериментах. Так как первично полученные на средах с селективными факторами колонии клеток могли возникнуть вследствие физиологической адаптации или определенного состояния дифференцировки клеток и не быть генетически устойчивыми, то в течение последующих 4–6 субкультивирований на селективной среде проверяется стабильность устойчивости полученных клонов. Затем их переносят на среду без селективного фактора и субкультивируют еще 2–3 пассажа. И только после повторного возвращения в селективные условия отбирают стабильные клоны, из которых пытаются получить растения-регенеранты. Однако работы, проведенные с получением растений, устойчивых к повышенным солям, а также к токсинам, выделенным из грибов–возбудителей болезней, показали, что устойчивость клетки и растения к исследуемому селективному фактору может совпадать и не совпадать. Прямая корреляция между устойчивостью растений и клеток in vitro отмечена лишь для низких температур, устойчивостью к гербицидам, высоким концентрациям алюминия и другим факторам.
Большое число работ по культивированию каллуса, с целью получения нового селекционного материала, проведено на пшенице, ячмене, рисе, сорго, а также на картофеле, томатах, люцерне и, крайне редко, на древесных. Уже достигнуты первые положительные результаты по получению растений пшеницы, риса, картофеля, устойчивых к NaCl или Na2S04. Получены клетки, а из них растения моркови, которые синтезируют в 20 раз больше метионина, в 30 раз – триптофана, в 5 раз – лизина путем добавления в питательную среду токсичных аналогов аминокислот. Для картофеля получены растения, устойчивые к кольцевой гнили. Что касается древесных, то для них работы в этом направлении крайне редки и часто имеют поисковый характер. Таким образом, использование каллусной культуры в селекционных целях открывает огромные возможности в создании новых форм растений, несущих ценные признаки, необходимые для человечества.
Наряду с перечисленными выше объектами (каллусная, суспензионная культура, изолированные протопласты), в качестве исходного материала для селекции могут быть использованы культуры соматических или андрогенных эмбриоидов, такие органогенные экспланты, как сегменты листьев или различные меристематические и стеблевые части растений, а также культура изолированных зародышей. Например, путем культивирования и селекции in vitro зародышей из семян получены растения ячменя, устойчивые к аналогам аминокислот, с улучшенным содержанием белка. Для картофеля разработан эффективный метод обработки побегов и черенков мутагеном, приводивший к получению химерных мутантов хлорофиллдефектности и антибиотикоустойчивости. При культивировании пыльников яровой пшеницы сорта Саратовская-29 и Москов-ская-35 на питательных средах с повышенным содержанием солей хлорида натрия получены соматические эмбриоиды, а в дальнейшем растения-регенеранты, проявившие повышенную солеустойчивость (Беккужина, 1993).
Таким образом, проведение селекции на клеточном уровне позволяет создавать новые формы растений в 2–4 раза быстрее по сравнению с традиционными способами селекции.
Похожие работы
... растением, количество веществ специализированного обмена. Только благодаря правильно разработанной стратегии получения высокопроизводительных штаммов к настоящему времени получены культуры тканей, в которых содержание вторичных продуктов достаточно велико, чтобы служить лекарственным сырьем. Однако для многих культур неоднократные попытки различных исследователей определить условия накопления ...
... по фосфору, азоту или сахару. Режим хемостата позволяет с помощью фиксированной скорости разбавления поддерживать константную скорость деления и плотность клеток в популяции. Клеточные суспензии в биотехнологии используются для получения вторичных метаболитов, многие из которых являются ценными лекарственными препаратами, для промышленного выращивания клеточной биомассы и для клеточной селекции. ...
... частности, биогенного происхождения: поли-b-оксибутирата, полиамилозы) и поиск новых активных микроорганизмов-разрушителей полимеров (полиэтилена, полипропилена, полихлорвинила). Усилия биотехнологов направлены также на борьбу с пестицидными загрязнениями — следствием неумеренного и нерационального применения ядохимикатов. Биотехнологические разработки играют важную роль в добыче и переработке ...
... на 54—71% и увеличивает урожай на 2 ц/га. Внесение триходермина в торфоперегнойные горшочки в количестве 50 мг снижает поражаемость огурцов корневыми гнилями на 60 % и увеличивает урожай на 31—74 %. Биотехнология и генетическая инженерия открывают новые широкие возможности в деле создания форм микроорганизмов, губительно влияющих на возбудителей болезней растений, отличающихся высокой ...



0 комментариев