Навигация
ММ Na-фосфатный буфер 75 мл 1 М раствора
75 мМ Na-фосфатный буфер 75 мл 1 М раствора
65 мМ NaCI 13 мл 3 М раствора
10% глюкоза 100 г.
Проавтоклавируйте.
| Организм | Концентрация клеток в 100 мкл блок-вставки | Нагрузка на дорожку при форезе |
| Trypanosoma brucei Plasmodium falciparum Giardia lambia Leishmania | 2х10х10 1Х102х10 | 1/16 1/8 1/10 1/16 |
Известно, что хромосомная ДНК из-за больших размеров молекулы чрезвычайно чувствительна к воздействию нуклеаз. В связи с этим необходимо принять за правило предварительно обрабатывать все растворы, контактирующие с ДНК. Растворы следует разлить на небольшие порции и простерилизовать. Стерильными должны быть и посуда, и оборудование. Для переноса образцов из вставок или из трубочек можно использовать изогнутую стеклянную палочку, простерилизованную в спирте и в пламени горелки. При работе с образцами ДНК нельзя пользоваться никакими приспособлениями, содержащими металлические детали, в частности из нержавеющей стали, а также шпателями и бритвенными лезвиями. ДНК прочно связывается со многими бивалентными металлами и контакт с ними обычно приводит к появлению разрывов в молекуле ДНК.
2. Приготовление вставок с образцами ДНК простейших
Свободно живущие простейшие могут быть прямо использованы для приготовления вставок с препаратами ДНК. Их можно отделить от культуральной среды центрифугированием. Перед приготовлением вставок внутриклеточных паразитов выделяют из клеток крови или других хозяйских клеток. Эритроциты можно лизировать, как указано в табл. 3. В некоторых случаях трипаносом выделяли из различных клеточных элементов с помощью ионно-обменной хроматографии на ДЕАЕ-носителе.
2.1 Выделение ДНК из культивируемых клеток и лимфоцитов
Процедуры получения ДНК из культивируемых клеток и из простейших имеют много общего. Для рестрикционного картирования необходимо использовать клеточные линии только с нормальным стабильным геномом. Например, клетки HeLa очень удобны для культивирования, но содержат большое количество хромосомных перестроек и имеют разную плоидность. Один миллион диплоидных клеток должен содержать примерно 6,6 мкг ДНК, что соответствует размерам генома 6х10 нуклеотидных пар. Поскольку несинхронизированные клеточные культуры обычно представляют собой смесь диплоидных, тетраплоидных и промежуточных состояний, мы используем для работы 1х10клеток, считая, что они содержат примерно 10 мкг ДНК.
Процедуру, описанную в табл. 3, использовали также для получения интактных хромосом из различных клеточных линий насекомых. При этом концентрация клеток должна быть пересчитана в соответствии с меньшими размерами генома.
Методика выделения ДНК из лимфоцитов существенно близка используемой для культивируемых клеток, если лимфоциты свободны от примеси эритроцитов. Эритроциты могут быть или лизированы), или удалены с помощью центрифугирования в градиенте фиколла или перколла. Эти методы описаны в табл. 3.
2.2 Выделение ДНК из клеток прокариот
Методика выделения ДНК из клеток Е. coli представлена в табл. 4. Именно эта методика была с успехом использована для получения интактной хромосомной ДНК широкого набора бактерий и архебактерий, включая Salmonella, Legionella, Mycobacterium, Haemophilus, Bacillus, Streptomyces, Halobacterium и некоторые другие быстрорастущие, сопутствовавшие им. Размеры хромосом у этих бактерий варьируют в пределах от 1 до 20хЮ нуклеотидных пар, количество хромосом на одну клетку также может изменяться от 1 до 5 в зависимости от условий культивирования. Таким образом, в предварительные эксперименты необходимо включить подсчет клеток в широком диапазоне.
В некоторых случаях могут оказаться необходимыми небольшие изменения в методике. Например, в растворе Pett IV, когда его использовали для обработки Halobacterium, концентрацию NaCl пришлось увеличить до 0,5 М, чтобы предотвратить преждевременный лизис клеток.
Прием, описанный в табл. 4, предназначен для синхронизации репликативных вилок, которая достигается инкубацией клеток в хлорамфениколе в течение 1 ч непосредственно перед сбором. Обработка хлорамфениколом позволяет закончиться уже начатым репликативным процессам, но предотвращает запуск новых. Препараты ДНК можно получить и из несинхронизированных культур. Однако необходимо помнить, что области хромосом около точек конца репликации могут быть недопредставлены в некоторых препаратах. Иногда это не имеет значения, но не всегда. Так, например, интенсивность окрашивания бромидом этидия зависит от молекулярного веса. Таким образом, хромосомную ДНК из области терминации репликации будет непросто выявить с помощью этого соединения.
2.3 Выделение ДНК из клеток грибов
Мы предлагаем две методики для дрожжей. Первая из них предназначена для Saccharomyces cerevisiae, а вторая – для делящихся клеток Schlzosaccharomyces pombe. В обоих случаях для удаления клеточной стенки и приготовления сферопластов используется зимолиаза 100 Т. Получить сферо-пласты из 5. pombe более трудно. В этом случае мы рекомендуем контролировать процесс лизирования под микроскопом.
Другие представители грибов могут иметь иные, нежели дрожжи, компоненты клеточной стенки. В этом случае полезно вспомнить, что существуют разнообразные зимолиазы, отличающиеся друг от друга по своей специфичности и активности. В каждом конкретном случае можно подобрать подходящий фермент. К сожалению, в этих ферментах присутствует большое количество примесных нуклеаз, которые препятствуют получению больших фрагментов ДНК. Препарат «Новозин», выпускаемый фирмой Novo Bio Labs, является смесью ферментов, воздействующих на клеточную стенку самых разных грибов. Мы так и не решились использовать этот препарат; нас смутил его коричневый цвет. Вероятно, необходима более тщательная очистка.
2.4 Выделение ДНК из растительных клеток
Усилия многих исследователей направлены'сейчас на разработку методов получения интактных хромосомных ДНК из солидных тканей. Предварительные эксперименты с плоскими червями, Caenorhabditis elegans, личинками Drosophila и с Chlamy-domotias продемонстрировали возможность использования различных приемов. Для небольших многоклеточных организмов могут пригодиться методы, применяемые для одноклеточных. Для предотвращения выхода подвижных клеток за пределы вставок полезна обработка раствором 0,2 мМ азида натрия. ДНК с большим молекулярным весом удается получить при обработке коллагеназами, гомогенизировании, трипсинизации или просто разрезании материала, помещенного в раствор ESP. Можно вначале выделить из клеток ядра, а затем из них приготовить вставки с образцами.
3. Работа с агарозными блок-вставками, содержащими образцы ДНК
Для многих целей удобнее и проще иметь дело с ДНК, заключенными в агарозный гель, чем находящимися в растворе. Низкомолекулярные компоненты свободно диффундируют через агарозу при мягком перемешивании. Мы работали с 100 мкл-агарозными блок-вставками просто как с жидкими образцами объемом 100 мкл.
Возможность обрабатывать ДНК ферментами непосредственно в агарозе зависит от типа агарозы. По крайней мере, половина партий агарозы содержит примеси, которые не позволяют ферментам эффективно работать. Компания FMC выпускает агарозу с низкой температурой плавления, специально проверенную на пригодность к рестрикционной обработке заключенных в нее молекул ДНК.
3.1 Ферментативная обработка
Для ферментативной обработки ДНК, содержащейся в блок-вставке, необходимо предварительно инактивировать протеинкиназу К, оставшуюся после приготовления образца, и убрать диализом ЭДТА и детергенты. Протеиназа К весьма устойчивый фермент и может оставаться активной в растворе ESP при 4°С по крайней мере 1 год. Однако она полностью инактивируется при обработке фенилметилсульфонилфторидом, который крайне нестабилен и свежий раствор, которого поэтому надо добавлять ежедневно. Любая остающаяся во вставке протеиназа К разрушит вносимые ферменты. Необходима чрезвычайная аккуратность, чтобы не загрязнять лабораторный стол и используемое оборудование протеиназой К. В правильно выбранной агарозе эффективными будут если не все, то большинство рестриктаз. Когда рестриктазы не активны в агарозе, они, как правило, не проявляют активность и в растворе. Обычно мы используем соотношение фермент: ДНК, равное 20: 1. В большинстве случаев это соответствует по крайней мере 10-кратному превышению над реально необходимым количеством фермента. Наш опыт, основанный на использовании ДНК и рестриктаз из различных источников, а также опыт других исследователей подсказывает, что именно такой подход гарантирует полноту рестрикции. В случае низкой концентрации ДНК, особенно при работе с бактериями, может оказаться необходимым повысить концентрацию рестриктаз. Для частичного рестриктазного гидролиза необходимо титровать отдельные рестриктазы, добавляя различное их количество к вставкам с образцами ДНК и инкубируя в течение 2,5 ч.
Похожие работы
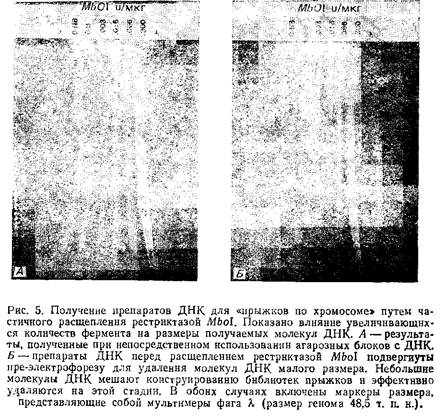
... , что тандемное лигирование молекул ДНК дает сцепленные фрагменты, соединяющие в себе две случайные последовательности. Такое сцепление приводит к образованию аномальных клонов, которые провоцируют «прыжки по хромосоме» из данной стартовой точки на какую-то случайную последовательность генома. Свести к минимуму риск возникновения такого события можно, проводя лигирование при достаточно низких ...
... развиваться. Поэтому все родившиеся клоны будут генетически одинаковыми. А мы живем среди вирусов, бактерий, патогенных организмов, которые постоянно мутируют. Люди приспосабливаются к ним за счет генетического разнообразия. А клон неизбежно будет поражен первым же самым простейшим вирусом, например, обычным вирусом гриппа. Так как одной из движущих сил прогрессивного развития является уровень ...
... ревматизма обусловила значительное снижение заболеваемости — до 0Д8 на 1000 детского населения. В разработку проблемы детского ревматизма внесли большой вклад отечественные педиатры В. И. Молчанов, А. А. Кисель, М. А, Скворцов, А. Б. Воловик, В. П. Бисярина, А. В. Долгополова и др. Эпидемиология, Установлена связь между началом заболевания и перенесенной стрептококковой инфекцией, в основном в ...
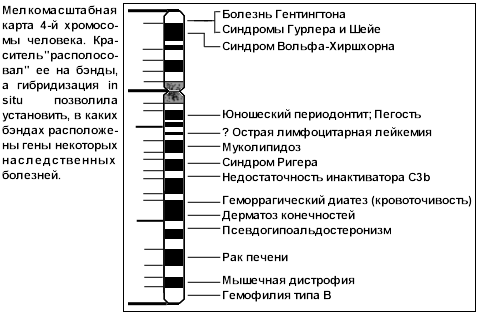
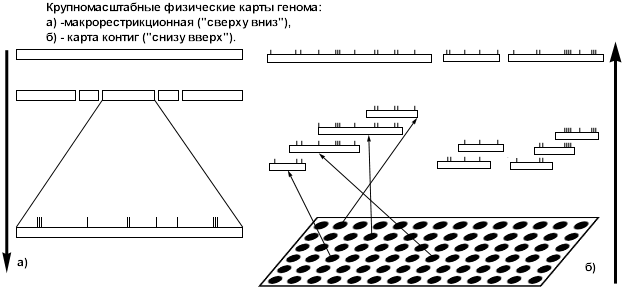
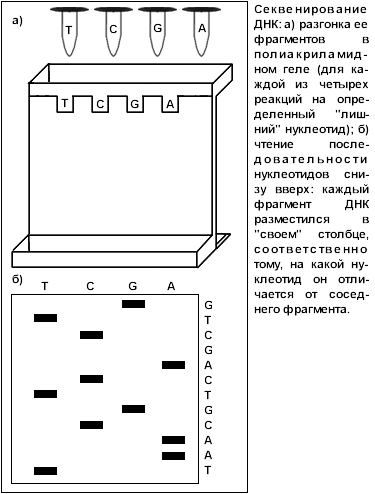
... (анализ первичной последовательности нуклеотидов в цепочке ДНК), разработанные П. Сэнджером. Несколько лет назад начались исследования по международной программе "Геном человека", объединившей усилия ученых многих стран. Конечная цель ее – создать подробную карту человеческого генома, то есть полного набора его генов. А цель предлагаемого реферата гораздо более скромная: пробившись сквозь завесу ...

0 комментариев