СИНТЕЗ БІЛКА
Зміст
Введення
Функції білка
Умови і етапи біосинтезу білка
Трансляція і загальні вимоги до синтезу білка в безклітинній системі
Рибосоми
Аміноацил-тРНК-синтетази.
Транспортні РНК
Природа генетичної коди
Етапи синтезу білка
Активування амінокислот
Введення
За останні роки потреба в значних кількостях амінокислот неухильно зростає у зв'язку з широким використанням їх в біохімії, живленні, мікробіології і при дослідженні рослинних і тваринних тканин. Крім того, амінокислоти знайшли широке застосування як добавки до природних і перероблених продуктів харчування. У минулому потреба в більшості аминокислот могла бути задоволена шляхом їх виділення з кислотного, лужного і ензиматичного гідролізату білків або з інших природних джерел. Фактично ці методи і до теперішнього часу застосовують в промисловості при виробництві аргініну, аспарагіна, цистіну, глутамінової кислоти, гістидіну, оксипроліну, проліну і тирозину. Проте зараз ці методи не є кращим шляхом отримання більшості аминокислот, що входять до складу білків. В даний час існує цілий ряд зручних синтетичних методів, що дозволяють легко отримати аланін, аспарагінову кислоту, гліцин, ізолейцин, лейцин, лізин, метіонін, фенілаланин, серин, треонін, триптофан і валін, а також багато інших амінокислот, причому як в лабораторному, так і в промисловому масштабах. Найбільш істотні з цих синтетичних методів будуть детально розглянуті в даному розділі.
Живий організм характеризується вищим ступенем впорядкованості складових його інгредієнтів і унікальною структурною організацією, що забезпечує як його фенотипічні ознаки, так і різноманіття біологічних функцій. У цій структурно-функциональном єдності організмів, що становить суть життя, білки (білкові тіла) грають найважливішу роль, що не замінюється іншими органічними сполуками.
Білки — високомолекулярні азотовмісні органічні речовини, молекули яких побудовані із залишків амінокислот. Назва протеїни (від греч. protos - перший, найважливіший), мабуть, точніше відображає першорядне біологічне значення цього класу речовин. Прийняті у вітчизняній літературі назви білки і білкові речовини пов'язані з виявленням в тканинах тварин і рослин речовин, що мають схожість з білком курячого яйця.
У наш час, коли абсолютно достовірно встановлено, що спадкова інформація зосереджена в молекулі ДНК кліток будь-яких живих організмів, не викликає сумніву, що тільки білки є тими молекулярними інструментами, за допомогою яких генетична інформація реалізується. Без білків, зокрема ферментів, ДНК не може реплицироваться, не може відтворювати себе, тобто позбавлена здатності передавати генетичну інформацію.
Жива природа характеризується поряд властивостей, що відрізняють її від неживої природи, і майже всі ці властивості пов'язані з білками. Перш за все для живих організмів характерні широка різноманітність білкових структур і їх висока впорядкованість; остання існує в часі і в просторі. Дивовижна здібність живих організмів до відтворення собі подібних також пов'язана з білками. Скоротність, рух - неодмінні атрибути живих систем - мають пряме відношення до білкових структур м'язового апарату. Нарешті, життя немислиме без обміну речовин, постійного оновлення складових частин живого організму, тобто без процесів анаболізму і катаболізму (цієї дивовижної єдності протилежностей живого), в основі яких лежить діяльність каталітично активних білків - ферментів.
Таким чином, білки (білкові речовини) складають основу і структури і функції живих організмів. По образному виразу одного з основоположників молекулярної біології Ф. Крику, білки важливі перш за все тому, що вони можуть виконувати найрізноманітніші функції, причому з незвичайною легкістю і витонченістю. Підраховано, що в природі зустрічається приблизно 1010 - 1012 різних білків, що забезпечують існування близько 106 видів живих організмів різної складності організації, починаючи від вірусів і кінчаючи людиною. З цієї величезної кількості природних білків відомі точна будова і структура нікчемно малій частині - не більше 2500. Кожен організм характеризується унікальним набором білків. Фенотипічні ознаки і різноманіття функцій обумовлені специфічністю об'єднання цих білків, у багатьох випадках у вигляді надмолекулярних і мультимолекулярних структур, що у свою чергу визначають ультраструктуру кліток і їх органели.
У клітці Е. соli міститься близько 3000 різних білків, а в організмі людини налічується понад 50000 різноманітних білків. Найдивовижніше, що всі природні білки складаються з великого числа порівняно простих структурних блоків, представлених мономірними молекулами - амінокислотами, зв'язаними один з одним в поліпептидні ланцюги. Природні білки побудовані з 20 різних амінокислот. Оскільки ці амінокислоти можуть об'єднуватися в самій різній послідовності, то вони можуть утворити величезну кількість різноманітних білків. Число ізомерів, яке можна отримати при всіляких перестановках вказаного числа амінокислот в поліпептиді обчислюється величезними величинами. Так, якщо з двох амінокислот можлива освіта тільки двох ізомерів, то вже з чотирьох амінокислот теоретично можливе утворення 24 ізомерів, а з 20 амінокислот - 2,4(1018 різноманітних білків.
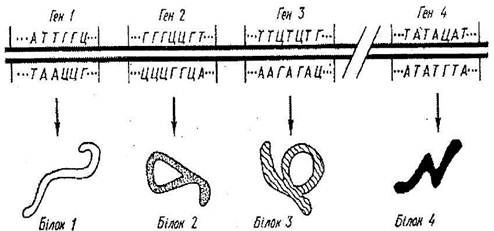
Неважко передбачати, що при збільшенні числа амінокислотних залишків, що повторюються, в білковій молекулі число можливих ізомерів зростає до астрономічних величин. Ясно, що природа не може дозволити випадкових поєднань амінокислотних послідовностей, і для кожного виду характерний свій специфічний набір білків, визначуваний, як тепер відомо, спадковою інформацією, закодованою в молекулі ДНК живих організмів. Саме інформація, що міститься в лінійній послідовності нуклеотидів ДНК, визначає лінійну послідовність амінокислот в поліпептидному ланцюзі лінійний поліпептидний ланцюг сам, що Утворився, тепер виявляється наділеною функціональною інформацією, відповідно до якої вона мимоволі перетвориться в певну стабільну тривимірну структуру. Таким чином, лабільний поліпептидний ланцюг складається, скручується в просторову структуру білкової молекули, причому не хаотично, а в строгій відповідності з інформацією, що міститься в амінокислотній послідовності.
Враховуючи найважливішу роль білків в живій природі, а також те, що білки складають майже половину сухої маси живого організму і наділені поряд унікальних функцій, а в пізнанні структури і функцій білків лежить вирішення багатьох важливих проблем біології і медицини.
Функції білка
Білки виконують безліч найрізноманітніших функцій, характерних для живих організмів. Тут же будуть перераховані головні і в деякому розумінні унікальні біологічні функції білків, не властиві або лише частково властиві іншим класам біополімерів.
Каталітична функція. Всі відомі в даний час біологічні каталізатори - ферменти - є білками. До 1988 р. було ідентифіковано більше 2100 ферментів. Ця функція білків є унікальною, такою, що визначає швидкість хімічних реакцій в біологічних системах.
Живильна (резервна) функція. Цю функцію виконують так звані резервні білки, живлення, що є джерелами, для розвитку плоду, наприклад білки яйця (овальбуміни). Основний білок молока (казеїн) також виконує головним чином живильну функцію. Ряд інших білків поза сумнівом використовується в організмі як джерело амінокислот, які у свою чергу є попередниками біологічно активних речовин, регулюючих процеси обміну речовин.
Транспортна функція. Дихальна функція крові, зокрема перенесення кисню, здійснюється молекулами гемоглобіну - білка еритроцитів. У транспорті ліпідів бере участь Альбумін сироватки крові. Ряд інших сироваткових білків утворює комплекси з жирами, міддю, залізом, тироксином, вітаміном А і іншими з'єднаннями, забезпечуючи їх доставку у відповідні органи-мішені.
Захисна функція. Основну функцію захисту в організмі виконує імунна система, яка забезпечує синтез специфічних захисних білків-антитіл у відповідь на надходження в організм бактерій, токсинів або вірусів. Висока специфічність взаємодії антитіл з антигенами (чужорідними речовинами) за типом білок-білок сприяє пізнаванню і нейтралізації біологічної дії антигенів. Захисна функція білків виявляється і в здібності ряду білків крові до згортання. Згортання білка плазми крові Фібриногену приводить до утворення згустку крові, що оберігає від втрати крові при пораненнях.
Скоротлива функція. У акті м'язового скорочення і розслаблення бере участь безліч білкових речовин. Проте головну роль в цих життєво важливих процесах грають актин і міозин - специфічні білки м'язової тканини. Скоротлива функція властива не тільки м'язовим білкам, але і білкам цитоскелета, що забезпечує якнайтонші процеси життєдіяльності кліток (розбіжність хромосом в процесі мітозу).
Структурна функція. Білки, що виконують структурні функції, займають по кількості перше місце серед інших білків тіла людини. Серед них найважливішу роль грає колаген в сполучній тканині, кератин у волоссі, нігтях, шкірі, еластин в судинній стінці і ін. Велике значення мають комплекси білків з вуглеводами у формуванні ряду секретів - мукоїдів, муцину і так далі В комплексі з ліпідами (зокрема, фосфоліпідами) білки беруть участь в утворенні біомембран кліток.
Гормональна функція. Обмін речовин в організмі регулюється різноманітними механізмами. У цій регуляції важливе місце займають гормони, що виробляються в залозах внутрішньої секреції. Ряд гормонів представлений білками або поліпептидами, наприклад гормони гіпофіза, підшлункової залози і ін.
Можна назвати ще деякі життєво важливі функції білків, зокрема здатність зберігати онкотичний тиск в клітках і крові, буферні властивості, що підтримують фізіологічне значення рН внутрішнього середовища, і ін.
Таким чином, з цього далеко не повного переліку основних функцій білків видно, що вказаним біополімерам належить виняткова і різностороння роль в живому організмі. Якщо спробувати вичленувати головну, вирішальну властивість, що забезпечує багатогранність біологічних функцій білків, то слід було б назвати здатність білків строго вибірково, специфічно з'єднуватися з широким довкола різноманітних речовин. Зокрема, ця висока специфічність білків забезпечує взаємодію ферментів з субстратами, антитіл з антигенами, транспортних білків крові з переносимими молекулами інших речовин і так далі У разі ферментів ця взаємодія заснована на принципі біоспецифічного пізнавання, ферменту, що завершується скріпленням, з відповідною молекулою, що сприяє протіканню хімічної реакції. Високою специфічністю дії наділені також білки, які складають молекулярну основу таких процесів, як диференціювання і ділення клітин, розвиток живих організмів, що забезпечує їх біологічну індивідуальність.
Умови і етапи біосинтезу білка
Трансляція і загальні вимоги до синтезу білка в безклітинній системі.
Пряме відношення до механізмів передачі спадкової інформації має процес трансляції, що означає переклад "чотирьохбуквеної мови нуклеїнових кислот на двадцатилітерну мову білків". Іншими словами, трансляція зводиться до синтезу білка в рибосомах; у цьому синтезі послідовність розташування нуклеотидів в мРНК визначає первинну структуру білка, тобто строго впорядковану послідовність розташування окремих амінокислот в молекулі білка, що синтезується.
При визначенні радіоактивності білків в різних субклітинних фракціях печінки, отриманих методом диференціального центрифугування через різні проміжки часу, було показано, що радіоактивна мітка в першу чергу з'являється у фракції мікросом і лише потім в інших субклітинних утвореннях. Після встановлення місця включення радіоактивної мітки було з'ясовано участь інших субклітинних фракцій і низькомолекулярних клітинних компонентів в синтезі білка. При інкубації мікросом печінки щурів з 14С-лизином включення радіоактивної мітки в білки рибосом спостерігалося за наявності в системі, крім фракції мікросом, ще деяких розчинних компонентів цитоплазми, джерела енергії у формі АТФ системи, а також ГТФ.
Подальші дослідження були направлені на пошук інших компонентів белоксинтезирующей системи.
Білоксинтезуюча система включає: набір всіх 20 амінокислот, що входять до складу білкових молекул; мінімум 20 різних тРНК, що володіють специфічністю до певного ферменту і амінокислоти; набір мінімум 20 різних ферментів - аміноацил-тРНК-синтетаз, що також володіють подвійною специфічністю до якої-небудь певної амінокислоти і одній тРНК; рибосоми (точніше за полісому: що складаються з 4-12 монорибосом з приєднаною до них матричною мРНК); АТФ і АТФ-ГЕНЕРІРУЮЩУЮ систему ферментів; ГТФ, що бере специфічну участь в ініціації і елонгації синтезу білка в рибосомах; іони Mg2+ в концентрації 0,005-0,008 М; мРНК як головний компонент системи, що несе інформацію про структуру білка, що синтезується в рибосомі; нарешті, білкові чинники, що беруть участь в синтезі на різному рівні трансляції.
Розглянемо детальніше структуру і функцію головних компонентів белоксинтезирующей системи.
Рибосоми
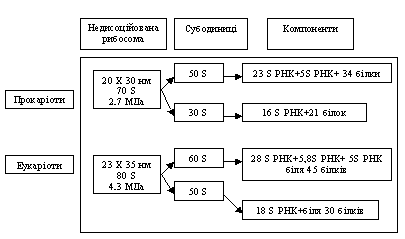
Живі організми, як відомо, залежно від структури кліток діляться на дві групи: прокариоты і эукариоты. Перші не містять обмеженого мембраною ядра і мітохондрій або хлоропластів; вони представлені головним чином мікроорганізмами. Клітки еукаріот тварин і рослин, включаючи гриби, навпаки, містять ядра з мембранами, а також мітохондрії (і у ряді випадків хлоропласти).
Обидва типи кліток містять рибосомы, причому рибосомы эукариот (клітки тварин) приблизно в два рази більше рибосом прокариот (бактерії). Зазвичай рибосоми характеризують за швидкістю їх седиментації у центрифужному полі, яка кількісно виражається константою седиментації s, що виражається в одиницях Сведберга S.
Величина s залежить не тільки від розміру частинок, але і від форми і щільності, так що вона не пропорційна розміру. Число рибосом в мікробній клітці приблизно рівне 104, а эукариот — близько 105.
Хімічно рибосоми є нуклеопротеїнами, що складаються тільки з РНК і білка, причому 80S рибосоми еукаріот містять приблизно рівну їх кількість, а у 70S рибосом прокаріот співвідношення РНК і білка складає 2:1. РНК рибосом прийнято називати рибосомним і позначати рРНК. Як 80S, так і 70S рибосоми складаються з двох субчастинок; це можна за допомогою електронної мікроскопії або шляхом обробки рибосом розчинами, що містять низькі концентрації іонів Mg2+. За цих умов рибосомы дисоціюють на субчастинки; останні можуть бути відокремлені один від одного методом ультрацентрофугування. Одна з субчастинок по розмірах в 2 рази перевищує розмір другої; так, у 70S рибосом величини S для субчастинок рівні 50S і 30S, у 80S рибосом, відповідно 60S і 40S. Субчастинки рибосом кліток еукаріот влаштовані складніше: більше 70 різних білків в обох субчастинках, при цьому велика субчастинка містить 28S, 5,8S і 5S рРНК, а мала містить 18S рРНК (До теперішнього часу повністю розшифрована первинна структура всіх рРНК в 70S і 80S рибосомах і амінокислотній послідовності всіх 55 білків 70S рибосом і частково білків 80S рибосом.).
Для з'ясування тонких молекулярних механізмів синтезу білка в рибосомах необхідні відомості про структуру і функції рибосом. Останнім часом отримані дані, що свідчать про вірогідну просторову тривимірну структуру як цілих рибосом, так і їх субчастинок. Зокрема, з'ясовано, що форму і розміри 30S і 40S рибосом зумовлюють не білкові молекули цих частинок, а третинна структура що входять в їх склад 16S і 18S рРНК. Більш того, за даними акад. А.С. Спірина, для збереження просторової морфологічної моделі всієї 30S субчастинки виявилася достатньою наявність тільки двох білків, що містяться в певних топографічних ділянках молекули 16S рРНК.
Щодо походження рибосом відомо, що рРНК походить із загального попередника всіх клітинних РНК, що у свою чергу синтезується на матриці ДНК в ядрі; рибосомні білки мають походження цитоплазми, потім вони транспортуються в ядерця, де і відбувається спонтанне утворення рибосомних субчастинок шляхом об'єднання білків з відповідними рРНК. Об'єднані субчастинки разом або нарізно транспортуються через пори ядерної мембрани назад в цитоплазму, де ряд рибосом разом з мРНК утворюють полісоми або полірибосоми.
Аміноацил-тРНК-синтетази
Експериментально доведено існування в будь-яких клітках живого організму специфічних ферментів, що каталізують активування амінокислот і скріплення останніх з певними тРНК. Всі ці ферменти виділені в чистому вигляді з E. coli.
Молекулярна маса майже всіх синтетаз рівна 100 000 Так, за винятком фенілаланін-тРНК-синтетази (180 000 Так). Всі вони виявилися чутливими до реагентів на SH-группы і вимагають присутності іонів Mg2+. Ферменти володіють абсолютною специфічністю дії, оскільки вони дізнаються тільки одну яку-небудь L-амінокислоту або одну тРНК; ця обставина надзвичайна важливо, оскільки надалі в білковому синтезі "пізнавання" аміноацил-тРНК засноване не на природі амінокислоти, а на хімічній природі антикодону тРНК. Вважається, що в молекулі кожної аміноацил-тРНК-синтетази є принаймні три центри скріплення: для амінокислоти, тРНК і АТФ; ферменти вельми чутливі також до аналогів амінокислот, які інгібірують активування відповідних амінокислот. Деякі ферменти складаються з одного поліпептидного ланцюга, інші з двох або чотирьох гомологічних або гетерогенних субодиниць.
Аміноацил-трнк-синтетази в активному центрі містять гістидин, імідазольне кільце якого бере участь в скріпленні АТФ за допомогою іонів Mg2+. Найбільшою спорідненістю ці ферменти, як було вказано, володіють по відношенню до молекул специфічних тРНК, хоча конкретний механізм, за допомогою якого ферменти дізнаються відповідну РНК, поки не ясний. В той же час ці ферменти відрізняються низькою молярною активністю (число оборотів не перевищує декількох сотень каталітичних актів в хвилину).
Транспортні РНК
У лабораторії М. Хогланда було з'ясоване, що при інкубації 14С-аминокислоты з розчинної з розчинною фракцією цитоплазми в присутності АТФ і подальшим додаванням трихлороцетової кислоти в білковому осаді, що утворився, мітка не відкривається. Було зроблено висновок, що мічена амінокислота не включається в білкову молекулу. Мітка виявилася пов'язаною ковалентний з РНК, такою, що міститься в безбілковому фільтраті. Показано, що РНК, до якої приєднується мічена амінокислота, має невелику молекулярну масу і зосереджена в розчинній фракції, тому її спочатку назвали розчинною, а потім адапторною або транспортною РНК (тРНК). Трнк припадає на частку приблизно 10 — 15 % загальної кількості клітинної РНК. До теперішнього часу відкрито більше 60 різних тРНК. Для кожної амінокислоти в клітці є принаймні одна специфічна РНК (для ряду амінокислот відкрито більш за одну, зокрема, для серину — 5 різних тРНК, для лізину і гліцину — по 4 різних тРНК, хоча і в цьому випадку кожна тРНК пов'язана із специфічною аміноацил-тРНК-синтетазою). Молекулярна маса більшості тРНК коливається від 24 000 до 29 000 Так. Вони містять від 75 до 85 нуклеотидов. Амінокислоти приєднуються до вільної 3'-OH-групі кінцевого мононуклеотіду, представленого у всіх тРНК АМФ, шляхом утворення ефірного зв'язку. Цікаво, сто всі тРНК володіють не тільки дивно схожими функціями, але і дуже схожою тривимірною структурою.
Встановлена первинна структура майже всіх 60 відкритих тРНК; знання послідовності, а отже, складу тРНК дало в руки дослідників багато цінних відомостей про біологічну роль окремих компонентів тРНК. Загальною для тРНК виявилася також нативна конформація, встановлена методом рентгеноструктурного аналізу і названа спочатку конформацією конюшинового листа; насправді ця конформація має неправильну, Г-подібну форму.
Визначення структури тРНК дозволило виявити ряд відмітних ділянок; так, на 3'-гидроксильном кінці розташовується однакова для всіх тРНК послідовність триплета ЦЦА-ОН, до якої приєднується за допомогою ефірного зв'язку специфічна амінокислота. Скріплення в основному відбувається через 3'-ОН- групу кінцевого аденілового нуклеотиду, хоча отримані докази можливості приєднання амінокислоти через 2'-ОН- групу. Тимін-псевдоуридін-цитиділова (Т(Ц) петливши, мабуть, зв'язує аміноацил-тРНК з поверхнею рибосоми. Є, крім того, додаткова петля, склад якої варіюється у різних типів молекул тРНК; її призначення невідоме. Дигідроуріділова петливши, з іншого боку, виявилася необхідною як сайт (місце) для пізнавання специфічним ферментом — аміноацил-тРНК-синтетазой. Є також антикодонова петливши, що несе триплет, названий антикодоном, і розташована на протилежній стороні від того кінця, куди приєднується амінокислота. Антикодон є специфічним і комплементарним до відповідного кодону мРНК, причому обидва вони є антипаралельними в своїй комплементарності.
Ретельний аналіз нуклеотидных послідовностей різних тРНК показав, що всі вони містять однаковий 5'-кінцевий нуклеотід — ГМФ з вільною 5'-фосфатной групою. Адапторна функція молекул тРНК полягає в пов'язанні кожної молекули тРНК зі своєю амінокислотою. Але оскільки між нуклеїновою кислотою і специфічною функціональною групою амінокислоти не існує відповідності і спорідненості, цю функцію пізнавання повинна виконувати білкова молекула, яка дізнається як молекулу специфічної тРНК, так і специфічної амінокислоти.
Природа генетичної коди
Генетична інформація, закодована в первинній структурі ДНК, переводиться ще в ядрі в нуклеотидную послідовність мРНК. Проте питання про те, яким чином ця інформація передається на білкову молекулу, довго не був з'ясований. Перші вказівки на існування прямої функціональної залежності між структурою гена і його продуктом — білком можна знайти у Ч. Яновського, який в серії витончених дослідів із застосуванням методів генетичного картирування і сективірування показав, що порядок змін в структурі гена мутанта триптофанситази у E. coli в точності відповідає порядку відповідних змін в амінокислотній послідовності молекули білка-ферменту.
Раніше було відомо, що молекули мРНК не володіють спорідненістю до амінокислот, тому для перекладу нуклеотидної послідовності мРНК на амінокислотну послідовність білків потрібний якийсь посередник, названий адаптором. Молекула адаптора повинна бути у свою чергу наділена здатністю дізнаватися нуклеотидну послідовність специфічної мРНК і відповідну амінокислоту. Володіючи подібною адапторною молекулою клітка може включати кожну амінокислоту у відповідне місце поліпептидного ланцюга, в строгій відповідності з нуклеотидною послідовністю мРНК. Залишається, таким чином, непорушним положення, що самі по собі функціональні групи амінокислот не володіють здатністю вступати в контакт з матрицею інформаційної мРНК.
Було показано, що в нуклеотидной послідовності молекули мРНК є кодові слова для кожної амінокислоти — генетичний код. Проблема, проте, зводиться до того, з чого складається цей таємничий код? Найімовірніше, він полягає в певній послідовності розташування нуклеотидів в молекулі ДНК . Питання про те, які нуклеотиди відповідальні за включення певної амінокислоти в білкову молекулу і яку кількість нуклеотидів визначає це включення, залишався невирішеним до 1961 р. Теоретичний розбір показав, що код не може складатися з одного нуклеотиду, оскільки в цьому випадку тільки 4 амінокислоти можуть кодуватися. Але код не може бути і дуплетним, тобто комбінація з двох нуклеотидів з чотирьохбуквеного алфавіту не може охоплювати всіх амінокислот, оскільки подібних комбінацій теоретично можливо тільки 16 (42=16), а до складу білка входять 20 амінокислот. Для всіх амінокислот білкової молекули було б досить узяти триплетний код, коли число можливих комбінацій складе 64 (43=64).
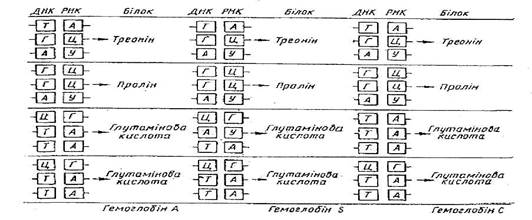
З приведених вище за дані М. Ніренберга стає очевидним, що Полі-у, тобто РНК, що гіпотетично вміщує залишки тільки одного уриділового нуклеотиду, сприяє синтезу білка, побудованого із залишків однієї амінокислоти — фенілаланину. На цій підставі був зроблений вивід, що кодоном для включення фенілаланину в білкову молекулу може служити триплет, що складається з 3 уриділових нуклеотидів, — УУУ. Незабаром було показано, що синтетична матрична поліцитиділова кислота (поли - Ц) кодує утворення поліпролину, а матрична поліаденілова кислота (поли-А) — полілізина. Відповідні триплети — ЦЦЦ і ААА — дійсно виявилися триплетами (названими кодонами) для кодування проліну лізину.
М. Ніренберг, С. Очоа и Х. Корану, користуючись штучно синтезованими мРНК, представили докази не тільки складу, але і послідовності триплетів всіх кодонів, відповідальних за включення кожній з 20 амінокислот білкової молекули.
Генетичний код для амінокислот є виродженим. Це означає, що переважне число амінокислот кодується з декількома кодонами, за винятком метіоніну і триптофану, решта амінокислот має більш за один специфічний кодон. Виродженність коди виявляється неоднаковою для різних амінокислот. Так, якщо для серину, аргініну і лейцину є по 6 кодових слів, то ряд інших амінокислот, зокрема глутамінова кислота, гістидин і Тирозин, мають по два кодони, а триптофан — тільки 1. Слід зазначити, що виродженність найчастіше стосується тільки третього нуклеотиду, тоді як для багатьох амінокислот перші два нуклеотиди є загальними. Цілком допустимо тому припущення, що послідовність перших два нуклеотидов визначає в основному специфічність кожного кодону, тоді як третій нуклеотид менш существен. Останнім часом з'явилися докази гіпотези два з трьох, що означає, що код білкового синтезу, можливо, є квазі- або псевдодуплетним. Є докази, що вырожденность генетичної коди має безперечний біологічний сенс, забезпечуючи організму ряд переваг. Зокрема, вона сприяє "вдосконаленню" генома, оскільки в процесі мутації можуть наступати різні амінокислотні заміни, найбільш цінні з яких відбираються в процесі еволюції.
Іншою відмітною особливістю генетичної коди є його безперервність, відсутність розділових знаків, тобто сигналів, вказуючих на кінець одного кодону і почало іншого. Іншими словами, код є лінійним, що не уривається: АЦГУЦГАЦЦ. Це властивість генетичної коди забезпечує синтез надзвичайно впорядкованої послідовності молекули білків. У всіх інших випадках послідовність нуклеотидов в кодонах порушуватиметься і приводитиме до синтезу "безглуздого" поліпептидного ланцюга із зміненою структурою. Слід вказати на ще одну особливість коди — його універсальність для всіх живих організмів: від Е. соli до людини.
Серед 64 мислимих кодонів сенс має 61, тобто кодує певну амінокислоту. В той же час три кодони, а саме УАГ, УАА, УГА є безглуздими, нонсенсом-кодоном, оскільки вони не кодують жодної з 20 амінокислот. Проте ці кодони не позбавлені сенсу, оскільки виконують важливу функцію в синтезі білка в рибосомах (функцію закінчення, термінації синтезу).
При дослідженні генетичної коди в дослідах in vivo були також отримані докази універсальності коди. Проте останнім часом з'ясовані деякі відмінності коди в мітохондріях еукаріот тварин, включаючи людину, що відрізняється чотирма кодонами від генетичної коди цитоплазми, навіть тих же кліток. Зокрема, АУГ, що є зазвичай ініціаторним кодоном, кодує також метіонін в ланцюзі, і УГА, що є нонсенсом-кодоном, кодує в мітохондріях триптофан. Крім того, кодони АГА і АГГ є для мітохондрій що швидше термінують, а не що кодують аргінін. Як результат цих змін, для прочитування генетичної коди мітохондрій потрібний менше за разных тРНК, тоді як система цитоплазми трансляції володіє повним набором тРНК.
Етапи синтезу білка
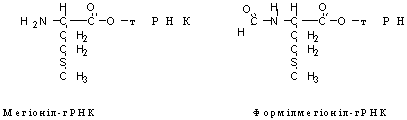
Синтез білка представляє собою циклічний багатоступінчатий енергозалежний процес, в якому вільні амінокислоти полімеризуються в генетично детерміновану послідовність з утворенням поліпептидів. Система білкового синтезу, точніше, система трансляції, яка використовує генетичну інформацію, транскибіровану в мРНК, для синтезу поліпептидного ланцюга з зазначеною первинною структурою, включає близько 200 типів макромолекул — білків і нуклеїнових кислот. Серед них близько 100 макромолекул, що беруть участь в активуванні амінокислот і їх перенесенні на рибосоми (все тРНК, аміноацил-тРНК-синтетази), більше 60 макромолекул, що входять до складу 70S або 80S рибосом, і близько 10 макромолекул (званих білковими чинниками), що беруть безпосередню участь в системі трансляції. Не розбираючи детально природу інших важливих для синтезу чинників, розглянемо детально механізм індивідуальних шляхів синтезу білкової молекули в штучній синтезуючій системі. Перш за все, за допомогою ізотопного методу було з'ясовано, що синтез білка починається з N-кінця і завершується С-кінцем, тобто процес протікає у напрямі NH2 ( COOH.
Білковий синтез, або процес трансляції, може бути умовно роздільний на два етапи: активування амінокислот і власне процес трансляції.
Активування амінокислот
Необхідною умовою синтезу білка, який кінець кінцем зводиться до полімеризації амінокислот, є наявність в системі не вільних, а так званих активованих амінокислот, що мають в своєму розпорядженні свій внутрішній запас енергії. Активація вільних амінокислот здійснюється за допомогою специфічних ферментів аміноацил-тРНК-синтетаз в присутності АТФ. Цей процес протікає в дві стадії, причому обидві каталізують одними ферсентом. На першій стадії амінокислота реагує з АТФ і утворюється пірофосфат і проміжний продукт, який на другій стадії реагує з відповідною 3'- ОН-ТРНК, внаслідок чого утворюється аміноацил -тРНК (аа-тРНК) і звільняється АМФ. АМІНОАЦИЛ-ТРНК має в своєму розпорядженні необхідний запас енергії. Необхідно підкреслити, що амінокислота приєднується до кінцевого 3'- ОН-ГИДРОКСИЛУ (або 2'-ОН) АМФ, який разом з двома залишками ЦМФ утворює кінцевий триплет ЦЦА, що є однаковим для всіх транспортних РНК.
Похожие работы
... і мембрани втрачають свою активність або її частину. Наприклад, вже згадувана (Na+-K+)-АТФ-аза. Компартменталізація уможливлює клітині просторове суміщення протилежних хімічних реакції. Наприклад, синтез жирних кислот проходить у цитозолі, а їх розщеплення – у мітохондріях. Внутрішні мембрани служать для зберігання різних, іноді агресивних, речовин. Наприклад, лізосоми містять ферменти, здатні ...
... і всіх розв'язних документів, необхідна певна законодавча база, що дозволяє у випадках появи негативних наслідків з юридичної точки зору вирішити проблему, що створилася. 1. Теоретичні основи генно-модифікованих продуктів Генетична інженерія - це нова галузь молекулярної біології, яка розробляє методи перенесення генетичного матеріалу від одного живого організму до іншого з метою ...
... кількості мітохондрій в період оогенезу. У багатьох тварин розмноження мітохондрій відбувається в основному до початку вітелогенезу. Наприклад, у жаби в період вітелогенезу і на ранніх стадіях ембріогенезу мітохондрії практично не діляться, тобто інтенсивне розмноження іде в превітелогенних ооцитах [Айзенштадт, 1984]. Таким чином, активна реплікація мітохондріальної ДНК в превітелогенних ооцитах ...
... механізмів клітинної резистентності до цисплатина розглядають особливості будови цитоплазматичної мембрани та прямого та зворотнього транспорту крізь неї. Однією з особливостей пухлинних клітин, резистентних до дії цисплатина, є зменшена у порівнянні з чутливими клітинами акумуляція препарату [31,32]. Дана модель пояснює, чому так багато клітинних ліній резистентних до дії цисплатина відрі ...

0 комментариев