Навигация
Матеріали та методи досліджень
2. Матеріали та методи досліджень
Дослідження проводили на мухах Drosophila melanogaster, що відносяться до родини Drosophilidae із відділу Diptera. Дрозофіла є класичним об’єктом генетичних досліджень, завдяки наступним властивостям. По-перше, у неї порівняно короткий період онтогенезу; по-друге, вона легко виживає та розвивається в лабораторних умовах, а також не потребує значних витрат на розведення та харчування.
Для цих мух комфортною температурою вважається 24 – 25С. При такій температурі цикл розвитку дрозофіли від яйця до дорослої мухи складає приблизно 10 діб. Розвиток яйця триває 20 годин, а розвиток личинки і лялечки – 8 діб. Таким чином за рік можна отримати до 40 поколінь дрозофіли. При температурі вищій за 31С дрозофіла стає безплідною, хоча в природних умовах вона може витримувати і більш високі температури. Зі зниженням температури цикл розвитку мух дуже уповільнюється. Так, при температурі 10С період личинки та лялечки значно зростає у часі.
культивування мух із досліджуваних популяцій проводили у скляних банках (200 мл) при температурі 24С у стандартних умовах. для годування дрозофіли зазвичай використовують корм із дріжджами. Крім них також використовували: цукор як субстрат для розвитку дріжджів та агар-агар, що надає корму желеподібної консистенції. Харчову масу готують із наступних співвідношень компонентів на 1 літр води:
агар-агар – 50 г
цукор-пісок – 36г
манна крупа – 36г
дріжджі – 27г
В ході експерименту аналізу піддавали мух із популяцій різного походження – К (Київ), Од (Одеса), В (Варва), П (Пирятин), Оз (Озеро із Чорнобильської зони) та сад (Яблуневий сад із Чорнобильської зони), що були люб`язно надані співробітниками кафедри генетики Київського національного університету ім. Т.Г. Шевченка.
Тривалість життя мух за голодування досліджували наступним чином. У пробірки (10 мл) без корму поміщали окремо по 10 самок та самців кожної популяції. Використовували особин триденного віку, попередньо на протязі трьох діб вони мали можливість харчуватися. Спостереження за досліджуваними мухами проводили з інтервалом у три години (вісім разів на добу). При цьому визначалася кількість особин, що вижили. В перші дні досліду смертність мух ще не дуже висока, пізніше починається масова їх загибель. Підрахунок вели до моменту загибелі половини мух у пробірці (Lt50). Тривалість життя мух за умов голодування виражали у годинах. Досліди проводили в десятикратній повторності.
Активність АДГ в экстрактах тканин дрозофіли визначали спектрофотометрично на СФ-26, використовуючи інкубаційну суміш наступного складу: 0,05 М тріс-НCL буфер, pH 8,5; 1,2 мM NAD+; 0,1 M спирт. Активність ферменту оцінювали по збільшенню вмісту NADН в середовищі інкубації на протязі 3 хвилин. В якості субстрату використовували ізопропанол. Активність АДГ виражали в нмолях NADН/хв∙мг білку [McKechnie, Geer, 1984].
Статистичну обробку отриманих даних здійснювали за допомогою критерія Стьюдента (Рокицкий, 1973)
1). Визначали середнє значення тривалості життя в умовах голодування:
![]() , де
, де
М – середнє значення тривалості життя при голодуванні; n – кількість дослідів.
2). Визначали квадратичне відхилення:
![]() , де
, де
М – а – різниця середнього та індивідуальних значень тривалості життя.
3). Визначали помилку середньоарифметичного значення тривалості життя:
![]() , де
, де
m – помилка середньоарифметичного значення; – квадратичне відхилення
При р > 0.05 відмінності не достовірні;
Якщо р < 0,05 – відмінності достовірні
3. Результати досліджень та їх обговорення
дані, отримані в експерименті при вивченні стійкості мух до голодування, наведено в таблиці.
Таблиця
Тривалість життя при голодуванні мух із досліджуваних популяцій, години (Lt50)
| Популяції | Самки | Самці | Самки та самці |
| Одеса | 39,60 1,60# | 34,50 1,02* # | 37,05 1,55# |
| Київ | 24,60 2,53** | 23,40 2,06** | 24,00 2,21** |
| Варва | 32,70 ± 1,22** # | 26,70 ± 1,64* ** | 29,70 ± 1,02** # |
| Пирятин | 34,80 ± 1,28** # | 29,70 ± 1,26* ** # | 32,25 ± 1,02** # |
| Озеро | 30,90 ± 1,09** # | 34,50 ± 1,03# | 32,70 ± 1,18** # |
| Сад | 33,00 ± 1,38** # | 29,40 ± 1,25** # | 31,20 ± 0,10** # |
* – Різниця достовірна порівняно з самками.
** – Різниця достовірна порівняно з Одеською популяцією.
# – Різниця достовірна порівняно з Київською популяцією.
Із представлених в таблиці та на рис. 1 даних видно, що самки і самці із популяції Києва не відрізняються по стійкості до голодування, адже тривалість їх життя в умовах досліду приблизно однакова (24,6 2,53 та 23,4 2,06 години відповідно). Так само не виявляють статевих відмінностей за цією ознакою і мухи із Чорнобильської зони. Самки і самці із популяції Озера виживали за голодування 30,90 ± 1,09 і 34,50 ± 1,03 годин відповідно, а із популяції Саду – 33,00 ± 1,38 і 29,40 ± 1,25 годин відповідно. Самки із популяцій Одеси, Варви і Пирятина виявилися більш витривалими в умовах голодування порівняно з самцями.
Години(Lt50)
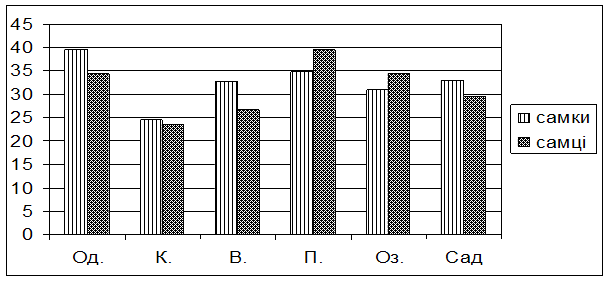
Рис. 1. Тривалість життя при голодуванні самок та самців досліджуваних популяцій дрозофіли
Порівнюючи результати власного експерименту із даними, опублікованими в опрацьованій літературі [Билева, Зимина и др., 1978; Хаустова, Тоцкий, 1990; Хаустова, Тоцкий и др., 2004), можна підтвердити, що самки мають вищу стійкість до голодування, ніж самці, але ця залежність виявляється не завжди і лише за певних умов..
На рис. 2 показані міжпопуляційні відмінності у самок і самців досліджуваних популяцій.
Години (Lt50)
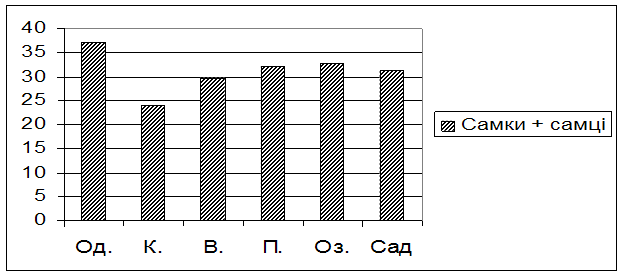
Рис. 2. Тривалість життя в умовах голодування мух із досліджуваних популяцій
Мухи із популяції Одеси виявились найбільш стійкими до голодування – вони прожили 37,05 1,55 годин в даних умовах. Дещо нижчий показник тривалості життя в умовах голодування належить мухам із популяцій Пирятина та Озера і складає 32,25 ± 1,02 та 32,70 ± 1,18 годин відповідно. Досліджувані мухи із популяції Варви і саду мають середні показники тривалості життя, а саме: 29,70 ± 1,02 та 31,20 ± 0,10 години. Найменшу тривалість життя показали мухи, відібрані із популяції Києва, – вони прожили лише 24,00 2,21 годин в дослідних умовах.
Таким чином, мухи із популяції Одеси в цілому мають найвищу стійкість до голодування, а у мух київської популяції даний показник пристосованості виявився найнижчим.
Відмінності по тривалості життя в умовах голодування у досліджуваних популяцій дрозофіли можна пояснити, скоріш за все, наявністю у них різних алельних генів, що вносять різний вклад у генетичну детермінацію даної ознаки. Це також може бути пов’язано з географічним розташуванням досліджуваних природних популяцій.
На рис. 3 представлені дані по активності АДГ у мух досліджуваних популяцій.
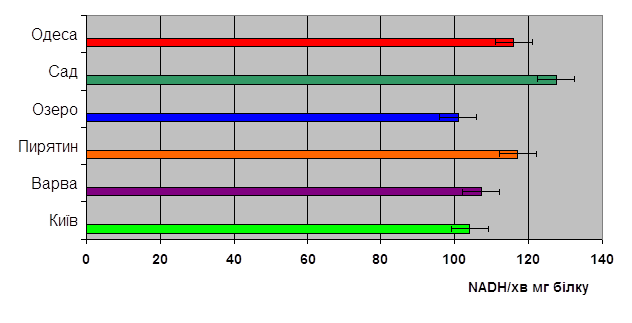 Рис. 3. Активність АДГ у мух досліджуваних популяцій
Рис. 3. Активність АДГ у мух досліджуваних популяцій
Аналізуючи дані, приведені на рис. 3, приходимо до висновку, що у мух досліджуваних популяцій є суттєві відмінності в активності АДГ.
Так, найвища активність ферменту (127.46 NADН/хв∙мг білку) спостерігалась у мух із популяції Саду Чорнобильської зони. Високою активністю АДГ відрізнялись і мухи із популяцій Пирятина та Одеси (117.02 та 115.97 NADН/хв∙мг білку відповідно). Достовірно нижча активність АДГ порівняно із такою у мух Саду Чорнобильської зони спостерігалась у мух із популяцій Варви та Києва (107.21 та 104.06 NADН/хв∙мг білку). найнижча активність АДГ притаманна мухам озерної популяції (100.93 NADН/хв∙мг білку).
Зазвичай рівень активності АДГ залежить від алельного стану структурного гена Adh. За даними літератури [Chambers, Wilks et all., 1984] електрофоретично швидкорухомий АДГ-F алозим відрізняється високою активністю, а менш рухомий АДГ-S алозим – низькою активністю, але більшою, ніж АДГ-F, термостабільністю ферменту.
в той же час відома залежність деяких показників пристосованості дрозофіли від приналежності мух до того чи іншого Adh-варіанту і від рівня активності ферменту [Хаустова, Тоцкий, 1990]. Установлено, що активність AДГ впливає на виживаність дрозофіли при помірно високій концентрації спирту в середовищі, в умовах голодування, в процесі старіння мух і ін. Причиною цього є надзвичайно важлива роль AДГ в утилізації и детоксикації спиртів – природного середовища існування дрозофіли.
В умовах проведеного експерименту не виявлено прямої залежності між витривалістю мух в умовах голодування і активністю їх АДГ, в той же час аналіз приведених даних (рис. 2, 3) свідчить, що стійким до голодування мухам із Одеської популяції притаманна досить висока активність АДГ, а чутливим до голодування мухам Київської популяції – менша активність ферменту.
Узагальнення
Однією із показових характеристик пристосованості є стійкість до голодування здатність вижити в екстремальних умовах нестачі корму.
Більшість тварин різних видів на протязі життя переживають періоди скорочення раціону і тому у них еволюційно закріплені адаптації, що підсилюють їх стійкість до голодування. Знання про генетичні та фізіологічні засади цих адаптацій, їх еволюційні зв`язки (як внутрішньовидові, так і популяційні) отримані значною мірою завдяки дослідженням на дрозофілі.
Так як і інші фенотипічні характеристики пристосованості, стійкість до голодування в значній мірі визначається генотипом, контролюється великою кількістю взаємодіючих генів і проявляє значну мінливість в природних популяціях. Ось чому генотипічно різним особинам зазвичай притаманна неоднакова стійкість до голодування.
В контексті вивчення механізмів адаптації генотипів та популяцій до дії екологічних факторів вважається доцільним вияснити роль ферменту алкгольдегідрогенази (АДГ) в життєдіяльності та адаптації у Drosophila melanogaster. Ген-ензимна система АДГ на протязі тривалого часу притягує увагу численних дослідників в різних областях генетики – від молекулярної до популяційної, завдяки відносно простій ідентифікації ферменту, значному поліморфізму і тій ключовій ролі, що АДГ відіграє в життєдіяльності дрозофіли.
З метою визначення тривалості життя при голодуванні в даній роботі дослідження проводили на мухах із популяцій різного походження – К (Київ), Од (Одеса), В (Варва), П (Пирятин), Оз (Озеро із Чорнобильської зони) та сад (Яблуневий сад із Чорнобильської зони).
В результаті проведених досліджень встановлено, що найбільш витривалими до дії голоду виявились самки із популяцій Одеси, Варви і Пирятина в порівнянні із самцями цих же популяцій. В цілому, найбільшу стійкість до голодування мають мухи Одеської популяції, а найменшу – мухи Київської популяції.
У мух досліджуваних популяцій є суттєві відмінності в активності АДГ. Так, найвища активність ферменту спостерігалась у мух із популяції Саду Чорнобильської зони. Високою активністю АДГ відрізнялись і мухи із популяцій Пирятина та Одеси. Достовірно нижча активність АДГ порівняно із такою у мух Саду Чорнобильської зони спостерігалась у мух із популяцій Варви та Києва. найнижча активність АДГ притаманна мухам озерної популяції.
Підсумовуючи дані проведеного експерименту, стверджуємо, що прямої залежності між тривалістю життя мух в умовах голодування і активністю їх АДГ не виявлено. Однак, аналіз отриманих результатів свідчить, що стійким до голодування мухам із Одеської популяції притаманна досить висока активність АДГ, а чутливим до голодування мухам Київської популяції – менша активність цього ферменту.
Висновки
1. Самки із популяцій Одеси, Варви і Пирятина були більш витривалими в умовах голодування порівняно з самцями.
2. Найбільшу стійкість до голодування виявили мухи Одеської популяції, а найменшу – мухи Київської популяції.
3. стійким до голодування мухам із Одеської популяції притаманна досить висока активність АДГ, а чутливим до голодування мухам Київської популяції – менша активність ферменту.
4. В цілому в умовах проведеного експерименту не виявлено прямої залежності між витривалістю мух в умовах голодування і активністю їх АДГ.
Список цитованої літератури
1. Бей-Биенко Г.Я. Определитель насекомых Европейской части СССР - Л: Наука, 1970 – С.199 – 209.
2. Билева Д.С., Зимина Л.Н., Малиновский А.А. Влияние генотипа и среды на продолжительность жизни D. melanogaster // Генетика, 1978. - Т.11 .-№ 5. – С. 848 – 852.
3. Гаврилов Л.А., Гаврилова Н.С. Биология продолжительности жизни М.: Наука, 1991 - 280 с.
4. Лобашев М.Е., Генетика, ЛГУ, 1967 - 718 с.
5. Медведев Н.Н. Практическая генетика - М.: Наука, 1966. - С. 21, 41, 167 - 174.
6. Рокицкий П.Ф. Введение в статистическую генетику.- Минск: Изд-во «Высшая школа», 1973. - 447 с.
7. Тоцький В.М. Генетика. – Одеса: Астропринт, 2008. – 710 с.
8. Тоцкий В.Н., Хаустова Н.Д., Стрельцова Н.А. Полиморфизм алкогольдегидрогеназы и генотипическая адаптация D. melanogaster к действию селективных факторов // Цитология и генетика. – 1995. – Т. 29. – № 6. – С. 54 – 60.
9. Хаустова Н.Д., Тоцкий В.Н. Алкогольдегидрогеназа и адаптация к этанолу у дрозофилы // Генетика. – 1990. – Т. 26. – № 8. – С. 1427 – 1434.
10. Хаустова Н.Д., Моргун С.В. Ген-энзимная система АДГ и приспособленность мутантов D. Melanogaster // Генетика. - 1999 - Т. 35.- № 5. - С. 600 - 605.
11. Хаустова Н.Д. Локус Adh Drosophila melanogaster в условиях отбора на задержку старения // Генетика. – 1995. – Т. 31. – № 5. – С. 646 – 651.
12. Хаустова Н.Д., Тоцкий В.Н., Нассер М.Ю., Стрельцова Н.А. Частота рекомбинаций и приспособленность дрозофилы при структурных перестройках генотипа // Вісник Одеського національного університету. – 2004. – Т. 9. – Вип. 1. – С. 142 – 151.
13. Хвостова В.В., Корочкин Л.И., Голубовский М.Д. Проблемы генетики в исследованиях на дрозофиле. – Новосибирск: Наука, 1977. – 282 с.
14. Черник Я.И., Корытко О.Р., Белоконь Е.М. Возрастные изменения алкогольдегидрогеназы, малатдегидрогеназы и лактатдегидрогеназы Drosophila melanogaster // Онтогенез. – 1982. – Т. 13. – № 5. – С. 169 – 174.
15. Яблоков А.В., Юсуфов А.Г. Эволюционное учение (Дарвинизм). – М.: Высшая школа, 1989. – 335 с.
16. Archer M.A., Phelan, J.P., Beckman, K.A., Rose, M.R. Breakdown in correlations during laboratory evolution. II. Selection on stress resistance in Drosophila populations // Evolution. - 2003. - № 57. - P. 536 – 543.
17. Arsham A.M., Neufeld T.P. Thinking globally and acting locally with TOR. // Curr. Opin. Cell. Biol. - 2006. - № 18. - P. 589 - 597.
18. Burger J.S.M., Hwangbo D.S., Corby-Harris V., Promislow, D.E.L. The functional costs and benefits of dietary restriction in Drosophila // Aging Cell. - 2007. - № 6. - P. 63 - 71.
19. Chambers G.K., Wilks A.V., Gibson J.B. Variation in the biochemical properties of the Drosophila alcohol dehydrogenase allozymes // Biochem. Genet. – 1984. – Vol. 22. – № 1 – 2. – P. 153 – 168.
20. Chippindale A.K., Leroi A.M., Kim S.B., Rose M.R. Phenotypic plasticity and selection in Drosophila life history evolution. 1. Nutrition and the cost of reproduction.// J. Evol. Biol. - 1993. - № 6. - P. 171 - 193.
21. Coyne J.A., Elwyn S. Does the desaturase-2 locus in Drosophila melanogaster cause adaptation and sexual isolation? // Evolution. - 2006. - № 60. - P. 279 - 291.
22. Dorado D., Barbancho M. Differential responses in Drosophila melanogaster to environmental ethanol: modification of fitness components at Adh locus // Heredity. – 1984. – Vol. 53. – № 2. – P. 309 – 320.
23. Greenberg A.J., Moran J.R., Coyne J.A. , Wu C.I. Ecological adaptation during incipient speciation revealed by precise gene replacement. // Science. - 2003. - № 302. - P. 1754 - 1757.
24. Harbison S.T., Yamamoto A.H., Fanara J.J., Norga K.K., Mackay T.F.C. Quantitative trait loci affecting starvation resistance in Drosophila melanogaster. // Genetics. - 2004. - № 166. - Р. 1807 - 1823.
25. Harshman L.G., Moore K.M., Sty M.A., Magwire, M.M. Stress resistance and longevity in selected lines of Drosophila melanogaster. // Neurobiol. Aging. - 1999b. - 20. - P. 521 - 529.
26. Harshman L.G., Schmid J.L. Evolution of starvation resistance in Drosophila melanogaster: aspects of metabolism and counter-impact selection. // Evolution. - 1998. - № 52. - P. 1679 – 1685.
27. Harshman L.G., Hoffmann A.A., Clark A.G. Selection for starvation resistance in Drosophila melanogaster: physiologicalcorrelates, enzyme activities and multiple stress responses. // J. Evol. Biol. - 1999a. - 12. - P. 370 - 379.28. Huey R.B., Suess J., Hamilton H., Gilchrist G.W. Starvation resistance in Drosophila melanogaster: testing for a possible ’cannibalism’ bias. // Funct. Ecol. - 2004. - № 1. - P. 952 - 954.
29. Kapahi P., Zid B.M., Harpe, T., Koslover D., Sapin V., Benzer, S. Regulation of lifespan in Drosophila by modulation of genes in the TOR signaling pathway. // Curr. Biol. - 2004. - № 14. - P. 885 - 890.
30. Leroi A.M., Kim S.B., Rose M.R. The evolution of phenotypic life-history trade-offs – an experimental study using Drosophila melanogaster. // Am. Nat. - 1994. - № 144. - P. 661 - 676.
31. Lin Y.J., Seroude L., Benzer S. Extended life-span and stress resistance in the Drosophila mutant methuselah. // Science. - 1998. - № 282. - P. 943 - 946.
32. Mackay T.F.C., Fry J.D. Polygenic mutation in Drosophila melanogaster: genetic interactions between selection lines and candidate quantitative trait loci. // Genetics. - 1996. - № 144. - P. 671 - 688.
33. Partridge L., Piper M.D.W., Mair W. Dietary restriction in Drosophila. // Mech. Ageing Dev. - 2005. - № 126. - P. 938 - 950.34. Piper M.D.W., Skorupa D., Partridge, L. Diet, metabolism and lifespan in Drosophila. // Exp. Gerontol. - 2005. - № 40. - P. 857 - 862.
35. Piper,M.D.W., Skorupa D., Partridge L. Diet, metabolism and lifespan in Drosophila. // Exp. Gerontol. – 2005. - № 40. - P. 857 - 862.
36. Schmidt P.S., Matzkin L., Ippolito M., Eanes W.F. Geographic variation in diapause incidence, life-history traits, and climatic adaptation in Drosophila melanogaster. // Evolution. - 2005a. - № 59. - P. 1721 - 1732.
37. Tatar M., Bartke A., Antebi A. The endocrine regulation of aging by insulin-like signals. // Science. - 2003. - № 299. - P. 1346 - 1351.
0 комментариев