Навигация
Механизм реакции переаминирования
1.2.3 Механизм реакции переаминирования
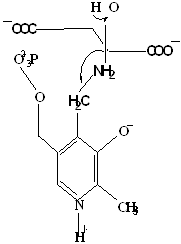
Общая теория пиридоксалевого капитализма была разработана в 1952 году А.Е. Браунштейном и М.М. Шемякиным, а несколько позднее – Д.Е.Мецлером и Э.Снеллом. Согласно этой теории действие пиридоксалевых ферментов обусловлено способностью альдегидной группы пиридоксальфосфата образовывать с аминокислотами альдимины (основания Шиффа) (рисунок1)/27/. В образующемся альдимине имеется система сопряженных двойных связей, по которой происходит смещение электронов от α – углеродного атома аминокислоты к электрофильному атому азота пиридинового кольца кофермента. Понижение электронной плотности у α– углеродного атома приводит к поляризации и ослаблению связей у этого атома.
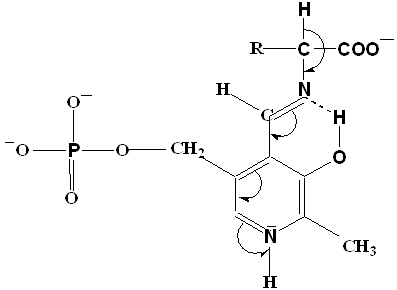
Рисунок 1 - Смещение электронов к атому N кофермента.
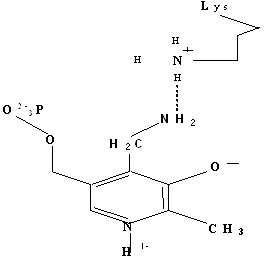
Проведенные А.Е. Браунштейном и Э.Снеллом модельные эксперименты показали, что избирательный разрыв только одной из этих связей с образованием карбаниона, определяется особенностями строения активного центра фермента. Эти представления получили подтверждения при исследовании очищенных фосфопиридоксалевых ферментов. В 1966 году Донатан выдвинул и теоретически обосновал важное положение о том, что в альдимине, фиксированном в активном центре фермента, должна разрываться та из связей у α – углеродного атома, которая ориентирована перпендикулярно к плоскости пиридинового кольца пиридоксальфосфата. При такой ориентации энергия, необходимая для разрыва связи, минимальная вследствие перекрывания электронной орбитали связи с сопряженной π – системой кофермента ( σ – π - перекрывание). Донатан предположил, что конформация может контролироваться апоферментом, возможно с помощью связывания карбоксилат – иона, а также, что имин может принимать одну из трех возможных конформаций/29/.
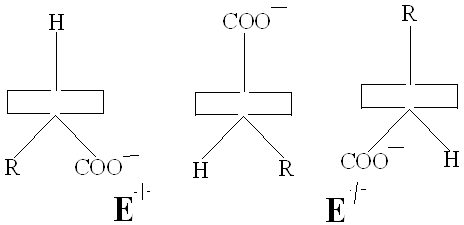
Здесь прямоугольником обозначена плоскость пиридинового кольца, вертикальной линией изображена σ – связь. Конформамация (1) благоприятствует переаминированию.
Методами спектрального анализа было установлено, что альдегидная группа связанного в активном центре пиридоксальфосфата образует так называемое “внутреннее” основание Шиффа с ε- NH2 – группой остатка лизина в белке. Из этого следует, что на начальном этапе каталитической реакции α – аминогруппа субстрата вытесняет ε- NH2 – группу лизина из связи с коферментом (стадия трансальдиминирования). На основании изучения спектральных, химических и кинетических свойств аспартат – трансаминазы был сделан вывод о том, что как прямая, так и обратная реакция переаминирования состоят из восьми стадий; интермедиаты, возникающие на этих стадиях, представлены на рисунке 2/27,28/.
На первом стадии происходит присоединение к ферменту субстратной аминокислоты с образованием нековалентного комплекса Михаэлиса. Далее один из протоков аминогруппы субстрата переходит на атом азота внутренней иминной связи (стадия 2); в результате аминогруппа приобретает нуклеофильные свойства, необходимые для атаки на атом С-4' кофермента. Эта атака приводит к образованию промежуточного тетраэдрического соединения (геминального диамина, стадия 3); за этим следует освобождение ε- NH2 – группы остатка лизина из связи с пиридоксальфосфатом и возникновение "внешнего" или субстратного альдимина (стадия 5), одной из форм которого является хинолоид показанный на рис.2. Последующее протонирование атома С-4' дает кетимин (стадия 6), при гидролизе которого образуется ПМФ – форма фермента и оксокислота (стадии 7 и 8). Далее реакция идет в обратном направлении между ПМФ – формой трансаминазы и другой ококислотой и приводит к регенерации ПЛФ – формы ("внутреннего" альдимина) и образованию новой аминокислоты.
Таким образом, реакции переаминирования являются обратимыми и универсальными для всех живых организмов. Пиридоксальфосфат в этих реакциях выполняет роль переносчика аминогруппы и в конечной стадии освобождается и может вновь вступить в ферментативный процесс.
Рисунок 2 - Основные интермедиаты, образующиеся в ходе реакции переаминирования.
а – внутренний альдимин;
б – нековалентный комплекс Михаэлиса;
в – то же, что σ, но атом иминного азота протонирован;
г– геминальный диамин;
д– внешний альдимии;
е - хинолоид;
ж – кетимин;
з – карбиноламин;
и- пиридоксаминфосфат.
![]()
![]()




![]()
![]()
![]()

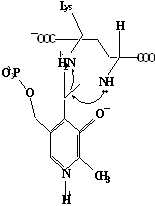



0 комментариев