Навигация
В колпачке "Центрикона-100" собирается выделенная ДНК, готовая к проведению ПЦР. Образец можно хранить при температуре –20 °С
14. В колпачке "Центрикона-100" собирается выделенная ДНК, готовая к проведению ПЦР. Образец можно хранить при температуре –20 °С.
Для проведения ПЦР берут 4 - 6 мкл супернатанта при суммарном объеме реакционной смеси ПЦР 25 мкл.
Формула пересчета скорости вращения ротора центрифуги при использовании "Центрикона-100":
g = 118 × 10-7 × n2 × r;
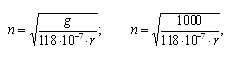
где g - центрифужное поле (g=1000);
r - радиус, см (расстояние от центра ротора до оси вращения колонки фильтра, измеряется эмпирически для используемой центрифуги);
n - скорость вращения ротора, об/мин (задается на центрифуге).
Приготовление растворов для выделения ДНК из стержня волоса
Ниже приводятся прописи шести растворов, которые готовят предварительно и затем используют при составлении смесей растворов, необходимых для данного метода. При приготовлении растворов используют деионизированную воду.
Раствор № 1. 1 М раствор трис-HCl, pH 7,5 (1 л):
растворить 121,1 г трис-HCl в 800 мл воды, довести pH раствора до 7,5 концентрированной соляной кислотой (приблизительно 65 мл), добавить воду до объема 1 л.
Раствор № 2. 0,5 М раствор ЭДТА, рН 8,0 (1 л):
растворить 186,1 г двузамещенной соли ЭДТА´2Н2О в 800 мл воды, довести рН раствора до 8,0 едким натром (динатриевая соль ЭДТА не растворяется до тех пор, пока рН раствора не будет 8,0), добавить воду до объема 1 л. Хранить при комнатной температуре.
Раствор № 3. 5 М раствор NaCl (1 л):
растворить 292,2 г NaCl в 800 мл воды и довести объем раствора до 1 л. Разлить по 100 мл.
Раствор № 4. 20% раствор натрия додецилсульфата SDS (100 мл):
растворить 20 г SDS в 80 мл воды при 60 °С, довести объем раствора до 100 мл.
Раствор № 5. 1 М раствор ацетата Na, рН 5,2 (100 мл):
растворить 13,6 г CH COONa´3H2O в 80 мл воды, довести рН раствора до 5,2 уксусной кислотой (примерно 2 мл), добавить воду до объема 100 мл.
Раствор № 6. 1 М раствор трис-НСl (1 л):
растворить 121,1 г трис-HCl в 800 мл воды, довести рН раствора до 8,0 концентрированной соляной кислотой (приблизительно 45 мл), добавить воду до объема 1 л.
С помощью растворов № 1 - 6 готовят следующие смеси, используемые в методике:
Буфер 1.
10 мМ трис-НСl, рН 7,5;
10 мМ ЭДТА;
50 мМ NaCl;
2% SDS.
Смешать 1 мл 1 М трис-НСl (рН 7,5), 2 мл 0,5 М ЭДТА, 1 мл 5 М NaCl, 10 мл 20% SDS и 86 мл воды. Хранить при температуре 4 °С.
1 М ДТТ.
Растворить 770 мг детиотреитола в 5 мл воды и добавить 50 мкл 1 М ацетата натрия. Хранить в аликвотах не более 200 мкл при температуре –20 °С.
10 мг/мл протеиназа К.
Растворить 10 мг протеиназы К в 10 мл воды. Хранить в аликвотах не более 200 мкл при температуре –20 °С.
Фенол-хлороформ.
Смешать10 частей фенола, насыщенного 1 М трис-НСl (рН 7,5), с 9 частями хлороформа. Хранить при температуре 4 °С не более двух месяцев, в темной емкости.
н-Бутанол.
Добавить 100 мл воды к 100 мл н-бутанола, перемешать. Бутанол находится в верхней фазе. Хранить при температуре 4 °С.
ТЕ-Буфер.
10 мМ трис-НСl, рН 8,0;
0,1 мМ ЭДТА.
Смешать 10 мл 1 М трис-НСl (рН 8,0) с 200 мкл 0,5 М ЭДТА и 990 мл воды. Хранить при температуре 4 °С.
МЕТОДИКА ВЫДЕЛЕНИЯ ДНК ИЗ ЛУКОВИЦЫ ВОЛОСА
Данная методика используется при исследовании волоса, на корневой части которого присутствуют влагалищные оболочки; это, как правило, бывает у вырванных жизнеспособных волос (см. рис. 1). Используют 20% взвесь ионообменной смолы Chelex, приготовленную в стерильной дистиллированной воде. Принцип метода заключается в гидролизе, "растворении" волоса при кипячении с ионообменной смолой Chelex, которая сорбирует различные примеси, и в том числе примеси белков.
Волос микроскопируют, отмывают (как описано выше), отрезают луковицу волоса с 2 - 3 мм стержня и помещают в пробирку "Эппендорф". В пробирку добавляют 100 мкл 20% взвеси ионообразной смолы Chelex. Выдерживают в термостате при температуре 56 °С в течение 12 ч (ночь). Встряхивают 5 - 10 с на вортексе при высокой скорости. Затем помещают пробирку с волосом в кипящую воду на 8 мин. Волос должен быть полностью погружен в раствор. Опять помещают на вортекс для встряхивания в течение 5 -10 с при высокой скорости.
Гидролизат волоса центрифугируют 2 - 3 мин при 10 000 - 15 000 об/мин. Супернатант используют для постановки реакции ПЦР. В реакцию берут не более 15 мкл образца при суммарном объеме реакционной смеси ПЦР 25 мкл.
ЗАКЛЮЧЕНИЕ
При разработке методики выделения ДНК из волоса с использованием ионообменной смолы Chelex исследовали многочисленные образцы волос, различающихся по длине, цвету, срокам хранения, наличию большего или меньшего количества эпителиальных клеток луковицы, загрязнению волос биологическими примесями (кровь, сперма и др.). Преимуществом данной методики является простота ее использования. Волос выдерживают во взвеси ионообменной смолы Chelex в термостате в течение 12 ч (ночь) и затем в течение ~15 мин (8 мин кипятят) получают гидролизат волоса, содержащий очищенный раствор ДНК, готовый к амплификации. На получение положительного результата (выделенная ДНК амплифицирована) не влияют такие факторы, как длина, цвет, сроки хранения волос. Недостатком методики является необходимое наличие луковицы волоса, что сужает круг исследования волос, поступающих на экспертизу. Волосы, имеющие загрязнение биологическим материалом, требуют специальной обработки раствором глицина и параллельного контрольного исследования периферического конца стержня волоса.
Методика выделения ДНК путем хлороформ-фенольной экстракции и последующих концентрирования и фильтрации экстракта на "Центриконе-100" является более совершенной и более трудоемкой. С использованием этой методики возможно исследовать различные образцы волос, в том числе и стержень единичного волоса. Однако работа с такими низкими количествами ДНК, какие выделяют из стержня единичного волоса, требует, во-первых, высокой степени специализации эксперта и, во-вторых, особых мер предосторожности (с соблюдением чистоты и стерильности) во избежание получения ошибочных результатов. В перспективе, по мере того как концентрирование ДНК на "Центриконе-100" будет внедряться в практику, очевидно, методика получит дальнейшее развитие и совершенство.
ЛИТЕРАТУРА
1. Deoxyribonucleic acid (DNA) typing of human leukocyte antigen (HLA) - DGA1 from single hair in Japanese/ R. Uchihi, K. Tamaki, T. Kojima, etc.// J. Forens. Science. –2002.–Vol. 37. – № 3. –Р. 853-859.
2. Higuchi R., Beroldingen C., Sensabaugh G., Erlich H. DNA typing from single hair// Nature. –1998. –Vol. 332. –№ 7. –Р. 543-546.
3. PCR applications methods// The Cetus-Perkin-Elmer corporation. –2006.
Похожие работы
... сетчатки относительно слепого пятна глаза и другие признаки. Капиллярный рисунок сетчатки глаз различается даже у близнецов и может быть с большим успехом использован для идентификации личности. Всего насчитывают около 250 признаков. Такие биометрические терминалы обеспечивают высокую достоверность идентификации, сопоставимую с дактилоскопией, но требуют от проверяемого лица фиксации взгляда на ...
... животного или растения, кроме идентичных (однояйцовых) близнецов или клонированных организмов; 2) у каждой особи ДНК всех соматических клеток (клеток тела) совершенно одинакова. Для ДНК-идентификации можно использовать любой биологический материал из живого или мертвого организма, например кровь, семенную жидкость, слюну, корни волос, кожу или же листья либо семена растений. Важно только, чтобы ...
... С использованием такого рода данных судебный медик быстрее и точнее установит истинную причину смерти, информирует об этом правоохранительные органы и органов здравоохранения. 3. Исследование расчлененных трупов и трупов, находящихся в состоянии сильно выраженных посмертных изменений Обнаружение частей расчлененного трупа или трупа в состоянии выраженных разрушающих посмертных изменений, ...
... убийств. Саратов 1967. Рассейкин Д.П. Расследование преступлений против жизни. Саратов. 1965. Розенталь М.Я. Справочник следователя. М., 1975. Руководство для следователей. М., 1971 Руководство по расследованию убийств. М., 1977. Селезнев М. Взаимодействие следователей и органов дознания - Законность 1996. № 6. Селезнев М. Оценка полноты раскрытия преступления. - Законность. 1995. № 2. ...

0 комментариев