Зміст
Вступ
Розділ 1. Загальна характеристика гемоглобінової системи в крові риб та її роль в підтриманні гомеостазу організму
Розділ 2. Стан системи гемоглобіну (крові) за дії екстремальних факторів довкілля (ЛТ посучасним пестицидах, по крові риб), температури, кислотних дощів
2.1 Морфологічні, фізіологічні та біохімічні зміни в організмі гідробіонтів за дії пестицидів
2.2 Ступінь прояву токсичної дії пестицидів на риб залежно від їх концентрації
2.3 Залежність стійкості риб до токсикантів від температури середовища та пори року
2.4 Вікові та видові особливості стійкості та чутливості риб до токсикантів водного середовища
2.5 Вплив гідрохімічних показників при визначенні токсичного ефекту
Розділ 3. Токсикологічна характеристика інсектицидів
Розділ 4. Матеріали і методи досліджень
Розділ 5. Результат теоретичного аналізу даних
Висновки
Список використаних джерел
Вступ
Розвиток сільського господарства та загальне зростання антропічного впливу на водне середовище загострило проблему виживання водних тварин і, зокрема, риб, в умовах пестицидного навантаження. Забруднення внутрішніх водойм, в тому числі рибогосподарських, гербіцидами є одним з лімітуючих чинників функціонування модельних водних екосистем та їх біопродуктивності. У зв’язку з цим вивчення фізіолого-біохімічних механізмів адаптації на рівні обмінних процесів у риб, а також їх енергетичне забезпечення у відповідь на токсичний вплив пестицидів є однією з головних умов розробки ефективних засобів та способів підвищення стійкості організму риб до змінених умов існування.
Знання характеру особливостей надходження, розподілу, накопичення пестицидів в органах та тканинах, біохімічних змін в результаті отруєння може бути використане для пояснення механізмів адаптації риб до токсикантів, виявлення причин загибелі гідробіонтів у природних водоймах та обґрунтування методів контролю забруднення навколишнього середовища.
Мета і завдання дослідження. Метою роботи було структно-функціональні характеристики гемоглобінової системи коропа лускатого (Cyprinus carpio L).
а) вміст Нв та його форм;
б) активність ферменту мет-гемоглобін-редуктази;
в) спорідненість Нв до кисню;
г) швидкість лужної деструкції Нв.
Об’єкт дослідження: короп лускатий (Cyprinus carpio L).
Предмет дослідження: вплив інсектициду „Престиж” на структурно-функціональні параметри гемоглобіну крові коропа у токсичних умовах.
Для досягнення мети вирішувались наступні завдання:
теоретично дослідити морфологічні зміни гемоглобінової системи риб у відповідь на існування в умовах інсектицидного навантаження;
проаналізувати структурно-функціональні зміни в гемоглобіновій системі коропа під впливом токсичних концентрацій інсектициду „Престиж", а саме:
Методи дослідження: спектрофотометричний аналіз (СФ-26).
Розділ 1. Загальна характеристика гемоглобінової системи в крові риб та її роль в підтриманні гомеостазу організму
Головною відмінністю кровоносної системи риб від інших хребетних є наявність одного кола кровообігу і двухкамерного серця, наповненого венозною кров'ю (за винятком двоякодишних і кістеперих).
Серце складається з одного шлуночка й одного передсердя і міститься в навколосерцевій сумці, відразу за головою, за останніми зябровими дугами, тобто в порівнянні з іншими хребетними зміщено вперед. Перед передсердям є венозна пазуха, або венозний синус, зі спадаючими стінками; через цю пазуху кров надходить у передсердя, а з нього - у шлуночок [14].
Кількість крові в риб відносно менше, ніж у всієї іншої хребетної тварин (1,1 - 7,3% від маси тіла, у тому числі в коропа 2,0-4,7%, сома - до 5, щуки - 2, кети - 1,6, тоді як у ссавців - 6,8% у середньому). Це зв'язано з горизонтальним положенням тіла (немає необхідності проштовхувати кров вгору) і меншими енергетичними витратами в зв'язку з життям у водному середовищі. Вода є гіпогравітаційним середовищем, тобто сила земного притягання тут майже не позначається.
Морфологічна і біохімічна характеристика крові різна в різних видів у зв'язку із систематичним положенням, особливостями середовища існування і способу життя. Усередині одного виду ці показники коливаються в залежності від сезону року, умов змісту, віку, статі, стану особей.
Кількість еритроцитів у крові риб менше, ніж у вищих хребетних, а лейкоцитів, як правило, більше. Це зв'язано, з одного боку, зі зниженим обміном риб, а з іншого боку - з необхідністю підсилити захисні функції крові, тому що навколишнє середовище багате хвороботворними організмами.
Кількість еритроцитів у риб коливається в широких межах, насамперед у залежності від рухливості риб: у коропа - 0,84-1,89 млн. /мм3 крові, щуки - 2,08, пеламіди-4,12 млн. /мм3. Кількість лейкоцитів складає в коропа 20-80, у йорша - 178 тис. /мм3. Клітки крові риб відрізняються великою розмаїтістю, ніж у іншої групи хребетних. У більшості видів риб у крові мають і зернисті (нейтрофіли, еозинофіли) і незернисті (лімфоцити, моноцити) форми лейкоцитів. Серед лейкоцитів переважають лімфоцити, на частку яких приходиться 80-95%, моноцити складають 0,5-11%; серед зернистих форм переважають нейтрофіли-13-31%; еозинофіли зустрічаються рідко (у коропових,).
Співвідношення різних форм лейкоцитів у крові коропа залежить від віку й умов вирощування.
Загальна кількість лейкоцитів у крові риб сильно змінюється протягом року, у коропа воно підвищується влітку і знижується узимку при голодуванні в зв'язку зі зниженням інтенсивності обміну [4].
Здатність гемоглобіну крові забирати кисень з води в різних риб неоднакова. У швидкоплаваючих риб - макрелі, тріски, форелі - гемоглобіну в крові багато, і вони дуже вимогливі до вмісту кисню у воді. У багатьох морських придонних риб, а також вугра, коропа, карасів і деяких інших, навпаки, гемоглобіну в крові мало, але він може зв'язувати кисень із середовища навіть з незначною кількістю кисню.
Чутливість риб до змін температури води також пов'язана з властивостями гемоглобіну: при підвищенні температури води потреба організму в кисні збільшується, але здатність гемоглобіну зв'язувати його падає.
Пригнічує здатність гемоглобіну зв'язувати кисень і вуглекислота: для того щоб насиченість киснем крові досягла 50% при вмісті у воді 1% О2, необхідний тиск кисню в 666,6 Па, а у відсутності О2 для цього досить тиску кисню майже вдвічі меншого - 266,6 - 399,9 Па.
Кров, будучи внутрішнім середовищем організму, містить у плазмі білки, вуглеводи (глікоген, глюкоза й ін) і інші речовини, що грають велику роль в енергетичному і пластичному обміні, у створенні захисних властивостей. Рівень цих речовин у крові залежить від біологічних особливостей риб і абіотичних факторів, а рухливість складу крові дозволяє використовувати її показники для оцінки фізіологічного стану.
Кісткового мозку, що є основним органом утворення формених елементів крові у вищих хребетних, і лімфатичних залоз (вузлів) у риб немає.
Кровотворення в риб у порівнянні з вищими хребетними відрізняється рядом особливостей:
1. Утворення клітин крові відбувається в багатьох органах. Вогнищами кровотворення в риб є: зябровий апарат (ендотелій судин і ретикулярний синцитій, зосереджений у основі зябрових пелюстків), кишечник (слизувата), серце (епітеліальний шар і эндотелий судин), нирки (ретикулярний синцитій між канальцами), селезінка, судинна кров, лимфоїдний орган (скупчення кровотворної тканини - ретикулярного синцитію - під дахом черепа). На відбитках цих органів видні кров'яні клітки різних стадій розвитку [12].
2. У кісткових риб найбільше активно гемопоез відбувається в лімфоїдних органах, нирці і селезінці, причому головним органом кровотворення є нирки (передня частина). У нирках і селезінці відбувається як утворення еритроцитів, лейкоцитів, тромбоцитів, так і розпад еритроцитів.
3. Наявність у периферичній крові риб і зрілих і молодих еритроцитів є нормальним і не служить патологічним показником на відміну від крові дорослих ссавців.
4. В еритроцитах, як і в інших водних тварин, на відміну від ссавців є ядро.
Селезінка риб розташовується в передній частині порожнини тіла, між петлями кишечника, але незалежно від нього. Це щільне компактне темно-червоне утворення різної форми (кулястої, стрічкоподібної), але частіше витягнутої. Селезінка швидко змінює обсяг під впливом зовнішніх умов і стану риби. У коропа вона збільшується узимку, коли в зв'язку зі зниженим обміном речовин потік крові сповільнюється і вона скапливается в селезінці, печінці і бруньках, що служать депо крові, теж спостерігається при гострих захворюваннях. При недоліку кисню, перевезенню і сортуванню риби, облові ставків запаси крові із селезінки надходять у кров'яне русло. Зміна розмірів селезінки в зв'язку з періодами посиленої активності встановлено на струмковій і райдужній форелях і інших рибах.
Одним з найважливіших факторів внутрішнього середовища є осмотичний тиск крові, тому що від нього залежить значною мірою взаємодія крові і клітин тіла, водний обмін в організмі і т.д.
Лімфатична система риб не має залоз. Вона представлена поруч парних і непарних лімфатичних стовбурів, у які лімфа збирається з органів і по них же виводиться в кінцеві ділянки вен, зокрема в Кювьеровы протоки.
Гемоглобінова буферна система - сама могутня буферна система крові. Вона в 9 разів могутніше бікарбонатного буфера; на її частку приходиться 75% від усієї буферної ємності крові [17].
Участь гемоглобіну в регуляції рН крові пов'язана з його роллю в транспорті кисню і вуглекислого газу. Константа дисоціації кислотних груп гемоглобіну міняється в залежності від його насичення киснем. При насиченні киснем гемоглобін стає більш сильною кислотою (НнbО2). Гемоглобін, віддаючи кисень, перетворюється в дуже слабку органічну кислоту (Ннb).
Отже, гемоглобінова буферна система складається з неіонізованого гемоглобіну Ннb (слабка органічна кислота, донор протонів) і калієвої солі гемоглобіну Кнb (сполучена основа, акцептор протонів). Точно так само може бути розглянута оксигемоглобінова буферна система. Система гемоглобіну і система оксигемоглобіну є взаємоперетворюваними системами й існують як єдине ціле. Буферні властивості гемоглобіну насамперед обумовлені можливістю взаємодії реагуючих сполук з калієвою сіллю гемоглобіну з утворенням еквівалентної кількості відповідної калійної солі кислоти і вільного гемоглобіну:
Кнb + Н2СO3→ КНСО3 + Ннb.
Саме в такий спосіб перетворення калійної солі гемоглобіну еритроцитів у вільний Ннb з утворенням еквівалентної кількості бікарбонату забезпечує підтримка рН крові в межах фізіологічно припустимих величин, незважаючи на надходження у венозну кров величезної кількості вуглекислого газу й інших киснуло реагуючих продуктів обміну.
Гемоглобін (Ннb), потрапляючи в капіляри легень, перетворюється в окси-гемоглобин (НнbО2), що приводить до деякого підкислення крові, витисненню частини Н2О з бікарбонатів і зниженню лужного резерву крові. Перераховані буферні системи крові відіграють важливу роль у регуляції кислотно-основної рівноваги. Як відзначалося, у цьому процесі, крім буферних систем крові, активну участь приймають також система дихання і сечо-статева система.
В умовах зимового голодування в організмі риб розвивається температурний та ресурсодефіцитний стрес. Відповіддю на нього є збільшення протягом зимівлі в 1,5 рази вмісту еритроцитів та величини гематокриту. Загальний вміст гемоглобіну знижуєтся в 2 рази, що корелює з даними про пряму залежність вмісту гемоглобіну в коропа від температури води. Це пояснюється зниженням в 4 рази активності мітохондріальної δ-АЛС, яка лімітує швидкість біосинтезу гема. Загалом, дані зміни погіршують в період зимівлі забезпечення тканин киснем.
В кінці березня на початку квітня поряд з зниженням в 4 рази вмісту оксиформи гемоглобіну рівень дезоксиформи відносно лютого в 3 рази зростає. Вміст метгемоглобіну при цьому збільшується в 2 рази, що співвідноситься з різким зниженням спорідненості гемоглобіну до кисню. З даними змінами корелює швидкість дисоціації оксигемоглобіну. Максимальна швидкість дисоціації виявлена в жовтні, коли спорідненість є мінімальною, а мінімальна - в червні, коли спорідненість є максимальною. Сезонна динаміка дисоціації оксигемоглобіну підтверджує підвищення спорідненості гемоглобіну до кисню в період зимівлі [6].
Існує взаємозв’язок між підвищенням спорідненості гемоглобіну до кисню, зниженням рівня метформи та зростанням вмісту його оксиформи. Значне зниження вмісту окси - та підвищення кількості метформи гемоглобіну, а також зміщення кривої дисоцації оксигемоглобіну вправо в кінці зимівлі свідчить про розбалансування системи транспорту кисню в цей період.
Оскільки біохімічна адаптація здійснюється як шляхом модифікації макромолекул, так і на рівні регуляторних факторів клітини, вченими досліджено регуляцію функціональної активності гемоглобіну за допомогою АТФ, який є основним модулятором спорідненості гемоглобіну риб до кисню. Протягом зимівлі рівень останнього знижувався в 2 рази, що співставляється с відміченим нами фактом збільшення спорідненості гемоглобіну коропа до кисню. Це узгоджується з зниженням в риб за низьких температур обміну речовин, рухливості, зменшенням споживання ними кисню та активацією гліколізу.
Перебудови енергетичного метаболізму відображаються на функціонуванні системи транспорту кисню шляхом впливу на структурно-функціональний стан гемоглобіну. Однією з суттєвих характеристик останнього є кінетика його лужної денатурації [7].
Найстійкішим гемоглобін є в червні (період активного живлення). Найзначнішою його денатурація є в жовтні та лютому, що є показником низької захищеності молекул від денатуруючих агентів.
В формуванні вищих рівнів структури білків важливу роль відіграють амідні групи. Протягом зимівлі амідованість гемоглобіну підвищується в 2 рази. Амідованість білків плазми крові знижується в середині зимівлі, але зростає з лютого по квітень. Відомо, що з другої половини зимівлі як ендогенне джерело живлення в риб використовуються саме білки, в зв’язку з чим амідування гемоглобіну та білків плазми протягом зимівлі можна вважати засобом їх адаптивного захисту від протеолізу. Додатковим механізмом такого захисту є глікування. Нами виявлено, що в середині зимівлі глікування гемоглобіну знижується, а в березні зростає майже в 3 рази. Білки плазми в часовій динаміці глікуються навпаки. Ввважаємо, що ступінь глікування може бути фактором, який з одного боку за несприятливих умов стабілізує білкові молекули, а з іншого - регулює інтенсивність вуглеводного обміну шляхом вилучення моносахаридів з окиснювального пулу. Збільшення ступеня амідування білків супроводжується зниженням відсотка їх глікування і навпаки. Ймовірно, що за рахунок цього максимально ефективно здійснюється стабілізація гемоглобіну. Одночасно з цим певну роль в захисті гемоглобіну під час зимівлі риб відіграють і сульфгідрильні групи. Проте їх роль, порівняно з описаними механізмами, нижча, оскільки вміст -SH груп протягом зимівлі змінюється мало. Незначну роль в даному процесі відіграє також і метгемоглобінредуктаза еритроцитів, активність якої зимою знижується в 2 рази, що корелює з зростанням вмісту метгемоглобіну.
Компенсаторно-адаптивними реакціями на токсичну дію можна вважати збільшення числа еритроцитів, активацію еритропоетичної активності тканин, зростання активності метгемоглобінвідновлюючої НАДH-залежної метгемоглобінредуктази, одного з основних ферментів блокування окислення гемового заліза [9].
Збільшення спорідненості гемоглобіну до кисню може бути фактором підтримання функціонально необхідного рівня вільного кисню (дія іонів свинцю окремо та спільно з аміаком, іонів цинку, закислення і залуження води, вплив фенолу) та засобом запобігання неконтрольованих перекисних процесів.
Розділ 2. Стан системи гемоглобіну (крові) за дії екстремальних факторів довкілля (ЛТ посучасним пестицидах, по крові риб), температури, кислотних дощів
2.1 Морфологічні, фізіологічні та біохімічні зміни в організмі гідробіонтів за дії пестицидів
Комплексна взаємодія природних явищ, хімічних процесів та людських дій призводить до появи достатньо високих концентрацій пестицидів у поверхневих водах, що викликає занепокоєння через шкідливу дію на водні організми, міграцію у харчових ланцюгах, небезпеку для здоров’я людини. Тому в наш час важливу роль відіграє вивчення біохімічних та фізіологічних показників життєдіяльності гідробіонтів, і зокрема риб, у відповідь на отруєння. Знання характеру змін в органах і тканинах в результаті отруєння може бути використане для пояснення механізмів адаптації риб до токсикантів, виявлення причин загибелі гідробіонтів у природних водоймах та обґрунтування методів контролю забруднення навколишнього середовища [5].
Як відомо, існує матеріальна кумуляція (накопичення в організмі токсичної речовини) та функціональна (викликані токсикантом ефекти). Здатність пестицидів до матеріальної кумуляції описано нами у попередньому розділі. Функціональна ж кумуляція здатна спричиняти морфологічні, фізіологічні та біохімічні зміни в органах і тканинах, проявляючись навіть при дії препаратів, що швидко руйнуються та виводяться з організму. Як відомо, функціональна кумуляція в органічному світі зустрічається частіше, оскільки після кожного попадання отрути в організм зберігаються наслідки попередньої реакції, які, накладаючись на наступну, призводить до появи токсичного ефекту.
До організму риб пестициди потрапляють переважно через зябра, шкіру та можуть захоплюватись з їжею. Токсиканти пестицидної групи мають різний механізм дії. Він залежить від хімічної будови цих речовин і тому єдиної думки по даному питанню не існує. Але особливо шкідливими виявились хлорорганічні сполуки, що обумовлено їх значною стійкістю як у навколишньому середовищі так і всередині організмів тварин, а також різноманітним ефектом дії (токсичний, мутагенний, канцерогенний). Значно більш токсичні, ніж хлорорганічні, фосфорорганічні пестициди. Не настільки токсичні, але дуже шкідливі похідні симм-триазина, сечовини та карбонових кислот.
В результаті досліджень впливу пестициду карбофурану на морфо-функціональний стан яєчників ляліуса (Colisa lalia L) отримані дані, що свідчать про переродження тканини яєчників, появу специфічних атлетичних ооцитів діаметром 80-180 мкм і зменшення кількості зрілих ооцитів, відмічено також порушення структури жовточних гранул. Дослідники спостерігали як гіпертрофовані, так і зморщені ооцити невеликого розміру з дезінтегрованими яйценосними пластинками.
Вивчення токсичного впливу фосфорорганічного пестициду діазинону дозоволило авторам роботи зробити висновок про значні морфологічні та фізіологічні зміни у Melanotaenia duboulayi, що виражались у гіпертрофії та гіперплазії зябер, закупорці кровоносних судин, потовщенні епітелію зябрових пелюсток, посиленні секреції слизу.
При хронічному отруєнні похідними дихлорфеноксиоцтової кислоти у риб спостерігається виснаження організму, атрофія скелетної мускулатури. Перикардіальна порожнина заповнена кров’ю, що майже не зсілася, відмічається жовтушність печінки. При гістологічному дослідженні найбільші зміни відмічені в печінці (застійна гіперемія міжтрабекулярних капілярів, зерниста дистрофія печінкових клітин, в окремих випадках в певних ділянках паренхіми каріо - та плазмопікноз і розпад поодиноких клітин) та міокарді (м’язеві волокна потончені, розрихлені з погано вираженою смугастістю). Субтоксичні концентрації 2,4-ДА при гострому отруєнні викликають у риб зміни в периферійному кровотоці, зниження кількості еритроцитів (на 8,9-18,2%), лейкоцитів (на 22-27%) і в окремих випадках гемоглобіну (до 14%), порушення газообміну (споживання кисню збільшується на 26%) [8].
Широко вивчаються також анатомо-фізіологічні зміни в організмі риб, що живуть в умовах пестицидного забруднення. Зокрема, фосфорорганічний пестицид діазинон викликає у Меlahotaenia duboulayi потовщення епітелію зябрових пелюсток, гіпертрофію та гіперплазію зябер, посилену секрецію слизу та закупорку кровоносних судин. У прісноводного ляліуса (Colisa lalia) токсикація карбофураном викликала атрезію яєчників. В залежності від концентрації пестициду у риб спостерігали ооцити без зародкових пухирців, гіпертрофовані, зморщені ооцити, дезинтеграцію яйценосних пластинок. Відмічено зміни у гістоструктурі центральної нервової системи молоді білуги в результаті хронічного отруєння яланом. При дії інсектицидів на риб та крабів у тварин спостерігали видозміни у будові нервових клітин. Вважається, що найбільш уразливими до дії забруднюючих речовин, зокрема пестицидів, є органи чуття риб, рецепторні елементи яких безпосередньо відкриті у навколишнє середовище: нюх, смак, бічна лінія, що призводить до змін у поведінці риби в умовах токсикозу. Поведінкові реакції можна використовувати як перші ознаки порушення нормальної життєдіяльності отруєних риб.
Відомі також данні про мутагенний та тератогенний вплив пестицидів на ембріональний розвиток осетрових риб, при якому найчастіше спостерігається порушення органогенезу, як правило, ці зміни несумісні з життям. Під час застосування деяких хлорорганічних пестицидів спостерігається також їх ембріотоксична дія на організм риб.
При вивченні біологічної дії пестициду SAN 527 I 240 EW (діюча речовина - тауфлувалінат) виявлено, що при концентрації у воді 48 г/га він пригнічує здатність коропа до виживання.
Для оцінки фізіологічного стану риб під впливом найрізноманітніших чинників середовища останнім часом широко використовують різні групи біохімічних показників, оскільки, застосовуючи біохімічні методи, і, зокрема, методи ензимоіндикації, можна визначити ступінь інтоксикації на самих ранніх стадіях токсичної дії, задовго до загибелі. Вплив пестицидного забруднення водного середовища на активність певних ферментів організму риб досить широко описано у фаховій літературі, крім того, важливим показником токсичності умов навколишнього середовища є кількісний склад певних метаболітів (загального білку, глюкози, лактату, пірувату тощо) в тканинах [4].
Досліджуючи токсичний вплив гептахлору на активність ферментів в організмі мозамбікської тіляпії (Tilapia mossambica L), автори роботи виявили вірогідне збільшення активності кислої фосфатази в зябрах риб та почерговому збільшенню і зменшенню активності ферменту в печінці.
При дослідженні індивідуальної та синергічної дії сублетальних доз пестициду монокротофосу та добрива хлориду амонію на склад протеїнів, глікогену, вільного цукру, кислої, лужної фосфомоноестераз та неспецифічних естераз в м’язах та печінці мозамбікської тіляпії відмічено значне зниження рівня всіх вище перелічених речовин уже після 96 годин експозиції. При цьому, суміш добрива і пестициду виявилась більш токсичною, ніж кожна речовина окремо.
Виявлено також, що фосфорорганічні пестициди діазінон та малатіон пригнічують холінестеразну активність у личинок райдужної форелі, причому ці зміни корелюють зі змінами рухової активності [7].
При вивченні дії сублетальних концентрацій рогора на деякі біохімічні показники кларієвого сома (Claridae), спостерігалось зменшення кількості м’язового глікогену з одночасним збільшенням вмісту лактату. Активність ЛДГ протягом перших 48 годин експозиції різко зростала, а потім (96-192 години експозиції) пригнічувалась Відмічено також зростання активності глікогенфосфорилази у м’язах у відповідь на дію токсиканта.
Під дією пестициду фенитротіону, що широко використовується в сільському господарстві, в концентрації 0,02 та 0,04 мг/л в організмі європейського вугра (Anguilla anguilla L) зменшується рівень протеїну, жирів, глікогену, спостерігається пригнічення енергетичного обміну. Більшість метаболічних порушень не приходить до норми протягом тижня. Автори пов’язують вплив фенитротіону з посиленим синтезом ліпопротеїнів, які відіграють захисну роль, та інтенсивним катаболізмом глікогену в умовах інтоксикації.
Дослідження інших вчених показали, що при витримуванні білого амура (Ctenopharingodon idella Val) у воді з сублетальними концентраціями аметрину (гербіцид), бейлусцину (молюскоцид) та сечовини у плазмі крові риб спостерігається збільшення концентрації глюкози та незакономірні зміни лактату, в м’язах та печінці вірогіднене зменшення рівня глікогену, крім того зростає активність глюкозо-6-фосфатази в печінці [6].
У 1995 році з метою одержання результатів, які б найбільш адекватно відображали вплив антропогенного забруднення на стан молоді осетрових риб (Acipenseridae), були проведені модельні експерименти по вивченню впливу суміші хлорорганічних пестицидів та солей важких металів (ВМ) при передачі їх по трофічним ланцюгам. Як з’ясувалось, рання молодь осетра досить стійка (резистентна) до дії ХОП та ВМ, хоча деякі патологічні зміни все ж таки спостерігались. Така протидія хлорорганічним пестицидам та солям важких металів, на думку дослідників, зумовлена, очевидно, високою інтенсивністю виведення вказаних токсикантів із організму риб. Однак виникнення патологічних змін, з точки зору вчених, не дозволяє вважати осетра достатньо повноцінною та процвітаючою популяцією.
Крім того, високотоксичні пестициди (корбель, фронтьєр, харнес) у сублетальній концентрації викликають у передличинок осетра відхилення в ліпідному обміні. Цікавим виявилось те, що личинки з високим вмістом жиру виявились більш токсикорезистентними.
Як об’єкт для вивчення біохімічних показників під впливом різного роду токсикантів досить широко використовується мешканець наших внутрішніх водойм - короп лускатий (Сyprinus carpio L). При дослідженні холінестерази (фермент, який американські дослідники пропонують використовувати як біомаркер забруднення сільськогосподарських водойм інсектицидами) мозку коропа при дії на його організм фосфорорганічних та карбаматних інсектицидів виявлено майже повне пригнічення активності цього ферменту.
Поряд з цим, порівнявши токсичну дію 13 інсектицидних препаратів на біохімічні показники коропа, відмічено збільшення естеразної та пероксидазної активності на початковій стадії інтоксикації з наступним інгібуванням цих ферментів. При інтоксикації гормоноподібними інсектицидами спостерігається збільшення вмісту малонового діальдегіду в тканинах мозку коропа, що на думку дослідників свідчить про активацію перекисного окислення ліпідів в мозковій тканині.
Відомо, що деякі пестициди можуть викликати зміни у складі крові риб. Зокрема ендосульфан спричиняє зменшення величини споріднення гемоглобіну до кисню, що в свою чергу призводить до зменшення рН крові у зв’язку зі збільшенням в ній концентрації вуглекислоти. Тими ж дослідниками визначено, що отруєння коропа різними пестицидами викликає зміни в концентрації сироваткових білків та їх окремих фракцій, однак направленість цих змін та їх вираженість визначається природою токсиканта та його концентрацією [24].
Дослідження, проведені геологічним товариством США в 1994 році в 13 штатах та окрузі Колумбія, довели чітку кореляцію (зворотно-пропорційну залежність) між рівнем естрогену і тестостерону у риб та концентрацією водорозчинних пестицидів у водоймах. Крім того, пестициди порушують позагенну дію прогестеронів на мейотичне дозрівання ооцитів риб шляхом зв’язування з рецепторами прогестеронів в їх плазматичних мембранах.
Заслуговують на увагу дані, що до впливу на гідробіонтів похідних арилоксиалканкарбонових кислот, а саме групи 2,4-дихлорфеноксиоцтової кислоти (2,4-Д) та триазинів.
Однією з важливих груп гербіцидів для боротьби з бур’янами в посівах злакових культур є арилоксиалканкарбонові кислоти та їх різноманітні похідні. Широкому застосуванню цих речовин сприяє їх помірно-гостра токсичність для теплокровних тварин, риб, планктону та інших об’єктів навколишнього середовища. Однак останнім часом з’явились дані про патологічні зміни, що викликають 2.4-Д та її похідні в організмі риб та інших тварин. Тому вивчення біохімічних змін, що виникають в організмі риб під впливом даних препаратів, дуже важливе.
Так, при дослідженні нирок линів (Tinca tinca L), які знаходились в воді з 2,4-Д, було встановлено, що остання викликає дегенерацію та некроз в усіх відділах системи канальців.
При одночасній дії 2,4-Д та піклорама у сомика (Ictalurus punctatus L) спостерігається посилення активності печінкової етоксирезоруфін-О-деетілази, зменшення концентрації хлоридів у сироватці крові та гепато-соматичного індексу, хоча ці зміни не відмічені у риб при окремій дії кожного з токсикантів.
Відомо також, що 2,4-Д-Na негативно впливає на окиснювальне фосфорилювання (зниження рівня окислювальних процесів і роз’єднання окиснювального фосфорилювання), знижує аденозинтрифосфатазну активність мітохондрій печінки коропа, зменшує виживання ікри та темпи раннього ембріонального розвитку риб, викликає кількісні зміни ліпідних фракцій у скелетній та серцевій мускулатурі коропа. Вивчались також кількісні зміни ліпідних фракцій печінки та плазми крові коропа під впливом натрієвої солі 2,4-Д та патоморфологічні зміни (частковий некроз та переродження у сполучну тканину) в окремих органах коропа (серце, печінка та інш) при гострому та підгострому отруєнні амонійною сіллю 2,4-Д. Відомо, що за дії 2,4-Д-амонійної солі відбуваються зміни в периферичній крові, а також спостерігаються дистрофічно-некробіотичні зміни та розлади кровообігу в печінці та міокарді.
Мутагенна дія похідних 2,4-Д виражена слабо, однак у дослідах на тваринах встановлено ембріотоксичну дію 2,4-Д бутилового ефіру в дозах, що не викликали загальнотоксичної дії [11].
У зв’язку з можливістю надходження пестицидів у рибоводні водойми вивчено токсичність багатьох з них для різних видів риб. Відмічено, що, як і інші токсиканти, похідні 2,4-Д мають різну токсичність та здатність до накопичення для риб різних видів.
Встановлено, що токсичність арилоксиалканкарбонових кислот для риб залежить не лише від виду риби, але й від її віку, температури води та інших факторів. Зокрема, токсичність солей з амінами та ефірів вища, ніж лужних солей препаратів. Особливо висока токсичність емульсій ефірів, що, можливо, пов’язано з наявністю емульгатора, присутність якого, як правило, посилює токсичність погано розчинних у воді органічних речовин. Підвищення токсичності солей з амінами може бути пов’язане з високою токсичністю для риб самих амінів та з високою здатність до проникнення таких солей в організм риби. Зокрема в районі застосування 2,4-Д кислоти в концентрації до 0,2 мг/л відмічена можливість накопичення великих кількостей преперату в трісці (Gadus morhua L) - до 1500 мг/кг тканини, та в рибі-місяці (Mola mola L) - до 500 мг/кг. Лабораторні дослідження Щербакова Ю.А. та Полубояринової І.В. свідчать про гідроліз 2,4-Д бутилового ефіру до 2,4-Д кислоти протягом 9-10 діб. По даним вчених при вмісті в воді 5 мг/л 2,4-Д ефіру на третій день в рибах накопичується 164,3 мг/кг 2,4-Д ефіру і 61,6 мг/кг 2,4-Д кислоти. При наявності у воді ефіру на рівні ГДК в рибах на третій день виявлено 32,4 мг/кг ефіру і 0,66 мг/кг кислоти. Крім того планктон, донні відкладення та водні рослини також здатні накопичувати та тривалий час утримувати препарати групи 2,4-Д.
Що до такого пестициду як зенкор (4-аміно-6-третбутил-3- (метилтіо) - 1,2,4-триазин-5 (4Н) - он) - одного з представників триазинів, то його дію на організми гідробіонтів і, зокрема, риб, вивчено порівняно мало. Є відомості про зміни в складі крові та порушення обміну нуклеїнових кислот у зв’язку зі здатністю заміщувати піримідинові основи [5].
Триазини, загалом, досить токсичні для тварин, що мешкають у водному середовищі. Протягом довгого часу похідні триазинів займають перше місце по об’ємам виробництва та застосування в світовому землеробстві. Потрапляючи у водойми, вони викликають багаточисельні негативні наслідки для гідробіонтів в результаті безпосередньої токсичної дії або в результаті глибокого порушення ланцюгів живлення.
В літературних джерелах описано дослідження негативного впливу симазина разом з хімічними добривами та атразину і діурону на риб і водні екосистеми.
2.2 Ступінь прояву токсичної дії пестицидів на риб залежно від їх концентраціїЯк відомо, результати дослідів з визначення токсичності певних речовин для риб визначаються двома найважливішими змінними: концентрацією токсиканту та часом його дії. За умови незмінного часу проведення експерименту, концентрація хімічної речовини відіграє провідну роль у визначенні ступеня прояву токсичної дії та при оцінюванні самого факту шкідливості досліджуваної сполуки для риб. Питання про концентрацію хімічної речовини, при якій вона стає токсичною чи летальною, залишається одним з найактуальніших в токсикології.
При дослідженні змін вуглеводного обміну у білого амура при витримуванні у воді з сублетальною та летальною концентраціями молюскоциду бейлусцину виявлено, що зміни активності ферменту глюконеогенезу - глюкозо-6-фосфатази залежать від кількості токсиканта у воді: при сублетальній концентрації активність ферменту спочатку швидко знижується, а згодом, по мірі адаптації до токсичних умов, збільшується. При дії летальної концентрації даного пестициду спостерігається різке збільшення активності ферменту [26].
Результати досліджень негативного впливу пестициду карбофурана у сублетальній (0,7 мг/л) та середній летальній (1,7 мг/л) дозах на морфо-функціональний стан яєчників ляліуса свідчать про те, що в яєчниках першої групи риб виявлено більший, ніж у риб контрольної групи, вміст ооцитів діаметром 80-180 мкм і менше зрілих ооцитів, відмічено також порушення структури жовточних гранул. У яєчниках риб, яких витримували при концентрації токсиканту 1,7 мг/л, спостерігали як гіпертрофовані, так і зморщені ооцити невеликого розміру з дезінтегрованими яйценосними пластинками.
Вивчення токсичного впливу фосфорорганічного пестициду діазинону у п’яти різних концентраціях дозволило авторам роботи зробити висновок про кореляцію вираженості морфологічних та фізіологічних змін у Melanotaenia duboulayi (гіпертрофія та гіперплазія зябер, закупорка кровоносних судин, потовщення епітелію зябрових пелюсток, посилена секреція слизу) від концентрації токсиканту.
При дослідженні токсико-кінетичних показників фенітротину в організмі європейського вугра, порівнюючи фактори біонакопичення для дослідних риб, які утримувались у розчинах пестициду в концентрації 0,02 та 0,04 мг/л вченими доведено, що швидкість поглинання токсиканту та його кількісний вміст в тканинах риб залежить від концентрації пестициду в розчині. Найвищий фактор біоконцентрації визначено для вугрів, експонованих у 0,04мг/л розчині токсиканту. Крім того, незалежно від концентрації фенітротіону у воді його накопичення в печінці сягало стабільного рівня (0,09-0,10 мкг/г ткани) через 48 годин при вмісті 0,02 мг/л та через 72 години при 0,04 мг/л. Однак при більш високій з досліджуваних концентрацій через деякий час спостерігалось швидке підвищення цього показника (до 0,45 мкг/г тканини). Після переносу риб у чисту воду вони швидко елімінують накопичений пестицид: рівні екскреції були відповідно 0,06 та 0,04 год-1 для вказаних концентрацій речовини. Тими ж дослідниками було проведено ряд експериментів для визначення впливу розчинів фенітротіону у вищезазначених концентраціях на рівень енергетичних сполук (глікогену, протеїну, жиру) в тканинах вугра. Незалежно від концентрації відмічено зниження рівня всіх досліджуваних сполук та зроблено висновок про те, що метаболічні порушення, викликані дією пестициду, не нормалізуються в період відновлення протягом тижня.
Дослідники з Фінляндії перевіряли дію препарату РСВ-77 в дозах 1-100 мкг/л на ембріони райдужної форелі. Накопичення пестициду в ікрі виявлено на третій день експерименту, рівень токсиканту при вихідних дозах в 1 і 10 мкг/л становить 185 та 1221 нг/г відповідно. При дозуванні РСВ-77 100 мкг/л інтенсивність нагромадження пестициду у тканинах виявилась меншою, ніж при нижчих концентраціях, однак на 7 день вона різко зросла. Таку динаміку накопичення РСВ-77 автори пояснюють збільшенням швидкості його метаболізма за участю монооксигеназної системи Р-450-залежної та глутатіон-S-трансфераз.
Крім того, в літературі зустрічаються відомості про зміни локомоторної та соціальної поведінки золотої рибки (Carassius auratus L) у відповідь на дію гербіцидів атразина та діурона в різних концентраціях: 0,1; 1,0; та 10 мг/л.
Російські вчені довели залежність між збільшенням концентрації токсичної речовини і зменшенням часу існування осетрових риб на всіх стадіях розвитку від зиготи до личинки у розчинах пестицидів.
Російськими вченими на прикладі коропових риб досліджено реакції імунної системи на короткочасну та хронічну дію фосфорорганічного пестициду карбофосу, а також вплив забруднення важкими металами та іншими пестицидами на імунну систему різних видів риб.
Дослідженнями останніх років доведено, що препарати 2,4-Д здатні впливати на синаптичні ефекти завдяки зміні ліпідних структур збуджуваної мембрани клітини. При внесенні препаратів 2,4-Д у розчин, що омиває внутрішню поверхню препарату ізольованого нерва жаби (яка, як і риби, належить до пойкілотермних тварин і більшу частину життя проводить у водному середовищі) з сумісно інервованим шматочком шкіри призводить до зміни різниці потенціалів на рівні нейроепітеліальних синапсів. Причому великого значення для визначення величини змін набуває концентрація гербіциду у промивній рідині. Так, при концентрації 0,1 та 1 ммоль різниця потенціалів зазнає змін відповідно на 47,2 та 68,9%.
2.3 Залежність стійкості риб до токсикантів від температури середовища та пори рокуОскільки риби відносяться до пойкілотермних тварин, то вплив температури зовнішнього середовища на ріст, розвиток, інтенсивність інших фізіологічних процесів дуже великий. Крім того, доведено, що різні абіотичні чинники пов’язані як між собою так і з біотичними чинниками. Зокрема, від температури залежить розвиток рослинних і тваринних організмів, якими живиться риба, насиченість води киснем та інш. Тому при вивченні взаємовідносин між концентрацією токсичної речовини і впливом її на організм риб не можна не враховувати температурний чинник, що визначає не лише інтенсивність обмінних процесів, а й рівень чутливості та стійкості риб до токсикантів [39].
Адаптації організму риб до змін температури вивчено досить повно. Є багато літературних джерел, в яких описано комплекс біохімічних, фізіологічних, морфологічних, поведінкових адаптацій, що зменшують екстремальну дію цього фактора середовища. Біохімічні зміни в організмі риб, викликані коливаннями температури, мають велике значення, оскільки у своїх дослідженнях ми вивчали комплексну дію токсикантів і температурного режиму на організм риб.
Пошуки зв’язку термостійкості організму зі складом ферментів - актуальне питання сьогодення.
Досить широко вивчається залежність енергетичного обміну у водних ектотермних тварин від температури. Взагалі вивченню функціонального стану гліколізу та ЦТК в тканинах риб під дією змін температури води присвячено багато робіт, оскільки інформація про стан цих процесів необхідна для розуміння механізмів енергозабезпечення адаптації їх до екологічних факторів, в тому числі й до температури. Зокрема, досліджуючи активність окремих ферментів цих циклів, можна судити про стан протікання відповідних реакцій гліколізу та ЦТК. Для більш повного вивчення температурної залежності регуляції та протікання вищезгаданих процесів, було вивчено зміни концентрації самих метаболітів, таких як піруват, лактат, оксалоацетат, ά-кетоглутарат та малат. Виявлено, що при збільшенні температури водного середовища від 10 до 30˚С в організмі коропа спостерігається перебудова шляхів генерування енергії за рахунок посилення інтенсивності гліколізу і гальмування реакцій ЦТК.
Оскільки температурна аклімація риб суттєво відображається на компонентах обміну аденілових нуклеотидів, що мають безпосереднє відношення до забезпечення організму енергією, відомі також дослідження обміну аденілових нуклеотидів у риб при їх температурній акламації [39].
Багаточисельні дослідження свідчать про зміни в активності аеробного та анаеробного метаболізму при холодовій акклімації. При вивченні механізма температурної компенсації на клітинному рівні було встановлено, що при низьких температурах відбувається збільшення маси мітохондрій (їх відносного об’єму в клітинах чи тканинах). Так, наприклад, у коропа, акклімованого до 2ºС, мітохондрії займають 25% об’єму червоних м’язових волокон, а при акклімації до 28ºС - лише 14%.
Деякі автори вважають, що холодова акклімація пов’язана зі зміною характеру експресії генів у риб, що мешкають у холодних водоймах. Причому експресія індукується у коропа лускатого при зниженні температури води з 25 до 6˚С, а у даніо-реріо до 12˚С. Активацію експресії виявлено через 2 години після дії холоду з піком через 12 годин.
Як зазначалось вище, температура води відіграє вирішальну роль у визначенні стійкості риб до токсикантів при незмінних концентрації та часу їхньої дії, оскільки сезонні та добові коливання температури, а також перепад температур, викликаний викидами стічних вод, можуть суттєво змінити їх стійкість до токсикантів шляхом зміни інтенсивності обміну. Крім того, дані, накопичені фізіологами та екологами риб про залежність рівня обміну риб від температури, викладені на початку даного розділу, дозволяють зробити припущення про важливу роль температурного фактора у визначенні швидкості та рівня накопичення токсикантів та величини порогової концентрації речовини у водоймі [41].
При дослідженні залежності швидкості розвитку токсичного процесу та часу загибелі піддослідних риб при збільшенні температури на 10º С отримані переконливі дані про зниження стійкості риб до органічної речовини - токсафену у 3 рази.
Вченими виявлено зв’язок між стійкістю риб до отрут органічного ряду та температурою. В роботах перевірявся токсичний вплив фенолу, суміші фенолу та крезолу, а також мета крезолу в температурному режимі від 10º С до 25º С. Результати дослідів свідчать про зменшення тривалості життя піддослідних риб у розчинах токсикантів при підвищенні температури. Крім того, зміни часу існування риб у токсичному середовищі до загибелі неоднакові при підвищенні температури на 10º С в області високих (15-25º С) та низьких (5-15º С) температур: при вищій температурі прискорення загибелі піддослідних риб виражене значно більше. При збільшенні температури середовища сумісно з токсикозом відмічено також змінення таких показників токсикорезистентності, як латентний період інтоксикації, швидкість та процент загибелі тварин.
Виникає питання про вплив попередньої адаптації риб до температури середовища на рівень їх стійкості до отрут. Всупереч очікуванням Лук’яненка В.І. зі співробітниками, час загибелі адаптованих до високої температури риб значно зменшився порівняно з часом загибелі неадаптованих, що кардинально не узгоджується з пропозицією Вінберга Г.Г. стосовно того, що адаптація риб до низьких температур пов’язана з підвищеним рівнем обміну, а до високих - зі зменшенням його інтенсивності.
Деякі автори намагаються дати оцінку впливу токсичних речовин на здатність риб розрізняти різну інтенсивність прояву абіотичних факторів, зокрема температури. При дослідженні дії органічних токсикантів на температурний преферендум струмкової форелі (Salmo trutta morpha fario L), виявлено, що високі концентрації досліджуваних речовин призводили до вірогідного зниження рівня температури, якій риби надавали перевагу, порівняно з контролем. Тобто можна зробити висновки про поведінкові зміни риб у вищезгаданих умовах.
Цікаві дані щодо безпеки використання пестициду базограну для рибоводства надані Махно П. М.: виявляється, що максимально можливі концентрації токсиканту проявляються для коропа різного віку при різних температурах: для малька - при 17-19º С, а для цьогорічки - при 12º С.
Матеріали Першого Конгресу іхтіологів Росії містять дані про тісний зв’язок між температурою води і часом загибелі риб при токсикозі пестицидами (базогран-М та інш): з підвищенням температури збільшується швидкість загибелі осетрових риб.
На думку В.І. Лук’яненка існує необхідність внесення суттєвих коректив в уявлення про роль температурного чинника у визначенні ступеня стійкості риб до токсикозу. Крім того, сезонні особливості метаболізму, його циклічність має неабиякий вплив на токсикорезистентність риб. Ефект зміни температури токсичного розчину проявляється через існуючий у даний момент рівень та направленість метаболізму, що склалися в процесі еволюційного розвитку [41].
Сезонні зміни обміну речовин - питання, що здавна і до сьогоднішнього дня цікавить дослідників. Доведено, що в період зимівлі змінюється хімічний склад м’язів та інших органів риб, ліпідний склад печінки, взагалі відбуваються зміни у ліпідному, вуглеводному та білковому обмінах. Дослідження активності ферментів вуглеводного обміну морських видів риб показали, що у більшості випадків активність ферментів (зокрема ЛДГ та СДГ) зростає в інтервалі природної для Чорного моря температури (5-25˚С), сягаючи максимуму при 25˚С, температурна залежність активності знаходиться у відповідності з термічною екологією виду риб та залежить від періоду річного циклу.
Виходячи із загальнофізіологічних уявлень, можна зробити висновок про неабиякий вплив сезонного фактора на токсикорзистентність риб. Однак, у літературі нами знайдено дуже мало відомостей про нього. Зокрема, Лук’яненко зі співробітниками, досліджуючи токсикорезистентність карасів (Carassius carassius L) у розчинах фенолу різної концентрації дійшли висновку, що різниця у стійкості риб у різні пори року визначається сезонними особливостями у метаболізмі карася і проявляються у деякому зниженні стійкості риб до найбільш високих концентрацій токсикантів у лютому та значному зменшенні часу існування риб при будь-яких концентраціях фенолу у червні. Зазначені відмінності пояснюються, напевно, тим, що взимку у карася рівень обміну речовин значно знижується порівняно з іншими порами року.
2.4 Вікові та видові особливості стійкості та чутливості риб до токсикантів водного середовищаДослідження ролі вікового чинника у визначенні стійкості риб до отрут важливе для розуміння шляхів впливу токсикантів у природній водоймі на популяцію виду в цілому та на окремі стадії життєвого циклу, а також для вірного розв’язання проблеми біологічного нормування гранично допустимих та мінімальних летальних концентрацій отрут. Надзвичайно велике значення має вивчення вікових особливостей відповіді на отруєння для оцінювання рівня токсикорезистентності даного виду риб, яке автор пропонує проводити в період її максимального зниження та з урахуванням саме цього “вузького" місця у життєвому циклі виду.
Рядом авторів відмічено, що у різних видів риб стійкість до отрут органічної природи, як правило, знижується в процесі онтогенетичного розвитку. Причому мінімум стійкості спостерігається у статевозрілих особин.
Зниження стійкості риб до отрут органічної природи по мірі дозрівання різних функціональних систем, діяльність яких визначає рівень реактивності організму пояснюються авторами діяльністю центральної нервової системи та її синаптичних структур, оскільки токсична дія отрут органічного походження проявляється шляхом порушення її діяльності. Певне значення при цьому може мати і гіпоталамо-гіпофізарно-адреналова система, що відіграє важливу роль у підтриманні гомеостазу. На ранніх етапах онтогенезу постійність внутрішнього середовища та механізми, що її регулюють, не мають належного розвитку, внаслідок чого організм здатний переносити значні відхилення від оптимального рівня [34].
Строганов Н.С. та Пажитков А.Т. висловлюють протилежну точку зору, стверджуючи, що найбільш вразливими стадіями онтогенезу риб є стадії личинки і малька. Подібні відхилення в оцінці стійкості окремих етапів онтогенезу пояснюються, напевне, різною хімічною природою отрут, і, як результат, різним механізмом їхньої дії на організм.
Досліджуючи дію хлорорганічних пестицидів на чахонь (Pelecus cultratus L) в період раннього онтогенезу вчені відмічають вповільнення темпів ембріогенезу, загальмованість ядерних перетворень на стадії гаструли, а також зупинку розвитку в ранній профазі.
При вивченні дії пестициду базограну на коропа різного віку автором виявлено, що найбільш чутливими до токсичного ефекту являються мальки риб. Цьогорічка проявляє вже значно більшу стійкість до забруднення. Так, якщо для малька СК50 становить 460,2 мг/дм3, то для цьогорічки цей показник збільшується у 2,4 рази і сягає 1100 мг/дм3.
Зі збільшенням маси тіла риб в процесі росту та розвитку польськими вченими доведено збільшення вмісту хлорорганічних пестицидів у м’язах.
Дослідження, проведені по визначенню впливу засобів захисту рослин (в т. ч. пестицидів) на ікру та личинки осетрових риб, показали, що найменш стійкими до токсикозу виявились ранні етапи ембріогенезу (від початку дробіння до формування ембріона, особливо стадія гаструляції), найбільш стійка стадія - пульсуючого серця. Далі відмічається невпинне зменшення токсикорезистентності від стадії передличинки до стадії личинки.
Визначення рівня токсичності речовин виявиться неповним без врахування видових особливостей чутливості та стійкості до них риб, вивчення яких має важливе значення для розуміння адаптаційних можливостей різних видів риб, а також для направлених змін складу рибогосподарської водойми у відповідності до можливості потрапляння у них токсикантів [34].
Так, при вивченні порівняльної токсичності 2,3,7,8-тетрахлордибензо-р-диоксину (ТХДД) для семи прісноводних видів риб в ході раннього розвитку, запліднену ікру пімефалеса, канального сома, сига, медаки, чукучана, звичайної щуки та даніо інкубували у воді з різними концентраціями ТХДД. Результати експерименту свідчать про найбільшу з досліджуваних видів чутливість до токсикозу у сига (175 нг/г ікри), найменшу - у даніо (2610 нг/г). Як бачимо, безпечні концентрації у представників різних видів відрізняються майже у 15 разів. Крім того, найбільш чутливим із раніше перевірених видів вчені називають озерного гольця-кристивомера.
При дослідженні токсичності пестицидів (БХС, ДДТ, диельдрину та альдрину) для мішкозябрового сома, коропа і молочної риби виявлено, що мінімальну сприйнятливість до більшості із застосованих речовин проявляє мішкозябровий сом, а максимальну - короп.
На токсикантів гідробіонти реагують по-різному, в залежності від систематичного положення, філогенетичного рівня, віку, статі, функціонального стану, біомаси, чисельності популяції, спадкової схильності, вмісту кисню у воді та багатьох інших факторів. Реакція (відгук) гідробіонтів на вплив токсичних агентів - інтоксикація, або токсичний ефект, тканинному, організм енному та надорганізменному рівнях.
Під токсичним ефектом розуміють патологічні зміни у функціонуванні організму під впливом токсикантів.
Важливе вирішальне значення в процесі інтоксикації гідробіонтів має концентрація токсикантів. Великі концентрації викликають гостру токсичність, яка призводить до загибелі гідробіонтів, у короткий проміжок часу: години, хвилини і навіть секунди. Загибелі тварин, як правило, передують судороги (корчі), гальмування або короткочасне прискорення пересування у воді, зміна положення тіла (у риб - пересування “на боці", положенням черевом догори), асфіксія, “хапання” повітря, вискакування з води. Іноді у тварин змінюється забарвлення тіла [34].
Найнебезпечнішим в екологічному відношенні наслідком накопичення токсикантів у трофічних ланцюгах є підрив плодючості як безхребетних, так і риб, оскільки це веде до поступової деградації гідрофауни, падіння видового різноманіття та зменшення біологічної продуктивності водойм.
2.5 Вплив гідрохімічних показників при визначенні токсичного ефектуЯк показують дослідження суттєве значення для організму риб мають хімічні властивості води, зокрема газовий режим, водневий показник, окисленість, наявністі біогенних речовин, твердість води тощо.
Вивчаючи зміни в організмі риб при адаптації їх до певних гідрохімічних умов автори відмічають, що від насиченості води киснем, величини рН, концентрації вільної вуглекислоти в першу чергу залежить не тільки їх нормальна життєдіяльність але й стійкість до токсикантів. На думку автора, зниження токсикорезистентності риб при дефіциті кисню не залежить від природи отруйної речовини і повністю визначається особливостями дихальної активності організму. Зменшення концентрації кисню у воді викликає складний комплекс порушень діяльності багатьох функціональних систем, деякі з яких мають вирішальне значення у визначенні швидкості проникнення і накопичення токсичних речовин в організмі.
При вивченні сумісної дії змін рН та токсикозу органічними речовинами з’ясувалось, що реакція середовища має два шляхи впливу на організм гідробіонтів: зміни токсичності діючої речовини за рахунок хімічних перетворень, обумовлених кислотністю середовища та змінення інтенсивності обміну і споживання кисню досліджуваними тваринами [12].
При аналізі літературних даних стосовно твердості води прослідковується два можливих шляхи впливу кальцію на стійкість риб до токсикантів: один з них полягає у зміні розчинності токсичної речовини, що призводить до утворення осадів та зниження шкідливості розчинів; другий шлях заключається в тому, що іони кальцію виступають у якості фізіологічних антагоністів (зокрема для важких металів), знижують проникність клітин і зменшують проникнення отрут всередину організму.
Водневий показник (рН) є одним з важливих факторів середовища. Найбільше сприятливо для більшості риб значення рН, близьке до нейтрального. При значних змінах в сторону кислого або лужного середовища зростає кисневий поріг, послаблюється інтенсивність дихання. Можливі границі рН, у яких можуть жити прісноводні риби, при інших рівних умовах залежать від видової приналежності. Найбільш витривалий карась і короп, щука переносить коливання рН у межах 4,8...8,0; струмкова форель - 4,5...9,5; короп 4,3...10,8.
Сольовий склад відіграє важливу роль у житті гідробіонтів. При цьому має значення як сумарна кількість розчинених у воді мінеральних солей, або солоність, так і іонний склад води. По загальній кількості розчинених речовин природні води умовно підрозділяють на 3 групи: прісні, солонуваті і солоні. У групу прісних входять води, що містять до 1 г/л, солонуваті - 1. .15 г/л і в групу солоних входять води із вмістом 15...40 г/л мінеральних розчинених речовин [9].
Чим більше солей розчинено у воді, тим вищий в ній осмотичний тиск, до якого чутливі гідробіонти. Маючи визначений сольовий склад, організми повинні підтримувати його сталість. Для цього в них існують різні механізми, що не тільки підтримують деяку різницю концентрації солей у середовищі і тілі, але і забезпечують стабільність концентрації в організмі окремих іонів і їх співвідношення. У мінеральному живленні риб істотну роль може відіграти захоплення різних іонів клітинами поверхні тіла, наприклад з'єднання сірки, фосфору й інших мінеральних елементів.
Особливе значення для живлення фітопланктону і вищої водної рослинності мають біогенні елементи - азот, фосфор, кремній, залізо й ін. На тваринні організми істотно впливає вміст у воді мікроелементів - кобальту, нікелю, марганцю, міді, цинку, стронцію й ін. Недостатня кількість або їх надлишок приводить до патології в розвитку, отруєнням і нерідко загибелі. Джерелом надходження мікроелементів у рибу є вода, рослинність, природний і штучний корми.
Органічна речовина присутня у воді в розчиненому і зваженому стані. Їх поділяють на автохтонні й алохтонні. Запаси автохтонних речовин поповнюються за рахунок фотосинтезу фітопланктону, макрофітів і хемосинтезу деяких бактерій, алохтонних - за рахунок виносу їх з водозбірної площі, надходження з атмосферними, а також іноді з побутовими і промисловими стоками. Частка розчиненої органічної речовини приблизно в сотні разів більша, ніж органічної речовини в живих організмах і детриті.
Такі легкозасвоювані органічні речовини, як цукри, амінокислоти, вітаміни й інші, мають важливе значення в житті гідробіонтів і в першу чергу в їхньому живленні. До зважених органічних речовин відноситься детрит, що складається з мінеральних і органічних часток, що поєднуються в складні комплекси. Детритом харчуються багато коловерток, ракоподібні, молюски, голкошкірі і багато риб [6].
Від біогенних елементів (фосфатів, солей азотної кислоти, мікроелементів), що забезпечують розвиток фітопланктону, залежить продуктивність водойми. Кількість кисню і вуглекислоти, величина рН, склад і біохімічний стан органічної речовини, а також компоненти сольового складу - наслідок життєдіяльності організмів, тобто результат інтенсивності біопродукційних процесів.
Значний вплив на хімічний склад води створюють кліматичні і гідрологічні фактори, до яких відносяться температура і світло. Ці фактори тісно пов'язані між собою і діють одночасно, викликаючи періодичні зміни в життєдіяльності гідробіонтів. У свою чергу, інтенсивність біопродукційних процесів, викликана цими факторами, позначається на зміні гідрохімічних показників. Змінюючи температуру води, можна активізувати або сповільнювати біохімічні процеси як в організмах, так і у водоймі. На її зміни реагують насамперед, фітопланктон і бактерії. Особливо великі ці зміна в сезонному аспекті.
В життєдіяльності організмів важливе значення має вуглець, азот і фосфор. Саме їх сполуки необхідні для утворення кисню й органічної речовини. Значну роль у круговороті біогенних елементів виконують донні відкладення. Вони є в одноу випадку джерелом, в іншому - акумулятором органічних і мінеральних ресурсів водойми. Надходження їх із донних відкладень залежить від рН, а також від концентрації цих елементів у воді. При підвищенні рН і низкій концентрації біогенних елементів збільшується надходження у воду фосфору, заліза й інших елементів з донних відкладень.
Основними показниками при оцінці інтенсивності біопродуктивних процесів є абсолютний і відносний вміст кисню. Дослідження вмісту кисню, у водоймі використовуються для розрахунків величини первинної продукції і деструкції органічної речовини, що утвориться в основному кормі для всіх гетеротрофних організмів. Не менш важливі дані можна одержати і при аналізі змін рН, вільної вуглекислоти, біогенних елементів, перманганатної і біхроматної окислюваностей, біохімічного споживання кисню (БПК). При цьому особливо важливо знати співвідношення між гідрохімічними показниками, наприклад, між киснем і вуглекислотою, між БПК і окислюваністю, між величиною добової деструкції і та ін. Для характеристики біопродукційних процесів істотне значення мають дані про амплітуду добових і сезонних змін кисню й окислюваності, про вміст біогенних елементів.
У природних водах, там, де процеси ґрунтоутворення і розпаду (мінералізації) органічної речовини збалансовані, величина насичення води киснем, з урахуванням її температури, близька до 100%. Однак у багатьох випадках, насамперед у продуктивних водоймах, фотосинтетичні і біохімічні процеси змінюють цю закономірність [6].
Водойми мають визначену рибопродуктивність, що залежить від сукупності умов, зокрема від кормових ресурсів. У рибництві під природною рибопродуктивністю водойми розуміють сумарний приріст маси риби, отриманий протягом одного вегетаційного періоду з одиниці площі за рахунок природної кормової бази. Виражається ця рибопродуктивність у кілограмах або тоннах на 1 га площі водойми. Величина цього показника не є постійною і змінюється в залежності від якості води і ґрунту, кліматичних і метеорологічних умов, виду вирощуваної риби, її віку, щільності посадки риби. Найбільш високу природну рибопродуктивність мають ставки, розташовані на родючих ґрунтах, що постачаються водою джерелом з родючим водозбором і знаходяться в районах із тривалим вегетаційним періодом. У рибництві за основу приймають середню рибопродуктивність за кілька років.
З кліматичних і метеорологічних умов, що впливають на формування природної кормової бази, на розвиток і ріст риб, найважливішим є температурний режим. Відповідно до кількості днів у році з температурою повітря вище 15 °С територія країни розділена на 7 рибоводних зон. При визначенні природної рибопродуктивності потрібно враховувати не тільки рибоводну зону, але і ґрунту, на яких знаходиться водойма, для цього існує поправочний коефіцієнт. Для середніх за родючістю ґрунтів (підзолисті суглинкові, супіщані, вилужені чорноземи й ін) він дорівнює 1, для малопродуктивних ґрунтів він складає: галові - 0,4, торф'янисті - 0,5, піщані - 0,6, високородючі ґрунти (чорноземи й ін) - 1,2.
Рибопродуктивність, одержувана за рахунок природної їжі, залежить від стану кормової бази ставків і ступеня її використання рибою. Утворення у водоймі природної їжі проходить складним біологічним шляхом. Матеріальну й енергетичну основу всіх наступних етапів продукційного процесу у водоймі складає новотворення органічних речовин з мінеральних у результаті життєдіяльності рослинних організмів.
У результаті росту і розвитку рослинних організмів у водоймах відбувається безперервне новотворення їх біомаси. Рівень первинної продукції, обумовлений фізіологічними властивостями водоростей і факторами середовища, є основним регулятором інтенсивності й ефективності усього біопродуктивного процесу. Біологічне продукування відбувається у формі утворення первинної і вторинної продукції, під якими розуміють відповідно приріст біомаси автотрофів (рослинних організмів) і гетеротрофів (тваринних організмів) [6].
Процес автотрофного живлення гідробіонтів, тобто утворення ними органічної речовини з мінеральних речовин, є єдиним, при якому у водоймі виникає "першоїжа". За рахунок її живуть усі гетеротрофні гідробіонти як рослинноїдні, так і м'ясоїдні. Так, молодь більшості видів риб на ранніх стадіях розвитку споживає водорості, а для деяких видів вища і нижча водна рослинність - важливе джерело живлення протягом усього життя.
Таким чином, усі живі організми водойм утягуються в процеси круговороту речовин, який включає наступні ланки: синтез органічної речовини у водоймі і надходження органічної речовини у водойму з водозбірної площі; розкладання органічних речовин у водоймі (мінералізація); споживання і перетворення розкладених речовин бактеріальними, рослинними і тваринами організмами; споживання живих організмів, що синтезують органічну речовину з неорганічної.
Утворення органічної речовини у водоймах відбувається в процесі фотосинтезу зеленими організмами планктону (водоростями і зеленими бактеріями) і бентосу (нижчими і вищими рослинами), а також у процесі хемосинтезу бактеріями.
Зелені рослини, що беруть участь у процесі фотосинтезу (діатомові, зелені, синьозелені й інші водорості), вимагають для свого розвитку визначених умов - наявності біогенів і мікроелементів, а також певної температури. Так, діатомові водорості розвиваються звичайно при температурі 16...18 °С. Синьозелені водорості з'являються при більш високій температурі, при наявності фосфору до 0,02 мг/л і азоту до 0,08 мг/л води. Зелені водорості вимагають великої кількості азоту.
У водойму також надходять органічні речовини. Їхня кількість залежить від характеру водозбірної площі, клімату, ґрунту, рослинного покриву, характеру господарської діяльності людини. Органічні речовини, що надійшли з донних відкладень і з водозбірної площі, а також організми, що розмножилися при фотосинтетичній діяльності і згодом відмирають (фітопланктон, макрофіти, фітобентос), розкладаються і перетворюються при участі бактерій і найпростіших. При цьому мікроорганізми не просто руйнують органічну речовину, а перетворюють її, переводячи у більш доступний стан для живлення тварин. Одночасно протікають і процеси деструкції, у результаті яких у воду надходять біогени, необхідні для розвитку водоростей. При слабкій утилізації органічна речовина осідає на дно водойми, поглинає велику кількість кисню, погіршує кисневий режим. В міру нагромадження у водоймах невикористаної органічної речовини відбувається старіння екосистем. Воно відбувається повільніше, якщо основними продуцентами органічної речовини є планктонні водорості. Однак і при інтенсивному розвитку фітопланктону, але слабкому його споживанні рослинноїдними безхребетними, значна частина первинної продукції також залишається недовикористаною і відкладається на дні водойми. Таким чином, оцінка продуктивності водойми, проведена тільки по величині первинної продукції, може привести до помилок, оскільки значна частина органічної речовини випадає з продукційних процесів і може негативно впливати на їх протікання [9].
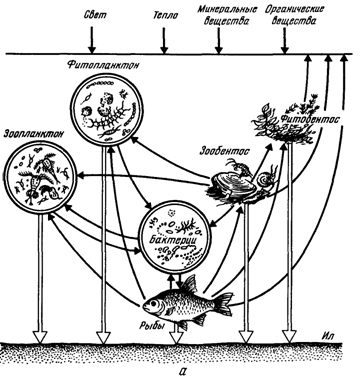
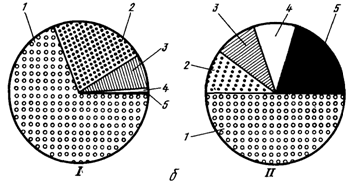
Рис 1. Процес круговороту речовин у водоймі (а) і частка риб у загальній біологічній продукції і біомасі природних водойм (б): І - співвідношення різних видів біологічної продукції, ІІ - співвідношення біомаси, 1 - фітопланктон, 2 - бактерії, 3 - зоопланктон, 4 - донні організми, 5 – риба.
Велике значення у водоймі мають бактерії, гриби і мікрозоопланктон (інфузорії, безбарвні жгутикові та ін). Річна продукція бактерій може досягати десятків і сотень грамів сирої маси на 1 м2. Величезну роль відіграють у вторинному продукуванні організми мікрозоопланктону і мікрозообентосу, зокрема найпростіші. У водоймах інфузорії в масі розвиваються слідом за наростанням біомаси бактерій, що починається після відмирання фітопланктону. Маючи величезну чисельність і високу інтенсивність продукування, інфузорії створюють біомасу, часто близьку до тієї, котру утворюють у водоймах всі інші тварини. Подальший хід круговороту речовин йде за участю тварин, що харчуються водоростями, сапрофітними бактеріями, грибами і тваринами інших видів [6].
Розділ 3. Токсикологічна характеристика інсектицидів
У зв’язку з необхідністю всебічної оцінки симптомів отруєння риб різного роду органічними речовинами, що використовуються у сільському господарстві, виникла потреба вивчення впливу їх на фізіологічний стан та обмін речовин цих гідробіонтів у токсичних умовах.
Як відомо, протягом багатьох років у сільському господарстві використовується велика група органічних речовин для боротьби з шкідниками сільськогосподарських культур, бур’янами тощо. Згодом ці речовини потрапляють у водойми, викликають отруєння риб, що, в свою чергу, зменшує рибопродуктивність водойм та може спричиняти захворювання людини при споживанні рибопродуктів. Тому, вивчення особливостей обміну речовин у риб в токсичних умовах необхідне, перш за все, для всебічної оцінки симптомів отруєння риб.
Інсектициди - хімічні препарати для захисту рослин від шкідливих комах. Певні комахи суттєво знижують, а в деяких випадках можуть повністю знищити врожай сільськогосподарських культур. Живлячись вегетативними чи генеративними органах рослин, крім прямого зменшення врожаю і його якості, шкідливі комахи і кліщі є джерелами розповсюдження вірусних і грибкових захворювань рослин.
Інсектициди використовують для захисту рослин від таких шкідливих комах. Контролюючи шкідників інсектициди допомагають попередити втрати врожаю і покращити його якість. Основні культури, де використовують інсектициди - зернові, плодові, овочеві культури і картопля [31].
Серед органічних речовин, що викликають явно виражений токсикоз у риб, виділяють інсектициди, гербіциди та пестициди, широке використання яких у сільському господарстві та інших областях, на думку дослідників, поставило перед токсикологами риб нові завдання: вивчення біохімічних показників життєдіяльності риб у відповідь на отруєння, характеру особливостей надходження, розподілу, накопичення пестицидів в органах та тканинах, біохімічних змін в результаті отруєння, що може бути використане для пояснення механізмів адаптації риб до токсикантів, виявлення причин загибелі гідробіонтів у природних водоймах та обґрунтування методів контролю забруднення навколишнього середовища.
Нерегламентоване застосування великого арсеналу засобів хімізації, більшість з яких є чужорідними для природи продуктами, викликає багато несприятливих наслідків: захоплені з сільськогосподарських земель пестициди з водою, грунтом та повітрям являють потенційну небезпеку для навколишнього середовища та здоров’я людини.
Комплексна взаємодія як природних явищ, так і хімічних процесів, а також людських дій призводить до появи достатньо високих концентрацій пестицидів у поверхневих та підземних водах, що викликає небезпеку для людини та шкідливу дію на водні організми. Тому в наш час важливу роль відіграє вивчення тих біохімічних показників життєдіяльності гідробіонтів, і зокрема риб, які виникають у відповідь на отруєння.
Дослідженню шляхів та джерел потрапляння пестицидів до природних і штучних водойм, а також шляхів їх міграції присвячено багато робіт як вітчизняних, так і закордонних дослідників. Зокрема встановлено, що значна частина пестицидів може потрапляти у водойми з поверхневим стоком, із стічними водами промислових підприємств, які виробляють пестициди, а також із стоком, що утворюється у сільському та лісовому господарстві після миття тари, устаткування, транспорту тощо, з колекторно-дренажними та зрошувальними водами, в які додавали гербіциди, а також з атмосферними опадами при великій площі водойм, особливо під час пилових бур. Для знищення шкідливих комах, смітної риби тощо пестициди іноді спеціально вносять у воду [31].
Крім того, велику увагу при розрахунках можливих кількостей пестицидів, що потрапляють на так звані „нецільові” об’єкти, треба звертати на спосіб внесення хімічної речовини у грунт, або обробки рослин. Зокрема, при застосуванні пестицидів шляхом обприскування речовина осідає на поверхні рослин і грунту на території, що обробляли, поза зоною обробки і розноситься вітром на значну відстань від місця внесення. Так, Попович Н.А. в своїй роботі наголошує на тому, що внесення гербіциду 2,4-Д натрієвої солі при посівах пшениці за допомогою дощувальної установки супроводжується втратою 15-20% препарату.
В роботах радянсько-американського симпозіуму, присвячених поведінці пестицидів та хімікатів в навколишньому середовищі, Бейкер Дж.Л. висловлює думку, що співвідношення факторів міграції пестицидів залежить від того в якому вигляді використовується препарат (гранули, водні розчини та інш), методу обробки, кількості внесення пестициду на одиницю площі, кліматичних особливостей, сільськогосподарської культури, що обробляється.
Крім того, встановлено, що з грунту пестициди можуть виноситись не лише поверхневим, колекторним стоком і дренажними водами, а ще і ґрунтовими водами, що спричиняє забруднення водойм та підземних вод.
Також не останнє місце посідає забруднення води і грунту в результаті негерметичності поховань непридатних до використання пестицидів.
Найбільша кількість препаратів представлено фосфорорганічними сполуками, на другому місці знаходяться похідні карбамінової кислоти (14%), на третьому -- галогенорганічні сполуки (11%) [31].
За токсичністю для теплокровних тварин препарати фосфорорганічної групи варіюють від першого до четвертого класу небезпеки, але майже всі вони характеризуються низькою стійкістю в об’єктах навколишнього середовища. Більшість препаратів розкладається в рослинах, ґрунті і воді до нетоксичних метаболітів на протязі періоду, що не перевищує один місяць. Вони не накопичуються в організмі тварин, хоча можуть викликати незворотні патологічні зміни у внутрішніх органах. При дотриманні регламентів застосування не утворюють токсичних залишків в продуктах врожаю. Серед фосфорорганічних інсектицидів є препарати всередині рослинної дії, що захищають культуру від заселення шкідниками довгий час (хлорофос, метафос, карбофос, метатіон, фозалон, фосфамін та ін. некондиційні препарати).
Інсектициди на основі похідних карбамінової кислоти володіють різною персистентністю і токсичністю для теплокровних тварин. Однак вони більш стійкіші, ніж фосфорорганічні сполуки, довгий час зберігаються в рослинах і ґрунті і потенційно небезпечні як забруднювачі продуктів врожаю.
Хлорорганічні інсектициди в міру своєї стабільності здатні до довгострокової циркуляції у біосфері і можуть являти собою загрозу для наземних і водних екосистем. Використання найбільш шкідливих препаратів (дилдрин, ендрин, гептахлор, ДДТ та ін) заборонено [7].
Усі інсектициди в тій чи іншій мірі є небезпечними для екосистем ксенобіотиками [10]. Застосування їх приводить до загибелі величезної кількості тварин як у районах, що обробляються, так і в сусідніх. Як правило, це трапляється при розсіюванні інсектицидів над лісами, завдяки чому гине значна кількість орнітофацин -- до 87%. Розсіювання з літаків і вертольотів на великих територіях подібні до масового знищення тварин, що проживають у цих лісах [15].
Інсектициди знищують до 80% комах-запилювачів, через що їхня кількість значно зменшилась, що негативно позначається на врожайності вирощуваних культур. Ентомофауна ґрунтів і боліт оброблених районів значно постраждала за часів СРСР -- загальна чисельність популяцій тварин зменшилась на 40%, тобто пестициди пригнічують біологічну активність ґрунтів, внаслідок чого знижується їх природна родючість [8].
Обробки інсектицидами проти шкідників викликають побічну дію на фауну безхребетних живих агроекосистем, в тому числі на ґрунтову біоту, що має важливе значення в ґрунтоутворюючому процесі [7]. Всі хлорорганічні, більшість фосфорорганічних інсектицидів в більшій мірі знижують чисельність жужелиць, стафілінід, а базудін також і комах. Надходження усіх інсектицидів у річки, ставки шкідливо як для водних безхребетних, так і для риб. При авіаобробці лісу такими інсектицидами як ДДТ, севін, метафос, карбофос, коли неможливо було попередити забруднення водойм, відмічалась загибель личинок бабок, двокрилих та інших комах, раків. Для риб особливо шкідливі хлорорганічні пестициди [1].
При застосуванні багатьох інсектицидів відмічена загибель павуків, однак причиною є непряма дія, а вторинне отруєння при споживанні токсикованих комах. Високостійкі до усіх груп інсектицидів дощові черв’яки і загибель їх спостерігається при внесенні в ґрунт великих доз. Крім загибелі внаслідок отруєння, хижаки залишають поле через недостачу їжі, спричиненої знищенням рослиноїдних видів, паразити гинуть через відсутність чи низьку чисельність хазяїв [10].
Дія інсектицидів на ентомофауну при зрошуванні рослин (пшениця, люцерна) варіює в залежності від застосованих препаратів [15]. Так, хлорофос більш шкідливий для ентомофагів, ніж метафос і поліхлоркарфен, які практично не впливали на їх чисельність. Відразу після обробки спостерігалось значне зниження чисельності як шкідливих, так і корисних комах, однак через деякий час число хижаків знову зростало, в цілому за період період вегетації різниця в заселенні ними оброблених і необроблених полів була незначною.
Розділ 4. Матеріали і методи досліджень
Об'єктом дослідження було обрано дворічок коропа (Cyprinus carpio L) вагою 350^400 г. Досліди проводилися у модельних умовах в ваннах об'ємом 200 літрів і кількістю досліджуваних особин - 8. Період акліматизації складав 4 дні. Риби витримувались в умовах досліду протягом двох тижнів та чотирьох тижнів, що є достатнім для формування можливої адекватної відповіді організму [Хлебович В.В. Акклимация водньїх животньїх. - Л.: Наука, 1981. - 135 с.]. Температура води коливалася в межах 14-15 °С, вміст розчиненого кисню знаходився в межах фізіологічної норми (5-7 мг/л). Воду в ваннах змінювали кожні 2 доби.
У експерименті риби знаходились у двох варіантах: контроль та за дії препарату "Престиж" (у воду додавали суспензію препарату).
В усіх експериментах кров для досліджень відбирали з синуса зябрової вени з використанням в якості антикоагулянту гепарину з розрахунку 20 од/мл крові.
Гомогенати всіх тканин готували на основі 0,025М Трис-НСl-буфера з рН 7,4, що містив 0,175 моль/л КС1 у співвідношенні 7: 18 (біологічний матеріал: буферний розчин).
Визначення МДА як кінцевого продукту ПОЛ проводили за його реакцією з тіобарбітуровою кислотою за методом [Стальная И.Д., Гаришвили Т.Г. Метод определения малонового диальдегида с помощью ТБК // Современньїе методьі-в биохимии / Под ред.В.Н. Ореховича. - М.: Медицина, 1977.]. При високій температурі в кислому середовищі малоновий диальдегід реагує з 2-тіобарбітуровою кислотою, утворюючи забарвлений триметиновий комплекс, з максимумом поглинання при 532 нм. Молярний коефіцієнт екстинкції цього комплексу - ε = 1,56 105 см-1 М-1.
Активність каталази визначали спектрофотометрично за інтенсивністю абсорбції водорозчинних комплексів "перекис водню-молібденова рідина" при 410 нм [Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.И. Метод определения активности каталазьі. // Лаб. дело, 1988, №1. С.16-18.].
Активність глутатіон-трансферази визначали спектрофотометрично за ступенем відновлення динітрохлорбензолу (зменшенню концентрації 1-хлор-2,4-динітробензолу) при ^=340 нм. Інкубаційна суміш для визначення ГТ містила 0, ЗмМ GSH та 0, ЗмМ 2,4 динітрохлорбензолу (ДНХБ) на 3 мл 0,1М К-фосфатного буфера рН 7,2, реакцію запускали внесенням 50 мкл біологічного матеріалу; про активність ферменту судили за зменшенням ДНХБ, вимірювану при 340 нм.
Активність глутатіонпероксидази визначали також спектрофотометрично. Інкубаційна суміш для визначення містила 0,7мМ ЕДТА, ІЗОмкМ NADPH, 0,7мМ GSH та 10-100 мкл біологічного матеріалу на З мл 0,1М К-фосфатного буфера з рН 7,2; реакцію починали, додаючи Н2Ог в кінцевій концентрації 0,2М; активність ферменту визначали за зменшенням NADPH, зареєстрованому при 340 нм.
Вміст загального білку розраховували за методом O. H. Lowry et al [Lowry O. H., Rosebroug N.І., Farr A. L., Randall R.I. Protein measurement with the Folin phenol reagent // J. Biol. Chem. - 1951. - 193, N 1. - P.265-275.].
Математичну обробку отриманих даних проводили методами варіаційної статистики з використанням t-критерію Стьюденту [Лакин Г.В. Биометрия. - М.: Вьісшая школа, 1990. - 351 с].
Престиж - це інсекто-фунгіцидний протруйник системної і контактної дії. Відноситься до групи протруйників. Активними інгредієнтами є імідаклоприд (140 г/л) та пенцикурон (150 г/л). Препаративна форма: концентрат суспензії. Реєстраційне посвідчення: А № 00679. Вирішує проблему боротьби проти дротяників та листової картопляної попелиці у період від посадки до початку відмирання бадилля, а також проти колорадського жука в період від появи сходів до початку цвітіння. Фунгіцидна дія препарату спрямована на захист від ризоктоніозу сходів і врожаю при гарному додатковому ефекті проти парші і мокрих гнилей.
Застосування розбавленого водою препарату покращує рівномірність покриття бульб картоплі. Обробку проводити перед висаджуванням картоплі в грунт. Посадковий матеріал має бути не старіший одного року (з урожаю минулого року).
Престиж слід використовувати безпосередньо після розбавлення водою, а робочий розчин не рекомендується залишати на довгий період без збовтування.
Механізм дії:
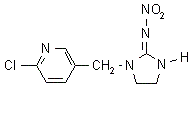
Імідаклоприд блокує передачу нервового імпульсу на рівні рецептора постсинаптичної мембрани:
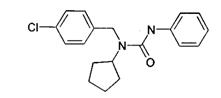
Пенцикурон проникає в кутикулу рослини та інгібує проростання міцелію, впливає на функціональний стан клітини та ядра, гальмує біосинтез стерину та вільних жирних кислот всередині гриба, значно зменшує вміст
Розділ 5. Результат теоретичного аналізу даних
Рівень накопичення токсикантів у тканинах риби та його вікові особливості має надзвичайно важливе значення в умовах інтенсифікації рибництва. Дослідження вчених показують, що здатність до кумуляції в тканинах риб для різних гербіцидів залежить від класу пестицидів, хімічної речовини, якою його представлено (2,4-Д кислота, амонійна сіль чи бутиловий естер), тканини та віку риб. Так, кумуляцію зенкору (представник триазинів) не виявлено у жодній тканині риб жодного віку, на відміну від гербіцидів-представників групи феноксиоцтової кислоти. Порівнюючи здатність до кумуляції в тканинах риб різних форм гербіциду за дії однакових концентрацій токсиканту, можна стверджувати, що найбільший коефіцієнт накопичення має 2,4-Д бутиловий естер. Якщо прийняти за 1 кількість накопиченої кислоти в мозку, то співвідношення 2,4-Д кислота: 2,4-Д амонійна сіль: 2,4-Д бутиловий естер будуть становити 1: 1,6: 32,8 для мальків, 1: 1,35: 10,2 для цьогорічок та 1: 1: 10,03 для дворічок. Крім того, результати досліду з визначення вмісту пестицидів в ікрі та личинках коропа, що перебували у воді з вмістом токсикантів 0,2 мг/дм3, показали, що в ікрі виявляється лише бутиловий естер; 2,4-Д кислота та її амонійна сіль не потрапили у середину ікринок. У личинок виявлено лише сліди цих пестицидів. Щодо 2,4-Д бутилового естеру, то його накопичилась за цей період значна кількість - 0,56 мг/кг маси тіла. Враховуючи концентрацію вказаного токсиканта у воді, в якій перебувала риба (0,2 мг/дм3), можна стверджувати про кумуляцію токсиканта. Наступне потрапляння пестициду у водойму призведе до накопичення додаткової кількості токсиканта на фоні вже наявного та до прояву токсичної дії в результаті синергізму (Врочинський, Маковський, 1979).
Аналізуючи результати дослідів з нагромадження пестицидів в тканинах (мозок, печінка, білі м’язи, кишечник, зябра) коропа різного віку (мальки, цьогорічки, дворічки) можна зробити висновок, що суттєвих відмінностей у рівні накопичення 2,4-Д кислоти у риб різного віку в одних і тих же тканинах не спостерігається: мінімальною кількістю накопиченого токсиканту характеризуються м’язова тканина, кишечник і зябра риб, але у всіх вікових групах цей токсикант в значних кількостях виявляється в печінці (0,55±0,12; 0,40±0,02 та 0,40±0,03 мг/кг тканини у мальків, цьогорічок та дворічок відповідно) та в мозку (0,50±0,08; 0,60±0,16 та 0,61±0,11 мг/кг тканини) [16].
В процесі індивідуального розвитку та під впливом токсикантів змінюються морфологічні та поведінкові показники риби. Кожен період життєвого циклу організму характеризується власною системою зв’язків з навколишнім середовищем та своїми основними пристосуваннями до умов життя. Результати дослідження кількісних морфологічних показників екстер’єру риб (коефіцієнт вгодованості, зоологічна та стандартна довжина риби, найбільша висота тіла риби тощо) свідчать, що вони вирогідно не змінюються при перебуванні протягом чотирнадцяти днів в умовах гербіцидного токсикозу (2 ГДК). Однак, у ряді випадків спостерігалась тенденція до кількісного зменшення більшості з досліджуваних показників.
Поведінкові реакції отруєних риб можна використовувати як початкові ознаки порушень нормальної життєдіяльності. Дія зенкору, як і більшості розчинів отрут органічного походження (Лук’яненко, 1983), супроводжується бурхливою руховою активністю піддослідних риб, особливо це стосується цьогорічок. В той же час коропи, що перебували під впливом 2,4-ДА, проявляли більшу рухову активність лише в перші години інтоксикації, однак у них спостерігали перехід у поверхневий шар води і такий специфічний симптом, як заковтування повітря, а також підвищену чутливість до звукових подразників.
Проводячи єксперименти, в риб беруть кров шляхом пункції серця на 1-у, 4-у, 7-у і 14-у добу експерименту. Початкову пробу крові без першої краплі використовують для визначення її згортання [10]. Іншу кров стабілізують шляхом додавання гепарину - 0,01% (у 1 мг препарату 130 ЕД) [12]. Для оцінки морфофункційного стану організму визначають наступні показники крові: кількість еритроцитів (підрахунок здійснюють в камері Горяева), швидкість осідання еритроцитів (ШОЕ), концентрацію гемоглобіну (за Салі) з використанням гемометра [32].
Виходячи з отриманих даних, розраховують вміст гемоглобіну в одному еритроциті (ВГЕ), кольоровий показник крові.
Вченими встановлено неоднозначність можливих шляхів формування відповідних реакцій організму протягом 14 доби на дію з гербіцидів, про що свідчить різна динаміка гематологічних показників двухлеток коропа (мал.1).
Вміст гемоглобіну, г/л
тривалість навантаження, діб
Рис.1. Динаміка вмісту гемоглобіну в крові дворічок коропа в умовах гербицидной навантаження
Після першої доби перебування коропів у токсичних умовах найбільша мобілізація фізіологічних ресурсів організму виявляється під дією зенкора, що виражається в максимальному збільшенні вмісту гемоглобіну (мал.1). Менш виражена термінова адаптація під дією раундапа, оскільки вміст гемоглобіну зменшується в 1,6 рази. Інші показники в порівнянні з контролем змінюються незначно. Під дією похідних 2,4-Д величини показників крові майже не змінюються.
Після закінчення чотирьох діб експерименту кількість гемоглобіну змінюється неоднозначно в залежності від природи гербіциду. Під дією зенкора їх кількість зменшується майже в два рази і стає менше ніж у контролі; під дією раундапа, навпаки, - незначно відрізняється від контролю. Що стосується дії 2,4-Д, достовірні розходження в показниках не спостерігаються.
Висновки
Експериментально досліджено структурно-функціональні зміни гемоглобіну коропа препарату „Престиж” показано:
В крові досліджуваних риб відбувається суттєвий перерозподіл форм гемоглобіну, при цьому зменшується вміст оксигемоглобіну, тотексигемоглобіну, а вміст жезоксигемоглобіну зростає.
Зниження метгемоглобіну пов`язано з активацією фенменту медгемоглобін редуктази.
Спорідненість гемоглобіну до кисню в умовах дії препарату зменшується, про що свідчить зростання швидкості дисоціації дезоксигемоглобіну.
Дія препарату призводить до зниженні швидкості денатурації гемоглобіну, що може бути адаптаційною реакцією даного гемопротеїду на дію препарату.
Список використаних джерел
1. Баб`як О. Попередження негативного впливу на життєдіяльність людини. // Надзвичайна ситуація. - 2001. - № 1. - С.40 - 42.
2. Биохимия. Практикум. - К.: Изд-вго КГУ, 1988. - 128 с.
3. Біологія. Спеціальний випуск "Гідроекологія". - 2005. - №3 (26). - С. 208-210.
4. Брагинский Л.П. Пестициды и жизнь водоёмов. - К.: Наукова думка, 1972. - 228 с.
5. Васильев А.В. Гематология сельскохозяйственных животных. - М.: Сельхозиздательство, 1948. - 439 с.
6. Волынкин Ю.Л. Взаимосвязь морфофизиологических и гематологических показателей сеголетков карпа в период зимовки // Современные проблемы популяционной экологии. Матер. IX Междунар. научно-практ. конф. - Белгород: Политера, 2006. - С.37-38.
7. Врочинський К.К. Пестициди і охорона водних ресурсів. - К.: Урожай, 1987. - 160 с.
8. Давыдов О.Н. Патология крови рыб / О.Н. Давыдов, Ю.Д. Темниханов, Л.Я. Куровская. - К., 2005. - 210 с.
9. Давыдов О.Н., Темниханов Ю.Д., Куровская Л.Я. Патология крови рыб. - К.: Фирма "ИНКОС", 2006. - 320 с.
10. Жиденко А.А., Мехед О.Б., Бибчук Е.В. Влияние пестицидов на качественное и количественное содержание аденилатов в тканях карпа // Актуальные проблемы экологической физиологии, биохимии и генетики животных: материалы Междунар. науч. конф. / отв. ред.А.Б. Ручин. - Саранск: Изд-во Мордов. ун-та, 2005. - С.68-70
11. Жиденко А.А., Мехед О.Б., Близнюк Е.В. Влияние пестицидов на качественный и количественный состав свободных аминокислот в тканях карпа // Актуальные проблемы экологической физиологии, биохимии и генетики животных: материалы Междунар. науч. конф. / отв. ред.А.Б. Ручин. - Саранск: Изд-во Мордов. ун-та, 2005. - С.70-72
12. Записки Тернопільського національного педагогічного університету ім. Володимира Гнатюка. Серія: клинических лабораторных исследований. - М.: Медицина, 1977. - 335с.
13. Зіньковська Н.Г. Цинк як антиоксидант. прооксидант за д. на орган. зм коропа / Н.Г. Заньковська, Ф. Мудра, О.Б. Столяр / Укр. б. ох. м. журн. - 2002. - Т.74, № 4б, дод.2. - С.88.
14. Коваленко О.М., Жиденко А.О. Гістологічні зміни в органах риб під впливом пестицидів // Наукові
15. Коган Ю.С. Общая токсикология пестицидов. - К.: Здоровье, 1981. - 384 с.
16. Константинов А.С. Общая гидробиология. - М.: Высш. шк., 1986. - 472 с.
17. Корсак К.В., Плахотнік О.В. Вплив пестицидів на екосистеми та людину. // Основи екології: навчальний посібник. - 2000. - С.167 - 171.
18. Ликвидация непригодных пестицидов. / И.К. Крийнов, И.А. Боровой, В.М. Скоробогатов и др. // Экотехнология и ресурсосбережение. - 1999. - № 2. - С.47 - 55.
19. Лотт Д.А. Как использовать залежавшиеся пестициды. // Защита и карантин растений. - 1996. - № 5. - С.35 - 36.
20. Мельников Н.Н. Химические средства защиты растений: Справочник. - М.: Химия, 1987. - 712 с.
21. Мехед О.Б. Накопление гербицидов группы 2,4-Д в организме карпа разного возраста // Гидробиол. журн. - 2006. - Т.42, № 3. - С.61-66.
22. Мехед О.Б., Яковенко Б.В. Активність ключових ферментів вуглеводного обміну в організмі коропа лускатого в умовах токсикозу // Вісник проблем біології та медицини. - 2003. - №6. - С. 20-25.
23. Мехед О.Б., Яковенко Б.В. Вплив пестицидного забруднення, як результату хімізації сільського господарства, на водні екосистеми // Суспільно-географічні дослідження природно-господарського комплексу Запорізького краю і суміжних територій: Матеріали науково-практичної конференції 16-17 жовтня 2003 року. - Мелітополь, 2003. - С.43-44
24. Мехед О.Б., Яковенко Б.В. Залежність ізоцитратдегідрогеназної та ізоцитратазної активності в організмі коропа від температури середовища // Укр. біохім. журн. - 2002. - 74, №4б (додаток 2). - С.99
25. Мехед О.Б., Яковенко Б.В., Жиденко А.А. Активность некоторых ферментов углеводного обмена в тканях сеголеток и двухлеток карпа в осенний период // Гидробиол. журн. - 2004. - 40, №3. - С.83-90.
26. Мехед О.Б., Яковенко Б.В., Жиденко А.О. Вплив зенкору на вміст глюкози та активність ферментів глюконеогенезу в тканинах коропа лускатого (Cyprinus carpio L) при різних температурах // Укр. біохім. журн. - 2004. - 76, №3. - С.99-103
27. Ойвин И.А. Статистическая обработка результатов экспериментальных исследований // Патол. физиол. и экспер. терапия. - 1960. - № 4. - С.76-85.
28. Парфенова И.А. Морфометрические характеристики циркулирующих эритроцитов Scorpaena porcus L. в условиях экспериментальной гипоксии // Науков. записки Тернопольського нац. пед. ун. верситету. Сер. я: б. олог. я. - 2005. - № 4 (27). - С.82-83.
29. Підліснюк В.В., Стирановська Т.В. Заборонені та непридатні до використання пестициди: стан та перспективи. // Безпека життєдіяльності. - 2004. - № 6. - С.23 - 28.
30. Посібник з клінічної лабораторної діагностики / П. д ред.В.Г. Денисюка. - К.: Здоров’я, 1992. - 296 с.
31. Сільськогосподарська екологія. / В.К. М`якутко, Д.О. Мельничук, Ф.В. Вольвач та ін; за ред.В.К. М`якушка. - К.: Урожай, 1992. - 264 с.
32. Скорюков В.И. Практикум по ихтиологии. - М.: Агропромиздательство, 1986. - 268 с.
33. Справочник по пестицидам (гигиена применения и токсикология) / Под ред. А.В. Павлова. - К.: Урожай, 1986. - 432 с.
34. Физиология адаптационных процессов. - М.: Наука, 1986. - 635 с.
35. Физиология человека и животных: 2 т. // Коган А.Б. и др. - М.: Высшая школа, 1984. - 360 с.
36. Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. - М.: Просвещение, 1975. - 318 с.
37. Хочачка П.В., Сомеро Д.Н. Биохимическая адаптация. - М.: Мир, 1988. - 568с.
38. Шевряков М.В., Яковенко Б.В., Явоненко О.Ф. Практикум з біологічної хімії: Навч. - метод. Посіб. Для студентів біологічних спеціальностей і факультетів фізичного виховання і спорту вищих навчальних закладів. - Суми: ВТД "Університетська книга", 2003. - 204 с.
39. Яковенко Б.В., Мехед О.Б. Біохімічні зміни в організмі коропа лускатого під впливом гербіцидного забруднення навколишнього середовища // Фальцфейнівські читання. Збірник наукових праць: Матеріали міжнародної наукової конференції 23-25 квітня 2003 року. - Херсон, 2003 - С.395-396 (здобувач виконав експериментальні дослідження, проаналізував літературу, виконав розрахунки)
40. Яковенко Б.В., Мехед О.Б. Концентрація гліцину та інших амінокислот у водоймах // Наукові записки Тернопільського державного педагогічного університету ім. Володимира Гнатюка. Серія: Біологія. Спеціальний випуск: Гідроекологія - 2001. - №3 (14). - С.242-243.
41. Яржомбек А.А. Справочник по физиологии рыб / А.А. Яржомбек, В.К. Лиманский. - М.: Агропромиздательство, 1986. - 192 с.
Похожие работы
... називають гаптенами або неповними антигенами. В процесі зростання і старіння організму продукування антитіл в організмі знижується, а завдяки цьому знижується і захисна реакція. Розвиток і вікові особливості серцево-судинної системи Серце закладається спочатку у вигляді двох правої і лівої трубок, що виникають з мезенхіми і розташованих в області головної кишки; в процесі розвитку ці парні ...
... і переходять розчинені у воді глюкоза, амінокислоти, солі мінеральних речовин. Продукти розщеплення жирів (гліцерин і жирні кислоти) надходять спочатку в лімфу, а з нею потрапляють до кровоносної системи. Травлення в товстому кишечнику. Товстий кишечник людини завдовжки 1,2-1,5м, його діаметр сягає 9 см. Перетравлення їжі та її всмоктування в основному завершуються в тонкому кишечнику. Виняток ...
... ів масажу і виявлялися прискоренням регенерації сідничного нерва. Цікаво, що при продовженні курсу масажу у відповідь реакції організму зменшувалися. Таким чином було експериментальне обґрунтовано дозування курсу масажу – 10 - 15 процедур. 1.3 Вплив масажу на м'язову систему Соматична м'язова система людини включає близько 550 м'язів, розташованих на тілі в декілька шарів і побудованих з ...
... : Закон України «Про банки і банківську діяльність» перш ніж визначити, які банки можуть бути в Україні і як вони повинні функціонувати, зафіксував концептуальне положення, що банківська система України повинна бути дворівневою, встановив, які банки відносяться до кожного з рівнів і яким буде механізм зв’язків між ними. Банківська система – законодавчо визначена, чітко структурована сукупність фі ...

0 комментариев