Навигация
Подготовка и конденсация воды
Курсовая работа
“Подготовка и конденсация воды”
Одесса 2010
Введение
В настоящее время вода широко используется в различных областях промышленности в качестве теплоносителя и рабочего тела, чему способствует широкое распространение воды в природе и ее особые термодинамические свойства, связанные со строением молекул. Полярность молекул воды, характеризуемая дипольным моментом, определяет большую энергию взаимного притяжения молекул воды (ориентационное взаимодействие) при температуре 10…30 С и соответственно большую теплоту фазового перехода при парообразовании, высокую теплоемкость и теплопроводность. Значение диэлектрической постоянной воды, также зависящей от дипольного момента, определяет своеобразие свойств воды как растворителя.
При нагреве воды на поверхностях нагрева образуются твердые отложения накипеобразующих солей. При испарении воды в пар переходят коррозионно-активные газы, которые способствуют разрушению поверхности охлаждения и генерируют новые вещества, образующие отложения из продуктов коррозии.
Надежность работы энергетического оборудования на станции непосредственно связана с качеством подпиточной воды котлов. Правильно рассчитанный, смонтированный и эксплуатируемый комплекс водоподготовки, дополненный химической программой коррекции котловой воды, является необходимым условием долговечной и экономичной работы любого котлоагрегата.
В условиях эксплуатации энергетического оборудования на ТЭС или АЭС при организации водного режима необходимо создавать условия, при которых обеспечиваются минимальные значения скорости коррозии и снижение накипных отложений. Отложения могут образовываться из примесей, поступающих в воду теплоэнергетических установок от внешних и от внутренних источников.
Исходные данные
Исходной водой является вода Бассейны Ингула со следующим химическим составом:
-биогенные компоненты:
![]() =1,66 мг/л;;
=1,66 мг/л;;
NO2+=0,030 мг/л;
NO3+=0,11 мг/л;
Fe=0,11 мг/л;
P=0,060мг/л;
Si=5,9 мг/л;
-окисляемость:
БО=28,4 мгО2/л;
ПО=7,8мгО2/л;
-главные ионы:
HCO3-=294,7 мг/л;
SO42-=67,8 мг/л;
Cl-=55,7 мг/л;
Ca2+=92,3 мг/л;
Mg2+=15,9 мг/л;
Na++K+=38,5мг/л;
-Жо=5,9 мг-экв/л;
Блоки: 210МВт 6шт.
Таблица 1
| Общая концентрация | Электро провод ность, χ=Сλf мкСм/см | |||||||||
| Молекуля рная масса "М" | Эквива лентная масса "Э" | Обозначения | Исх. концентрация | Скорректированная концентрация | ||||||
| [H] мг/кг | [C]мг-экв/кг | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | |||||
| 40,08 | 20,04 | Ca2+ | 51,8 | 2,585 | 51,8 | 2,585 | 0,0013 | 0,005 | 110,67 | |
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 10,8 | 0,899 | 0,0004 | 0,001 | 40,8 | |
| 23 | 23 | Na+ | 6,4 | 0,278 | 11,884 | 0,517 | 0,0005 | 0,001 | 23,84 | |
| 1 | 1 | H+ | ||||||||
| Сумма Kt | 3,762 | 4,001 | ||||||||
| 17 | 17 | OH- | ||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 199,7 | 3,274 | 0,0033 | 0,020 | 134,18 | |
| 60 | 30 | CO32- | ||||||||
| 96 | 48 | SO42- | 17,3 | 0,360 | 17,3 | 0,360 | 0,0002 | 0,002 | 20,75 | |
| 35,46 | 35,46 | Cl- | 13,0 | 0,367 | 13,0 | 0,367 | 0,0004 | 0,001 | 25,78 | |
| Сумма An | 4,001 | 4,001 | ||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
| ||||||
| NH4-,мг/л | 0,60 | моль/л | 0,006 |
| ||||||
| NO2-, мг/л | 0,02 | f’ | 0,921 |
| ||||||
| NO3-, мг/л | 0,11 | f“ | 0,720 |
| ||||||
| Fe, мг/л | 0,10 | CО2ф,моль/л | 0,00002 |
| ||||||
| P, мг/л | 0,04 | СО2р,моль/л | 0,00016 |
| ||||||
| Si, мг/л | 0,00 | рНф | 8,59 |
| ||||||
| БО, мгО2/л | 10,7 | рНр | 7,75 |
| ||||||
| ПО, мгО2/л | 4,00 | Ис | 0,84 |
| ||||||
| Жо, мг-экв/л | 3,7 | Жо-расчетное значение, мг-экв/л | 3,48 |
| ||||||
| СС,мг/л | СС, расчетное значение мг/л | 304,48 |
| |||||||
| Электропроводность,Сf,мкСм/см | 356,02 |
| ||||||||
Расчёт и корректировка исходного состава воды
Для начала найдём эквивалентные массы ионов:
Э = М/Z,
где М- молярная масса иона;
Z- заряд иона.
Э(Са2+) = 40,08/2 = 20,04 г-экв;
Эквиваленты остальных ионов считаются аналогично.
Расчет начинаем с анионного состава воды:
[С] = [Н]/Э,
где [Н]- концентрация иона, выраженная в мг/л,
Э- эквивалент иона.
С(HCO3-) =3,274мг-экв/кг;
С(SO42-) = 0,360мг-экв/кг;
C(Cl-) = 0,367 мг-экв/кг.
Σ An = 4,001мг-экв/кг.
Рассчитаем катионный состав воды:
С(Са2+) = 2,585мг-экв/кг;
С(Mg2+) = 0,899мг-экв/кг;
С(Na+) = 0,278мг-экв/кг;
Σ Kt = 3,762мг-экв/кг.
Правильность определения концентраций катионов и анионов, т.е. солей, образованных эквивалентным количеством ионов, проверяют на основании закона электронейтральности по уравнению:
Σ Kt=ΣAn.
При несоблюдении этого условия, следует скорректировать состав воды. Это достигается путём добавления натрия Na+.
Т.о. закон электронейтральности соблюдается.
Пересчитаем значения концентраций примесей в другие виды концентраций: [N]= [Н]/(М.1000), моль/л;
Пересчёт остальных концентраций осуществляется аналогично.
[С]= [Н]/104,%
Ионная сила раствора равна полусумме произведений молярных концентраций на квадраты их зарядов.
μ = 0,5 ![]()
Коэффициент активности – функция ионной силы раствора:
lg f' = -0.5Zi2 ![]() ,
,
f = 10![]() ,
,
Концентрация в природных водах недиссоциированных молекул Н2СО3 составляет обычно лишь доли процента от общего количества свободной углекислоты, под которым понимают сумму Н2СО3+ СО2.
Равновесное значение суммы Н2СО3+ СО2, моль/кг
Н2СО3+ СО2 = 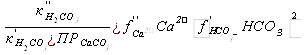 ,
,
и рН – равновесное
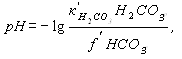
Таблица 2
| Молекуляр- | Эквивалент- | Обозначения | Концентрации после коагуляции | Электропровод- | |||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | |
| 40.08 | 20.04 | Ca2+ | 51.800 | 2.585 | 0.0013 | 0.005 | 109.97 |
| 24.03 | 12.01 | Mg2+ | 10.800 | 0.899 | 0.0004 | 0.001 | 40.54 |
| 23 | 23 | Na+ | 11.884 | 0.517 | 0.0005 | 0.001 | |
| 1 | 1 | H+ | |||||
| Сумма Kt | 4.001 | ||||||
| 17 | 17 | OH- | |||||
| 61 | 61 | HCO3- | 169.200 | 2.774 | 0.003 | 0.017 | 113.50 |
| 60 | 30 | CO32- | |||||
| 96 | 48 | SO42- | 41.300 | 0.860 | 0.000 | 0.000 | 49.23 |
| 35.46 | 35.46 | Cl- | 13.000 | 0.367 | 0.000 | 0.001 | 25.74 |
| Сумма An | 4.001 | ||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения | ||||
| NH4+, мг/л | 0.300 | моль/л | 0.006 | ||||
| NO2-, мг/л | 0.011 | f' | 0.920 | ||||
| NO3-, мг/л | 0.055 | f'' | 0.715 | ||||
| Fe, мг/л | 0.030 | СО2 моль/л | 0.0005 | ||||
| P, мг/л | 0.022 | pH | 7.153 | ||||
| Si, мг/л | 0.000 | Жо - расчетное значение, мг-экв/л | 3.484 | ||||
| БО, мгО2/л | 5.350 | CC, расчетное значение мг/л | 297.984 | ||||
| ПО, мгО2/л | 2.000 | Электропроводность, СfмкСм/см | 362.783 | ||||
| Dk,мг-экв/л | 0.500 | ||||||
Вывод: Величина pH имеет оптимальное значение, т.к. входит в интервал 5,5-7,5. Бикарбонатная щелочность увеличилась на дозу коагулянта, а содержание сульфатов увеличилось.
Коагуляция исходной воды
В данном случае, в качестве коагулянта использовался сернокислый алюминий Al2(SO4)3.
Доза добавляемого коагулянта:
Dk = 0,07.ПО = 0,12.8,1 = 0,972мг-экв/л.
Т.к. Dk>0,5 принимаем это значение равное 0,5 мг-экв/л.
Оптимальное значение рН при коагуляции с сернокислым алюминием находится в интервале 5,5 – 7,5. Значение величины рН среды при коагуляции оказывает влияние на скорость и полноту гидролиза.
При коагуляции в обрабатываемой воде увеличивается содержание сульфатов, но уменьшается бикарбонатная щелочность на дозу коагулянта. Катионный состав воды не меняется.
Таблица 3
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После гидратного известкования | Электропровод- | ||||||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность,мкСм/см | |||||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 31,088 | 1,551 | 0,0008 | 0,0031 | 69,44 | ||||||||||
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 0,0004 | 0,0011 | 7,782 | 0,648 | 0,0003 | 0,0008 | 30,74 | ||||||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,11 | ||||||||||
| 1 | 1 | H+ | |||||||||||||||||||
| Сумма Kt | 4,69 | 2,716 | |||||||||||||||||||
| 17 | 17 | OH- | 5,100 | 0,300 | 0,0003 | 0,0005 | 55,4 | ||||||||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 0,0033 | 0,02 | 19,215 | 0,315 | 0,0003 | 0,0019 | 13,05 | ||||||||||
| 60 | 30 | CO32- | 5,550 | 0,185 | 0,0001 | 0,0006 | 9,65 | ||||||||||||||
| 96 | 48 | SO42- | 17,3 | 0,360 | 0,0002 | 0,0017 | 41,3 | 0,860 | 0,0004 | 0,0041 | 51,8 | ||||||||||
| 35,46 | 35,46 | Cl- | 37,43 | 21,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,06 | ||||||||||
| Сумма An | 4,69 | 2,716 | |||||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
| |||||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,004 |
| |||||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,931 |
| |||||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,752 |
| |||||||||||||||||
| Fe, мг/л | 0,33 | СО2 моль/л | 0,0005 |
| |||||||||||||||||
| P, мг/л | 0,022 | pH | 10,446 |
| |||||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 2,199 |
| |||||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 154,249 |
| |||||||||||||||||
| ПО, мгО2/л | 2 | Электропроводность, СfмкСм/см | 329,249 |
| |||||||||||||||||
| Dk,мг-экв/л | 0,5 |
| |||||||||||||||||||
| Dи,мг-экв/л | 3,78 |
| |||||||||||||||||||
| Иизв,мг-экв/л | 0,300 |
| |||||||||||||||||||
| DCaCl2,мг-экв/л | -0,689 |
| |||||||||||||||||||
| Mg2+max | 0,596 |
| |||||||||||||||||||
Коагуляция с известкованием исходной воды (гидратный режим)
Гидратный режим известкования благоприятен для удаления магния, соединений железа, кремния и для осветления воды.
Для расчёта данной таблицы использовали коагулянт – сернокислое железо FeSO4 и гашёную известь Са(ОН)2. Оптимальное значение рН находится в интервале 9 – 10,5. Доза коагулянта Dk = 0,5 мг-экв/л.
Т.к. воды относятся к III группе и являются щелочными, т.е содержание ионов НСО3- находится в избытке по сравнению с остаточной жесткостью, то известкование в этом случае является нецелесообразным. Воду из III группы переводят в I путем добавления CaCl2 эквивалентно содержанию HCO3-.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Используя закон электронейтральности, находим остаточную концентрацию ионов Са2+:
Концентрация сульфатов увеличивается на дозу коагулянта.
Таблица 4
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После бикарбонатного известкования | Электропровод- | ||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | |||
| 40,08 | 20,04 | Ca2+ | 51,8 | 2,585 | 0,0013 | 0,0052 | 21,443 | 1,07 | 0,0005 | 0,0021 | 48,48 | ||
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 0,0004 | 0,0011 | 10,8 | 0,899 | 0,0004 | 0,0011 | 43,17 | ||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,18 | ||
| 1 | 1 | H+ | |||||||||||
| Сумма Kt | 4,001 | 2,486 | |||||||||||
| 17 | 17 | OH- | 1,190 | 0,070 | 0,0001 | 0,0001 | 12,97 | ||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 0,0033 | 0,02 | 23,485 | 0,385 | 0,0004 | 0,0023 | 16,0 | ||
| 60 | 30 | CO32- | 3,450 | 0,115 | 0,0001 | 0,0003 | 6,07 | ||||||
| 96 | 48 | SO42- | 17,3 | 0,36 | 0,0002 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 52,42 | ||
| 35,46 | 35,46 | Cl- | 37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,28 | ||
| Сумма An | 4,69 | 2,486 | |||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
| |||||||||
| NH4+,мг/л | 0,3 | моль/л | 0,004 |
| |||||||||
| NO2-, мг/л | 0,011 | f' | 0,934 |
| |||||||||
| NO3-, мг/л | 0,055 | f'' | 0,761 |
| |||||||||
| Fe, мг/л | 0,03 | СО2 моль/л | 0,0005 |
| |||||||||
| P, мг/л | 0,022 | pH | 9,816 |
| |||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 1,969 |
| |||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 149,792 |
| |||||||||
| ПО, мгО2/л | 2,0 | Электропроводность, СfмкСм/см | 278,574 |
| |||||||||
| Dk,мг-экв/л | 0,5 |
| |||||||||||
| Dи,мг-экв/л | 3,481 |
| |||||||||||
| Иизв,мг-экв/л | 0,07 |
| |||||||||||
| DCaCl2,мг-экв/л | 0 |
| |||||||||||
Коагуляция и известкование исходной воды (карбонатный режим)
В качестве коагулянта используется сернокислое железо, доза которого Dk = 0,5 мг-экв/л.
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Приняв значение ОН, определяем остаточную концентрацию иона Mg2+.
Mg2+ост = ![]() мг-экв/л.
мг-экв/л.
Концентрацию магния не изменяется.
Остаточная концентрация кальция рассчитывается из закона электронейтральности (концентрация ионов магния и натрия не изменяется):
Карбонатный режим применяют: 1) когда вынужденно приходится использовать в качестве коагулянта сернокислый алюминий; 2) при необходимости исключить выделение магниевых соединений, чтобы в случае соблюдения определённых гидравлических условий получать при известковании крупнокристаллический осадок. При карбонатном режиме несколько уменьшается расход извести (по сравнению с гидратным режимом).
Таблица 5
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После известкования и содирования | Электропровод- | |||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность,мкСм/см | ||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 1,922 | 0,096 | 0,00005 | 0,0002 | 4,54 | |||||||
| 24,03 | 12,01 | Mg2+ | 10,8 | 0,899 | 0,0004 | 0,0011 | 5,185 | 0,432 | 0,0002 | 0,0005 | 21,64 | |||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 2,238 | 0,0005 | 0,0012 | 105,89 | |||||||
| 1 | 1 | H+ | ||||||||||||||||
| Сумма Kt | 4,69 | 8,199 | ||||||||||||||||
| 17 | 17 | OH- | 5,950 | 0,350 | 0,0004 | 0,0006 | 65,54 | |||||||||||
| 61 | 61 | HCO3- | 199,7 | 3,274 | 0,0033 | 0,02 | 12,200 | 0,200 | 0,0002 | 0,0012 | 8,4 | |||||||
| 60 | 30 | CO32- | 9,000 | 0,300 | 0,0002 | 0,0009 | 16,53 | |||||||||||
| 96 | 48 | SO42- | 17,3 | 0,36 | 0,0002 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 54,74 | |||||||
| 35,46 | 35,46 | Cl- | 37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 76,1 | |||||||
| Сумма An | 4,69 | 2,766 | ||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
| ||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,003 |
| ||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,944 |
| ||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,795 |
| ||||||||||||||
| Fe, мг/л | 0,030 | СО2 моль/л | 0,0005 |
| ||||||||||||||
| P, мг/л | 0,022 | pH | 10,519 |
| ||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 0,528 |
| ||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 158,519 |
| ||||||||||||||
| ПО, мгО2/л | 42,0 | Электропроводность, СfмкСм/см | 353,369 |
| ||||||||||||||
| Dk,мг-экв/л | 0,5 |
| ||||||||||||||||
| Dи,мг-экв/л | 3,948 |
| ||||||||||||||||
| Иизв,мг-экв/л | 0,350 |
| ||||||||||||||||
| Dс,мг-экв/л | 1,722 |
| ||||||||||||||||
| DCaCl2,мг-экв/л | -0,689 |
| ||||||||||||||||
| Mg2+max | 0,403 |
| ||||||||||||||||
| Са2+мах | 0,088 |
| ||||||||||||||||
Коагуляция с известкованием и содированием исходной воды
Доза извести считается следующим образом:
Dи = СО2исх + ΔНСО3- + Dk+Ии, мг-экв/л;
Происходящие при известково-содовом умягчении основные химические процессы описываются следующими уравнениями:
а2СО3 → 2 Nа+ + СО32-;
Са(ОН)2 → Са2+ +2ОН-;
СО2 + 2ОН- → СО32- + Н2О;
Н+ + ОН- → Н2О
НСО3- → Н+ + СО32-
НСО3- + ОН- = СО32- + Н2О;
Са2+ + СО32- → СаСО3↓;
Мg2+ + 2ОН- → Мg(ОН)2↓.
Приняв значение ОН- определяем остаточную концентрацию ионов кальция и магния. Концентрация сульфатов увеличивается на дозу коагулянта.
Т.о. остаточную концентрацию натрия определяем из закона электронейтральности.
Таблица 6
| Молекуляр- | Эквивалент- | Обозначения | Концентрации(С СаСl2,Ca=HCO3) | После известкования с обескремниванием | Электропровод- | |||||||||||||
| ная масса "М" | ная масса "Э" | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | [H] мг/кг | [C] мг-экв/кг | [N] моль/кг | % | ность, мкСм/см | ||||||||
| 40,08 | 20,04 | Ca2+ | 65,606 | 3,274 | 0,0016 | 0,0066 | 33,328 | 1,663 | 0,00108 | 0,0033 | 74,53 | |||||||
| 24,03 | 12,01 | Mg2+ | 108 | 0,899 | 0,0004 | 0,0011 | 6,440 | 0,536 | 0,0003 | 0,0006 | 25,46 | |||||||
| 23 | 23 | Na+ | 11,884 | 0,517 | 0,0005 | 0,0012 | 11,884 | 0,517 | 0,0005 | 0,0012 | 24,12 | |||||||
| 1 | 1 | H+ | ||||||||||||||||
| Сумма Kt | 4,69 | 0,276 | ||||||||||||||||
| 17 | 17 | OH- | 5,100 | 0,300 | 0,0003 | 0,0005 | 55,42 | |||||||||||
| 61 | 61 | HCO3- | 1997 | 3,274 | 0,0033 | 0,02 | 23,485 | 0,385 | 0,0004 | 0,0023 | 15,96 | |||||||
| 60 | 30 | CO32- | 3,450 | 0,115 | 0,0001 | 0,0003 | 6,00 | |||||||||||
| 96 | 48 | SO42- | 17,3 | 0,36 | 0,00202 | 0,0017 | 41,3 | 0,86 | 0,0004 | 0,0041 | 51,85 | |||||||
| 35,46 | 35,46 | Cl- | 37,43 | 1,056 | 0,0011 | 0,0037 | 37,43 | 1,056 | 0,0011 | 0,0037 | 75,08 | |||||||
| Сумма An | 4,69 | 2,716 | ||||||||||||||||
| Обозначения | Значения | Обозначения и расчетные формулы | Значения |
| ||||||||||||||
| NH4+, мг/л | 0,3 | моль/л | 0,004 |
| ||||||||||||||
| NO2-, мг/л | 0,011 | f' | 0,932 |
| ||||||||||||||
| NO3-, мг/л | 0,055 | f'' | 0,753 |
| ||||||||||||||
| Fe, мг/л | 0,03 | СО2 моль/л | 0,00052 |
| ||||||||||||||
| P, мг/л | 0,022 | pH | 10,446 |
| ||||||||||||||
| Si, мг/л | 0 | Жо - расчетное значение, мг-экв/л | 2,199 |
| ||||||||||||||
| БО, мгО2/л | 5,35 | CC, расчетное значение мг/л | 157,317 |
| ||||||||||||||
| ПО, мгО2/л | 2,0 | Электропроводность, СfмкСм/см | 328,418 |
| ||||||||||||||
| Dk,мг-экв/л | 0,5 |
| ||||||||||||||||
| Dи,мг-экв/л | 3,711 |
| ||||||||||||||||
| Иизв,мг-экв/л | 0,300 |
| ||||||||||||||||
| DCaCl2,мг-экв/л | 0,689 |
| ||||||||||||||||
| Mg2+max | 0,493 |
| ||||||||||||||||
Вывод: Для данных вод с содержанием ГДП>2 мг/л, Ок>4 мгО2/л, Жк>2 мг-экв/л, Жнк<10 мг-экв/л, концентрацией Si<3 мг/л оптимальной схемой предочистки является К+Иг+Ф и К+Иб+Ф.
Коагуляция с известкованием и магнезиальным обескремниванием исходной воды
Основным из числа методов магнезиального обескремнивания воды является метод обескремнивания каустическим магнезитом. Одновременно с обескремниванием воды проводят её известкование и коагуляцию.
Известкование при магнезиальном обескремнивании производится для того, чтобы снизить щёлочность воды и создать должную величину рН. При рН<10удаление кремнекислых соединений будет затруднено из-за недостаточной диссоциации Н2SiО3. Кроме того, вследствие низкой концентрации в воде ионов ОН- обескремнивающий реагент будет взаимодействовать с бикарбонат-ионами исходной воды, свободной угольной кислотой, а также введённым в воду коагулянтом:
МgО + Н2О → Мg(ОН)2 → Мg2+ + 2ОН-;
ОН- + Н+ → Н2О;
НСО3- → СО32- + Н+;
СО2 + Н2О → Н2СО3 → Н+ + НСО3- → 2 Н+ + СО32-;
СО32- + Са2+ → СаСО3↓;
Похожие работы
... l/d трубки. 6590 Вт/(м2К). Графически определяем при =26,81°С q=22306 Вт/м2. Коэффициент теплопередачи охладителя: Площадь поверхности теплообмена: 3.6 Анализ теплотехнических расчетов В настоящее время для очистки трапных вод с энергоблоков 1-4 на Балаковской АЭС применяются три выпарные установки: две в работе, одна в резерве. Фактические поверхности теплопередачи выпарного ...
... Эта особенность имеет большое значение для нагревания воды подо льдом. Теплопроводность льда довольно высокая—53·10-4 кал/ (см · сек · °С); для сравнения: теплопроводность воды—14, а воздуха— 0,57 кал/(см · сек · °С). излучений и т. д. 1.9 Серебряная вода и ее применение. Еще 2500 лет назад персидский царь Кир во время походов пользовался водой, сохраняемой в серебряных сосудах. В древней ...
... . Еще один-два микрона осажденной воды содержится в облаках. Казалось бы, всякие разговоры о гидрологии при таком положении вещей теряют смысл. Но это очень поверхностный, утилитарный вгляд. На самом деле «круговорот воды», хотя и совсем не такой, о котором нам рассказывали в школе, вполне возможен и с такой слабой атмосферой, как марсианская. И интерес к нему не случаен. Несмотря на всю свою ...
... %. Количество осадка после механической очистки - 1,5 л/м3. Осадок удаляется раз в 5-7 суток перекачкой его в начало очистных сооружений. Сооружения обеззараживания и обезвреживания осадков Химическое обеззараживание осадков проводится известью, аммиаком, тиазоном, формальдегидом или мочевиной. Одновременно повышается удобрительная ценность осадков. Требуемая для обеззараживания известью ...

0 комментариев