Навигация
Методы определения карбоксипептидазо-В-подобной активности
2.2. Методы определения карбоксипептидазо-В-подобной активности
Карбоксипептидазо-В-подобную активность определяли флюориметрическим методом Фрикер и Снайдер с модификациями. В основу метода положена различная растворимость в хлороформной и водной фазах субстрата и продукта реакции.
2.2.1. Определение активности карбоксипептидазы Н
50мкл 1% гомогената смешивали со 150мкл 50мМ натрий-ацетатного буфера, рН 5.6, в случае контрольной пробы; в случае опытной пробы 50мкл 1% гомогената смешивали со 140мкл 50мМ натрий-ацетатного буфера, рН 5.6 с добавлением 10мкл ГЭМЯК.
Смесь инкубировали 8 мин при 37°C. Реакцию начинали прибавлением 50мкл субстрата (DNS-фен-лей-арг, приготовленного на 50мМ натрий-ацетатном буфере при рН 5.6). Пробы перемешивали и инкубировали 60 мин при 37°C.
Реакцию останавливали добавлением 50мкл 1н р-ра HCl.
Для экстракции продукта DNS-фен-лей к пробам добавляли 1,5 мл хлороформа, интенсивно встряхивали в течение 60с и центрифугировали 10мин при 1000об/мин для разделения фаз.
Измерение флюоресценции проводили на флюориметре ФМЦ-2 (λex = 360нм, λex = 530нм) в кювете толщиной 1см.
Активность КПН определяли как разность в флюоресценции проб и выражали DNS-фен-лей, образовавшегося за 1мин инкубации в расчете на 1мг белка.
2.3. Методика определения белка
Количество белка в пробах определяли по методу Лоури. Этот метод сочетает в себе биуретовую реакцию (реакцию на пептидные связи) и реакцию Фолина (на тирозин и триптофан). Метод Лоури является достаточно чувствительным (10-100мкг белка в пробе) и наиболее точным из всех существующих методов количественного определения белка.
Калибровочную кривую строили по раствору бычьего сывороточного альбумина (БСА). Для этого из исходного р-ра БСА (100мкг/мл) готовили разведения с концентрацией БСА 10, 20, 30, 40, 50, 60, 70, 80, 90мкг/мл и определяли в них концентрацию белка по обычной схеме. График зависимости оптической плотности от концентрации белка приведен на рис.1.
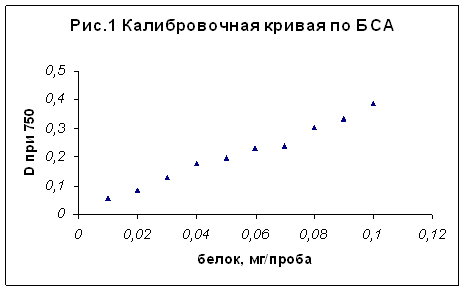
Для проведения цветной реакции отбирали 0,5мл р-ра белка, приливали по 1мл реактива С, приготовленного следующим образом: р-р А (21,6г Na2CO3×10H2O и 4г NaOH растворили в 1л воды) и р-р В (0,5г CuSO4×5H2O и 1г цитрата натрия растворяли в 10мл воды) смешивали в отношении 50:1. Пробы тщательно перемешивали и выдерживали 10мин при комнатной температуре. Затем прибавляли 0,1мл 1н реактива Фолина, тщательно перемешивали и выдерживали 40мин при комнатной температуре. Пробы фотоколориметрировали на КФК-2 при λ = 750нм против холостой пробы.
2.4. Статистическая обработка результатов исследования
Для оценки достоверности различий между контрольной и опытной группой использовали t-критерий Стьюдента. Это параметрический критерий, используемый для проверки гипотез о достоверности разнице средних при анализе количественных данных о популяциях с нормальным распределением и одинаковой вариантой.
Метод Стьюдента различен для независимых и зависимых выборок. Независимые выборки получаются при исследовании двух различных групп испытуемых (в нашем эксперименте это опытная и контрольная группы).
Далее в таблице значений t находят величину, соответствующую n-2 степеням свободы, где n – общее число испытуемых в обеих выборках, и сравнивают эту величину с результатом расчета по формуле.
Если полученный результат больше, чем значение для уровня достоверности 0,05, найденное в таблице, то можно отбросить нулевую гипотезу, т.е. считать разницу средних достоверной. Если же полученный при вычислении результат меньше, чем табличный, то нулевую гипотезу нельзя отбросить, и следовательно, разница средних не достоверна [5].
3. Результаты и обсуждение
Результаты исследования активности КПН и ФМСФ-КП в гипофизе, гипоталамусе, стриатуме, больших полушариях, четверохолмии и надпочечниках под влиянием пирроксана представлены на двух диаграммах.
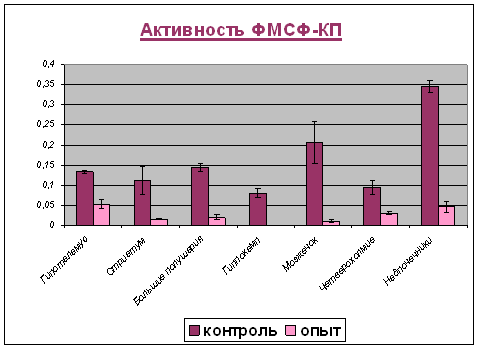
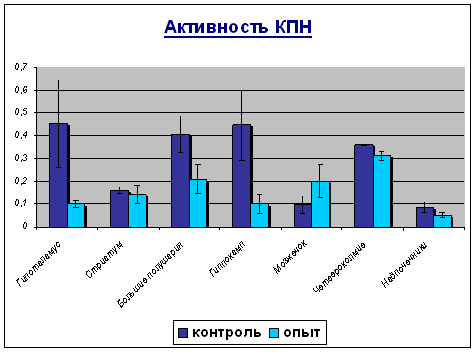
В ходе проведения эксперимента было установлено, что получение животными пирроксана приводит к существенному снижению активности ферментов обмена регуляторных пептидов:
а) активность ФМСФ-КП падает в стреатуме, больших полушариях и надпочечниках в 7раз, а в гипоталамусе и четверохолмии в 3раза. Лишь в гипофизе наблюдается небольшое увеличение активности фермента в 2раза;
б) активность КПН уменьшается во всех пробах: в гипоталамусе в 4.5 раза, а в больших полушариях и четверохолмии в 1.5раза.
Можно пытаться толковать эти данные так, что активность ферментов обмена регуляторных пептидов может регулироваться состоянием адренергической системой, с использованием нескольких путей.
Итак, возможна регуляция через Ca2+-систему: при действии на α-адренорецепторы наблюдается изменение концентрации ионов Ca2+, но сами ионыне влияют на активность ферментов, а изменяют стабилизацию, агрегацию и способность к связыванию с мембраной. В составе фермента, а именно КПН, обнаружен участок связывания с данным ионом. Возможно, что биологическая роль растворимого и мембраносвязанного КПН отличается. Предполагают, что обе формы принимают участие в процессинге нейропептидов, но мембраносвязанная форма, наряду с этим, участвует в сортировке пептидов. Следовательно, различная концентрации Ca2+ может приводить к снижению уровня активности КПН, т.к., вероятно, происходит изменение соотношения растворимой и мембраносвязанной форм. Результатом служит влияние на процессинг и сортировку биологически активных пептидов. Аналогичный механизм будет действовать и в отношении ФМСФ-КП, так как для нее также обнаружена мембраносвязанная форма.
Возможен путь за счет изменения состояния мембраны, что ведет к изменению состояния липидного слоя и, следовательно, уменьшается активность мембаносвязанных форм изучаемых ферментов.
Наиболее важным является механизм аденилатциклазного пути, в котором внимание уделяется не цАМФ, а G-белкам. Известно, что при действии на α-адренорецепторы происходит инактивация Gi-белка и синтезироваться цАМФ не будет, т.к. не будет работать аденилатциклаза. Что приводит к уменьшению части обменных процессов, след-но, уменьшается скорость синтеза мРНК и трансляции, и результат – замедление синтеза изучаемых ферментов, в связи с тем, что считывание происходит в меньшей степени.
Разнонаправленное изменение активности ФМСФ-КП может быть вызвано с те, что в гипофизе и в гипоталамусе участвуют в образовании активных форм разных пептидов.
В целом полученные данные согласуются с литературными об изменении уровня регуляторных пептидов при введении α-адреноблокаторов.
Итак, изменение активности карбоксипептидаз через адренергическую систему может влиять на уровень регуляторных пептидов, а через пептиды – на функционирование других систем организма и, соответственно, на состояние сердечно-сосудистой системы, а также на эмоциональный статус, поведение и другие функции высшей нервной деятельности.
ВЫВОДЫ
Изучение влияния пирроксана на активность основных карбоксипептидаз в нервной ткани крыс позволило сделать следующие выводы:
Ø при введении а-адреноблокатора активность изучаемых ферментов имела тенденцию к снижению в большинстве изученных отделов;
Ø в связи с тем, что при воздействии активность КПН и ФМСФ-КП изменяется однонаправлено, то скорее всего, оба фермента обладают сходной биологической функцией;
Ø изменение активности ферментов под влиянием пирроксана указывает на то, что взаимосвязь между пептидергической и адренергической системой может осуществляться посредством изучаемых карбоксипептидаз.
Библиографический список
1. Азарян А.В. Пептидгидролазы нервной системы и их биологические функции. – Ереван: Айастан, 1989. – 208 с
2. Азарян А.В. Пептидгидролазы нервной системы и их биологические функции //Ереван – Айастан, 1989. – 208 с.
3. Ашмарин И.П., Каменская М.А. Нейропептиды в симпатической передаче // Итоги Н. и Т. (ВИНИТИ. Сер. Физиология человека и животных). – 1988. – 34, 184 с.
4. Бабичев В.Н. Нейроэндокринный контроль процессов пубертации // Усп. совр. биол. – 1994. – 114, № 3. – С. 330-344.
5. Беляев Н.А., Колесанова Е.Ф. Динамика содержания мет-энкефалина в надпочечниках и плазме крови крыс при острой алкогольной интоксикации // Вопросы мед. химии. – 1990. – Т. 36, № 3. – С.86-87.
6. Вернигора А. Н., Генгин М. , Макарова В. В. Влияние стрессовых факторов на активность карбоксипептидазы Н в отделах головного мозга крыс // Укр. биохим. журн. – 1992. – 64. № 2. – С. 45-49. Н124.
7. Вернигора А.Н., Генгин М.Т. Влияние этанола на активность карбоксипептидазы Н в гипофизе и некотрых отделах головного мозга крыс при различных стрессирующих воздействиях //Физиологический журнал им. И.М. Сеченова, 1993. - Т. 79, № 3. – 34-38с.
8. Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и участие в обмене нейропептидов //Биохимия – 1996. – 61, № 5. – С. 771-785.
9. Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Очистка и физико-химические свойства растворимой карбоксипептидазы Н из серого вещества головного мозга кошки //Биохимия. – 1992. – Т. 57, № 11. – С. 1712-1719.
10. Вернигора А.Н., Генгин М.Т., Салдаев Д.А., Щетинина Н.В. Распределение активности фенилметилсульфонилфторид-ингибируемой карбоксипептидазы в нервной ткани котов // Нейрохимия. – 1997. – Т. 14, № 4. – С. 423 - 425.
11. Вернигора А.Н., Михайлова О.Е., Генгин М.Т., Рыжкова Ю.А., Мухина Е.С. Влияние хронического потребления этанола на активность основных карбоксипептидаз в отделах мозга крыс //Укр. биохим. журн., 2002. – Т. 74, № 6. – 128-130с.
12. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние внутрибрюшинного введения физиологического раствора на поведение крыс в тесте “открытое поле” и активность ферментов обмена нейропептидов //Физиол. журнн, 1995. – Т. 81, № 12. – 121-125с.
13. Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Частичная характеристика основной фенилметилсульфонилфторид-ингибируемой карбоксипептидазы из головного мозга кошки //Биохимия. – 1995. – Т. 60, № 11. – С. 1860-1866.
14. Генгин М.Т., Вернигора А.Н. Ферменты процессинга опиоидных пептидов и методы определения их активности //Укр. биохим. журн. – 1994. – Т. 66, № 2. – С. 3-17.
15. Гомазков О.А. Функциональная биохимия регуляторных пептидов. -М: Наука. 1993. – 160 с.
16. Оболенская Н.Е. Некоторые особенности образования нейропептидов // Успехи совр. биол. – 1989. – Т. 108, № 3(5). – С. 337-341.
17. Щетинина Н.В. Активность основных карбоксипептидаз в тканях и отделах мозга крыс в онтогенезе //дис. на соиск. ученой степени кандидата биол. наук. – Спб., 1997.
18. Daud A.I., Bumpus F.M., Husain A. Characterization of angiotensin I-converting enzyme (ACE)-containing follicles in the rat ovary during the estrous cycle and effects of ACE inhibitor on ovulation //Endocrinology. – 1990. – 126, № 6. – Р. 2927-2935.
19. Fiedorek F.T.Jr., Parkinson D. Carboxypeptidase H processing and secretion in rat clonal beta-cell lines //Endocrinology. – 1992. – V. 131, № 3. – P. 1054-1062.
20. Fricker L.D., Snyder S.H. Enkephalin convertase: purification and charasterization of a specific enkephalin-synthesizing carboxypeptidase localized to adrenall chromaffin granules //Proc. Natl. Acad. Sci. USA. – 1982. – № 79. – P. 3886-3890.
21. Guest P.C., Pipeleers D., Rossier J., Rhodes C.J., Hutton J.C. Co-secretion of carboxypeptidase H and insulin from isolated rat islets of Langerhans //J. Biochem. – 1989. – V. 264, № 2. – P. 503-508.
0 комментариев