Навигация
Медико-тактическая характеристика чрезвычайной ситуации, связанной с аварийным выбросом хлора
Балтийская государственная академия рыбопромыслового флота
Кафедра: Защита в чрезвычайных ситуациях
КУРСОВАЯ РОБОТА
по дисциплине Медицина катастроф
Тема:
Медико-тактическая характеристика чрезвычайной ситуации, связанной с аварийным выбросом хлора
Исполнитель: студентка гр.ЗЧС-41
Андруша М.И.
Преподаватель: д.п.н. Вавилова Л.Н.
г. Калининград
2009
Содержание
Введение
Глава 1. Особенности аварий, связанных с применением хлора в технологических процессах
1.1 Химическая характеристика хлора, специфика его использования в технологических процессах и воздействие хлора на организм человека
1.2 Основные причины возникновения аварийных ситуаций и последствия аварий на химически опасных объектах, использующих в производстве хлор
Глава 2. Медико-тактическая характеристика чрезвычайных ситуаций, связанных с авариями на промышленных объектах, использующих в технологических процессах хлор
2.1 Основные требования к безопасности технологических процессов с использованием хлора
2.2 Основные требования безопасности для персонала и нормы поведения населения, проживающего вблизи предприятий, использующих в технологических процессах хлор
Глава 3: Организация аварийно-спасательных работ в зоне чрезвычайной ситуации, связанной с аварийным выбросом хлора
3.1 Организация работ аварийно-спасательных формирований по спасению и эвакуации людей из загазованной зоны
3.2 Задачи служб предприятия, использующего в технологических процессах хлор, и привлекаемых для ликвидации аварий аварийно-спасательных формирований, направленные на ликвидацию чрезвычайной ситуации с выбросом хлора и ее последствий
Заключение
Список использованной литературы
Расчетное задание
Схема организации лечебно-эвакуационного обеспечения
Приложение
Введение
Крупные аварии на химически опасных объектах являются одними из наиболее опасных технологических катастроф, которые могут привести к массовому отравлению и гибели людей и животных, значительному экономическому ущербу и тяжелым экологическим последствиям. Причины аварий, в большинстве случаев, связаны с нарушениями установленных норм и правил при проектировании, строительстве и реконструкции химически опасных объектов, нарушением технологии производства, правил эксплуатации оборудования, машин и механизмов, аппаратов, низкой трудовой и технологической дисциплины производственного процесса. Проблема промышленной безопасности значительно обострилась с появлением крупномасштабных химических производств в первой половине нашего века. Основу химической промышленности составили производства непрерывного цикла, производительность которых не имеет, по существу, естественных ограничений. Постоянный рост производительности обусловлен значительными экономическими преимуществами крупных установок. Как следствие, возрастает содержание опасных веществ в технологических аппаратах, что сопровождается возникновением опасностей катастрофических пожаров, взрывов, токсических выбросов и других разрушительных явлений. Хлор по объему производства и области применения является одним из важнейших продуктов химической промышленности. Широкое использование и большие объемы производства хлора определяют высокую потенциальную опасность возникновения чрезвычайных ситуаций, обусловленных его аварийными выбросами в окружающую среду. Эти обстоятельства усугубляются физико-химическими и токсикологическими свойствами хлора, являющегося сильнодействующим ядовитым веществом удушающего характера. Токсикологические и физико-химические свойства хлора являются основными поражающими факторами при его аварийных выбросах. Широкомасштабное применение хлора и несовершенство используемого основного и вспомогательного технологического оборудования привели к высокому уровню аварийности на предприятиях, использующих хлор. Очевидно, что в сочетании с имеющим место низким уровнем профессиональной подготовки производственного персонала по действиям в аварийных ситуациях это может привести к цепному характеру развития аварии и неконтролируемому возрастанию ее масштабов.
Глава 1. Особенности аварий, связанных с применением хлора в технологических процессах
1.1 Химическая характеристика хлора, специфика его использования в технологических процессах и воздействие хлора на организм человека
Химические свойства хлора. Хлор относится к группе галогенов. Молекулярная масса хлора - 70,9. При нормальных условиях хлор представляет собой газ зеленовато-желтого цвета с резким раздражающим запахом. В сжиженном состоянии хлор может находиться только при избыточном давлении или при температуре ниже минус 34 °С. Хранится и транспортируется жидкий хлор в сосудах, выдерживающих избыточное давление. Давление насыщенных паров хлора в сосуде зависит от температуры и с ее повышением увеличивается. Плотность жидкого хлора при температуре кипения (-34 °С) составляет 1560 кг/м3. При испарении одного объема жидкого хлора при 0 °С образуется 457 объемов газообразного хлора. Газообразный хлор тяжелее воздуха в 2,5 раза, поэтому при аварийных утечках он стелется по низу, создавая устойчивое газовое облако. Плотность хлор-газа при 0 °С и давлении 101,3 кПа равна 3,21 кг/м3.
Хлор растворим в воде: в одном объеме воды растворяется около двух его объемов. Образующийся желтоватый раствор часто называют хлорной водой. Химическая активность его очень велика – он образует соединения почти со всеми химическими элементами.
Хлор является сильным окислителем. Не горюч. Реагирует с большинством органических соединений, в ряде случаев со взрывом. Смесь хлора с водородом под действием света взрывается. Хлор оказывает различное коррозионное воздействие на конструкционные материалы в зависимости оттого, "влажный" он или "сухой". В присутствии влаги протекает обратимая реакция гидролиза хлора с образованием соляной и хлорноватистой кислот:
Сl2 + Н2O « НСl + НСlO
Кроме этой реакции, в определенных условиях протекают одновременно реакции с образованием хлорноватой кислоты (НСlO3), хлоридов железа, водорода и кислорода. Поэтому во "влажном хлоре" (содержание воды > 0,04% масс.) углеродистые и низколегированные стали подвергаются точечной и язвенной коррозии, а в герметичных сосудах (например, в хлорных контейнерах) повышается вероятность образования взрывоопасных смесей водорода с кислородом и хлором. С углеродистыми и низколегированными сталями "сухой хлор" практически не взаимодействует до температуры 100 °С [6].
Особенности использования хлора в промышленности. Под давлением хлор превращается в жидкость, которую широко используют как отбеливатель, в частности в текстильной и бумажной промышленности, начиная с 1795. Хлор – слишком сильный окислитель для отбеливания шелка и шерсти, но эффективен для отбеливания хлопка, льна и древесной массы. Другое важное применение жидкого хлора – для очистки воды – впервые предпринято в 1895 для целей городского водоснабжения Нью-Йорка. Соединения хлора находят разнообразное применение. Хлороформ CHCl3 и хлорэтил C2H5Cl являются анестетиками, трихлорэтаналь (или хлораль) CCl3CHO применяют в медицине как наркотик, тетрахлорид углерода CCl4 используется для тушения огня, для сухой чистки, как и трихлорэтилен С2HCl3. Три хлорпроизводных – фосген COCl2 (удушающий газ), иприт (C2H4Cl)2S – кожнонарывная жидкость, хлорпикрин CCl3NO2 (слезоточивый газ) – являются боевыми отравляющими веществами. Фреон CF2Cl2 используется как хладагент в холодильной технике. Хлор применяют в производстве красок, резин, синтетического каучука, углеводородов, взрывчатых веществ и в химических синтезах. Хлор используют также для отбеливания губок и соломы. Хранят и перевозят хлор в стальных баллонах и железнодорожных цистернах под давлением. При выходе в атмосферу он дымит, заражает водоемы. Лабораторный метод получения хлора заключается в медленном прикапывании концентрированной соляной кислоты HCl через капельную воронку к KMnO4 или MnO2:
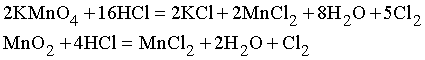
Жидкий хлор был получен М.Фарадеем в 1823 при нагревании гидрата хлора Cl28H2O, помещенного в один конец трубки. В результате конденсации в другом конце трубки, охлаждаемом смесью соли со льдом, собирался жидкий хлор [6]. Основной промышленный метод получения хлора – электролиз концентрированного раствора хлористого натрия. Ежегодное потребление хлора в мире исчисляется десятками миллионов тонн. Хлор, полученный в электролизерах, может содержать крайне опасную примесь - трихлорид азота (NCl3). Последний представляет собой тяжелую маслянистую жидкость с неприятным запахом, напоминающим запах хлора. Плотность NCl3 – 1,65 кг/л; температура кипения 71 °С. Трихлорид азота является взрывчатым веществом, обладающим чрезвычайно высокой чувствительностью к удару, трению и нагреванию. Наличие в хлоре трихлорида азота может послужить причиной хлопков и взрывов трубопроводов, ресиверов, испарителей и тары для хранения и транспортирования жидкого хлора. Хлопки и взрывы на ряде предприятий химической промышленности, цветной металлургии, в хлорном хозяйстве станций водоподготовки сопровождались, как правило, выбросом больших количеств хлора в окружающую среду. Учитывая взрывоопасные свойства трихлорида азота, допускает его содержание в жидком хлоре первого сорта не более 0,004% [6].
Соединения хлора, применяемые в промышленности: Хлороводород (хлорид водорода) HCl в водном растворе был получен И.Глаубером в 1648 при взаимодействии поваренной соли и серной кислоты. Раствор HCl в воде называют хлороводородной или соляной кислотой. Эта кислота встречается в источниках рек Южной Америки, которые вытекают из вулканических районов Анд. Желудочный сок человека содержит 0,2–0,4% соляной кислоты. Хлороводород получают синтезом из Cl2 иH2 под действием света или тепла. HCl образуется также по реакции Cl2 c сероводородом или метаном и другими углеводородами. Наиболее простой способ заключается в постепенном добавлении серной кислоты к хлориду натрия (поваренной соли) при слабом нагревании:
NaCl + H2SO4 = NaHSO4 + HCl.
При использовании твердой соли и более сильном нагревании образуется сульфат натрия:
NaCl + NaHSO4 = Na2SO4 + HCl. HCl
– резко пахнущий бесцветный газ, который можно конденсировать в бесцветную жидкость, кипящую при –83,7 C и затвердевающую при –112 C. Газ в 1,26 тяжелее воздуха, очень хорошо растворим в воде (442 объема на 1 объем воды при 20 С). Концентрированная соляная кислота содержит 37% HCl (плотность 1,19 г/мл). 20,24%-ный раствор HCl имеет температуру кипения 110 С. Соляная кислота широко используется в лабораторной практике, для обработки поверхности металлов перед пайкой, для травления их, в крашении, ситценабивном деле, производстве клея, мыла, глюкозы и др. Смесь 3 объемов концентрированной HCl и 1 объема концентрированной HNO3 известна в лабораторной практике под названием «царская водка»; она растворяет золото и другие благородные металлы [22]. Оксиды. Хлор образует оксиды Cl2O, ClO2 и Cl2O7. Все оксиды хлора нестабильны, могут разлагаться со взрывом, являются сильными окислителями, вызывают возгорание органических соединений, например бумаги, дерева и сахара. Cl2O – желтовато-красный газ – образуется при пропускании Cl2 над оксидом ртути при низкой температуре. При растворении его в воде образуется хлорноватистая кислота HClO. ClO2 – темножелтый газ, в промышленности его получают действием хлора на сухой хлорит натрия NaClO2. ClO2 применяют в отбеливающих порошках, в производстве бумаги и текстиля. Cl2O7 – бесцветная маслянистая жидкость, более стабильна, чем другие оксиды, но при определенных условиях также может взрываться. Cl2O7 получают обезвоживанием HClO4 в присутствии P4O10[22]. Оксокислоты. Хлорноватистая кислота HClO слабая, ее соли гипохлориты являются окислителями и применяются для дезинфекции и для отбеливания. Раствор Дакина, содержащий гипохлорит натрия, применяли для обработки открытых ран во время Первой мировой войны. Хлористую кислоту HClO2 получают по реакции хлорита бария с серной кислотой. Кислота стабильна только в очень разбавленных растворах, а в безводном состоянии не получена. Хлорноватая кислота HClO3 максимальной концентрации 40 % получается при разложении гипохлорита или по реакции хлората бария с разбавленной серной кислотой, при концентрации выше 40% кислота разлагается. Сама кислота и ее соли хлораты – сильные окислители. При нагревании KClO3 (бертоллетова соль) разлагается с выделением кислорода. Поэтому соль используют для изготовления спичек, сигнальных огней и в фейерверках. Хлорную кислоту HClO4 получают осторожной перегонкой смеси ее натриевой соли (перхлората натрия) с концентрированной HCl при пониженном давлении, так как кислота кипит при 16 С (18 мм рт.ст.). Эта реакция взрывоопасна. Чистая хлорная кислота – летучая бесцветная жидкость, является сильнейшим окислителем, в ее концентрированных растворах возгораются бумага и дерево. Cl2O7 является ангидридом этой кислоты, а ее соли (перхлораты) – наиболее устойчивые из солей кислородных кислот хлора. Хлорная кислота находит применение в аналитической химии как окислитель, а смесь перхлората бария и перхлората магния – как осушитель. Перхлораты используют также в производстве спичек и взрывчатых веществ [22].
Воздействие хлора и его производных на человека. Хлор обладает сильным токсическим и раздражающим действием. Оказывает раздражающее воздействие на глаза и органы дыхания. При вдыхании вызывает судорожный, мучительный кашель. В тяжелых случаях происходит спазм голосовых связок, отек легких. Оказывает сковывающее воздействие на центральную нервную систему.
Газообразный хлор раздражающе действует на влажную кожу, вызывая ее покраснение. При попадании на кожу жидкого хлора могут иметь место химические ожоги, обморожения. Предельно-допустимая концентрация хлора в воздухе рабочих помещений 1 мг/м3, в атмосферном воздухе населенных мест максимально разовая - 0,1 мг/ м3, среднесуточная - 0,03 мг/ м3. Минимально ощутимая концентрация хлора – 2 мг/м3. Раздражающее действие возникает при концентрации около – 10 мг/м3. Воздействие в течение 30 – 60 минут 100 – 200 мг/м3 хлора опасно для жизни, а более высокие концентрации могут вызвать мгновенную смерть. Органы дыхания и глаза можно защитить фильтрующими и изолирующими противогазам. Но пребывание в них без дополнительной насадки на фильтрующую коробку – не более 35 мин. Максимально допустимая концентрация при применении фильтрующих противогазов – 2500 мг/м3. Если она выше, то должны использоваться только изолирующие противогазы.[2] Характер действия хлора на организм человека в зависимости от его концентрации в воздухе приведен в табл. 1.1 прил.1.
Похожие работы
... бригад осуществляют дежурство на дому в нерабочее время, а в праздничные и выходные дни - по графику, утвержденному руководителем учреждения-формирователя по согласованию с центром медицины катастроф. В режиме чрезвычайной ситуации общее руководство деятельностью бригад возлагается на руководителя центра медицины катастроф. Сроки выезда (вылета) в район ЧС определяют исходя из местных условий. ...
... В некоторых странах продолжается производство и хранение отравляющих веществ, которые способны даже в малых дозах при попадании в организм животных с кормом, водой, воздухом или через кожный покров вызвать отравление с самыми различными последствиями. Условия чрезвычайных ситуаций могут возникнуть по самым различным причинам, в том числе из-за различных природных катаклизмов и техногенных ...
... на догоспитальном этапе и проводиться доступными средствами. При невозможности приближения ее к очагу поражения, госпитализацию целесообразно осуществлять в одном из ближайших специализированных лечебных учреждений. II. Организация оказания медицинской помощи при авариях на радиационно опасных объектах Ядерные энергетические установки и другие объекты экономики, при авариях иразрушениях ...
... комиссии с участием представителя госнадзора и им выдаются удостоверения. Повышение рабочими уровня знаний по безопасности труда осуществляется на курсах повышения квалификации, ее сдачей экзаменов. 136. Виды инструктажа, регистрация инструктажа. Инструктаж работающих подразделяется на: 1. вводный 2. первичный на рабочем месте 3. повторный 4. внеплановый 5. целевой Все ...
0 комментариев