Навигация
Примеры соединений с водородной связью
1.2 Примеры соединений с водородной связью
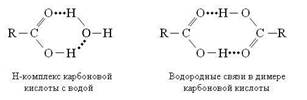
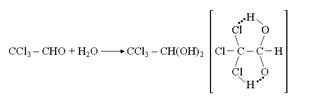
Во многих случаях, когда имеется сильная связь между молекулами или разными группами одной и той же молекулы, эту связь можно приписать атомам водорода, проявляющим двухвалентный характер. Таковы, например, димеры алифатических кислот, ион дифторида![]() и димер HF, структура которых приведена на рисунке 1.1 [6].
и димер HF, структура которых приведена на рисунке 1.1 [6].
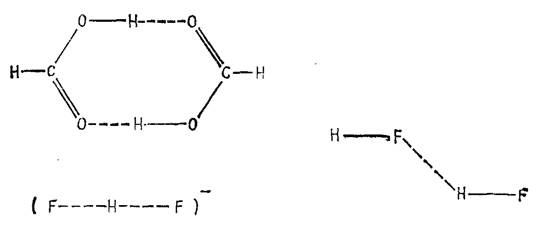
Рисунок 1.1 Некоторые примеры структур с водородной связью
Водород служит в качестве связующего атома в другом важном классе соединений – бороводородах. Простейшим членом этого семейства является диборан (В2Н6). Однако бороводороды обычно не рассматривают в качестве соединений с водородной связью, так как их нельзя разбить на фрагменты, представляющие собой стабильные молекулы [6]. Рассмотрим эти соединения лишь для того, чтобы сопоставить их с комплексами с водородной связью.
Бороводороды были названы электронодефицитными молекулами (термин электронодефицитный в применении к бороводородам не совсем оправдан, так как во всех случаях электронов достаточно для заполнения всех связывающих молекулярных орбиталей), так как они не имеют достаточно электронов для образования того количества двухэлектронных связей, которое, по-видимому, подразумевается их молекулярной геометрией. Диборан имеет восемь связей В–Н, но только четырнадцать валентных электронов. Расчеты на основе метода молекулярных орбиталей показывают, что концевые связи представляют собой нормальные двухэлектронные связи, а мостиковые связи следует описывать как трехцентровые двухэлектронные связи [6].
Описание на основе метода молекулярных орбиталей иона дифторида полностью отличается от описания диборана, поскольку для образования мостиковых связей здесь имеются четыре электрона. Равновесная конфигурация молекулы линейная, причем водород находится посредине отрезка F–F. Две наивысшие заполненные молекулярные орбитали образованы в основном 2pσ -орбиталями фтора п ls-орбиталями водорода с некоторой добавкой 2s-орбиталей фтора. Низшая из двух орбиталей имеет симметрию σg и является связывающей для всех трех атомов. Более высокая орбиталь σu (ее узел приходится на атом водорода) – разрыхляющая по отношению к атомам фтора. Однако атомы фтора достаточно удалены друг от друга, так что разрыхляющий эффект мал, и орбиталь σu имеет отрицательную энергию (т. е. связывает электроны), что обусловлено большой электроотрицательностью атома фтора [6].
Можно преобразовать σg- и σu-орбитали в эквивалентные орбитали θ1 = σg + σu и θ2 = σg – σu, локализованные на двух связях F–Н, что демонстрирует отличие от мостиков в бороводородах, орбитали которых не могут быть локализованы на связях [6].
Ион дифторида не типичен для соединений с водородными связями в том отношении, что атом водорода расположен посредине между двумя тяжелыми атомами. Обычно энергии водородных связей намного меньше, чем для иона дифторида, а водород более тесно связан с одним из атомов, чем с другим, как в димере муравьиной кислоты (рис. 1.1). В действительности геометрия двух компонентов, составляющих комплекс, немного отличается от их геометрии в изолированных состояниях [6].
Таблица 1.1 Энергии димеризации некоторых газофазных димеров с водородной связью [6]
| Димер | Энергия димеризации, кДж/моль-1 |
| (HF)2 | 29±4 |
| (H2O)2 | 22±6 |
| (NH3)2 | 19±2 |
| (HCl)2 | 9±1 |
| (H2S)2 | 7±1 |
Похожие работы
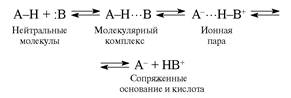
... обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя. Кроме указанных фиксируются и другие структурные и спектроскопические особенности водородных связей, которые используются, с одной стороны, для идентификации последних, а с другой – в расшифровке их электронной природы. Так как водородная связь возникает только в том ...
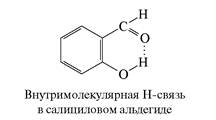
... водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется. Водородные ...
... длин химических связей молекулы растворителя, дипольный момент молекулы растворителя и вязкость, выражается следующим уравнением (2) Коэффициент множественной регрессии составляет КММР = 0,999. В табл. 2 представлены значения энергии водородных связей в различных растворителях, полученные по ур. (1) и (2), в сравнении с литературными данными. Таблица 2 Величины энергии водородных связей ...
... по их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Электролитическая диссоциация. ...
0 комментариев