Навигация
Электроны вращаются вокруг ядра. Число электронов равно числу протонов (атом электронейтрален)
7. Электроны вращаются вокруг ядра. Число электронов равно числу протонов (атом электронейтрален).
Свойства элементарных частиц, образующих атом
Принадлежность атома к какому-либо элементу определяется зарядом его ядра Z, т.е. числом протонов. При этом число нейтронов и, соответственно, массовое число у атомов одного и того же элемента может различаться. Такие атомы называются изотопами.
Изотопами называют атомы с одинаковым зарядом ядра, но имеющие разные массовые числа.
Таким образом, изотопы — это атомы одного элемента, имеющие разную массу.
Каждый изотоп характеризуется двумя величинами: А (проставляется вверху слева от химического знака) и N (проставляется снизу слева от химического знака) и обозначается символом соответствующего элемента. Например: изотоп углерода 126C или словами: «углерод-12» Эта форма записи распространена на элементарные частицы: электронов, нейтрон 10n, протон 11p, нейтрино 00vi. Изотопы известны для всех химических элементов: кислород имеет изотопы с массовыми числами 16, 17, 18: 168О, 178O, 188O. Изотопы аргона: 3618Ar, 3818Ar, 4018Ar; калия: 3919K, 4019K, 4119K.
Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом распространенности их.
Например, средняя атомная масса природного лития, содержащего 92,48% 73Li и 7,52% 63Li, равна 6,94 и т.д.
Атомная масса элементов, приводимых в периодической системе Д. И. Менделеева, есть средние массовые числа природных смесей изотопов.
Наряду с термином «изотопы» используется термин «нуклид».
Нуклид -- атом со строго определенным значением массового числа, т.е. фикзированным значением числа протонов и нейтронов в ядре. Радионуклид -- радиоактивнуй нуклид.
Например, нуклид 16О, радионуклид 14С и т.д. Термин «изотопы» следует применять только для стабильных и радиоактивных нуклидов одного элемента.
Ядерные реакции отличаются от химических, в которых атомы реагирующих веществ вступают в новые комбинации, образуя продукты реакции, но ядра атомов остаются неизменными.
В ядерных реакциях происходит перераспределение протонов и нейтронов в ядрах атомов, и образуются новые элементы.
У некоторых элементов атомы неустойчивы и самопроизвольно распадаются с образованием более легких атомов. Ядро расщепляется, и из его протонов и нейтронов образуется два новых ядра, а электроны исходного атома образуют электронные оболочки двух новых атомов. Иногда распад атома состоит в превращении нейтрона в протон или протона в нейтрон. Такое превращение сопровождается образованием новых частиц, которые покидают атом. Атомы могут также самопроизвольно распадаться на два осколка, или ядро атома может испустить протон. Самопроизвольный распад атома называют радиоактивным распадом. Если все изотопы данного химического элемента радиоактивны, то такой элемент называют радиоактивным. Испускание частиц и выделение энергии — это признаки радиоактивности.
Распад радиоактивных веществ сопровождается испусканием излучения, которое получило название a- (альфа),)b- (бета) или g- (гамма) излучения. Каждое из них ионизирует атомы вещества, через которое оно проходит, а a-излучение, кроме того, способно вызывать свечение сульфида цинка. Их проникающая способность различна: например, g-излучение способно пройти слой воздуха в несколько десятков метров, b-излучение — на порядок меньше, а a-излучение — всего несколько сантиметров.
К основным видам радиоактивного распада относятся a-распад, b-распад, спонтанное деление атомных ядер и протонный распад. Часто эти виды радиоактивного распада сопровождаются испусканием g-лучей, т.е. жесткого (с малой длиной волы) электромагнитного излучения.
При a-распаде ядро атома испускает два протона и два нейтрона, связанные в ядро атома гелия 42Не; это приводит к уменьшению заряда исходного радиоактивного ядра на 2, а его массового числа на 4. Таким образом, в результате a-распада образуется атом элемента, смещенного на два места от исходного радиоактивного элемента к началу периодической системы.
Возможность b-распада связана с тем, что по современным представлениям протон и нейтрон представляют собой два состояния одной и той же элементарной частицы — нуклона (от лат. nucleus — ядро). При известных условиях (например, когда избыток нейтронов в ядре приводит к его неустойчивости) нейтрон может превращаться в протон, одновременно «рождая» электрон:
нейтрон ® протон + электрон или n ®р+ е-
Таким образом, при b-распаде один из нейтронов, входящих в состав ядра, превращается в протон; возникающий при этом электрон вылетает из ядра, положительный заряд которого на единицу возрастает.
Возможно также превращение протона в нейтрон: протон ® нейтрон + позитрон или p® n + n+, где n+ — позитрон — элементарная частица с массой, равной массе электрона, но несущая положительный электрический заряд; по абсолютной величине заряды электрона и позитрона одинаковы. Процесс превращения протона в нейтрон с образованием позитрона может происходить в тех соединениях, когда неустойчивость ядра вызвана избыточным содержанием в нем протонов. При этом один из протонов, входящих в состав ядра, превращается в нейтрон, возникающий позитрон вылетает за пределы ядра, а заряд ядра на единицу уменьшается. Такой вид радиоактивного распада называется позитронным b-распадом (или b+-распадом) в отличие от ранее рассмотренного электронного b-распада (b--распада). Этот вид радиоактивного распада наблюдается у некоторых искусственно полученных радиоактивных изотопов.
Изменение заряда ядра при b-распаде приводит к тому, что в результате b-распада образуется атом элемента, смещенного на одно место от исходного радиоактивного элемента к концу периодической системы (в случае b--распада) или к ее началу (в случае b+-распада).
К уменьшению заряда ядра на единицу приводит не только b+-распад, но и электронный, захват, при котором один из электронов атомной электронной оболочки захватывается ядром; взаимодействие этого электрона с одним из содержащихся в ядре протонов приводит к образованию нейтрона:
Электрон чаще всего захватывается из ближайшего к ядру К-слоя (.К-захват), реже из L или М-слоев.
Спонтанным делением называется самопроизвольный распад ядер тяжелых элементов на два (иногда на три или четыре) ядра элементов середины периодической системы. Варианты такого деления очень разнообразны, так что общих правил смещения по периодической системе не существует; чаще всего происходит распад исходного ядра на тяжелый и легкий осколки, несущие, соответственно, около 60 и 40% заряда и массы исходного ядра. Относительное содержание нейтронов в ядрах тяжелых элементов выше, чем для ядер устойчивых изотопов середины периодической системы, поэтому при спонтанном делении распадающееся ядро испускает 2-4 нейтрона; образующиеся ядра все еще содержат избыток нейтронов, оказываются неустойчивыми и поэтому претерпевают ряд b--распадов.
Протонный распад представляет собой самопроизвольный распад ядер с дефицитом нейтронов, сопровождающийся испусканием одного или одновременно двух протонов. Образующееся ядро имеет заряд и массовое число меньше исходного на единицу в случае испускания одного протона и двух единиц при испускании двух протонов.
Элементы, расположенные в конце периодической системы (после висмута), не имеют стабильных изотопов. Подвергаясь радиоактивному распаду, они превращаются в другие элементы. Если вновь образовавшийся элемент радиоактивен, он тоже распадается, превращаясь в третий элемент, и так далее до тех пор, пока не получаются атомы устойчивого изотопа.
Ряд элементов, образующихся подобным образом один из другого, называют радиоактивным рядом.
Например, ряд урана:
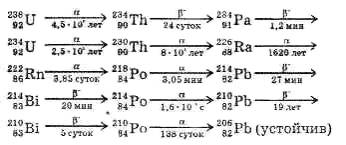
Изотопы
ИЗОТОПЫ — разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название "изотопы" было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos — одинаковый и topos — место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов (см.также АТОМА ЯДРО). Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы "снаружи", но различны "внутри".
В 1932 был открыт нейтрон — частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода — протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы — это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов , где X — символ химического элемента, Z — заряд ядра атома (число протонов), А — массовое число изотопа (общее число нуклонов — протонов и нейтронов в ядре, A = Z + N). Поскольку заряд ядра оказывается однозначно связанным с символом химического элемента, часто для сокращения используется просто обозначение AX.
Переход электронов между электронными состояниями как основные атомные процессы(возбуждение и ионизация)
Модель атома сама по себе нейтральна.
ИОНИЗАЦИЯ -образование положит. и отрицат. ионов и свободных эл-нов из электрически нейтральных атомов и молекул.
ВОЗБУЖДЕНИЕ АТОМА И МОЛЕКУЛЫ - квантовый переход атома или молекулы с более низкого (напр., основного) уровня энергии на более высокий при поглощении ими фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами (возбуждение ударом).
Согласно принципам квантовой механики, атомы и молекулы устойчивы лишь в нек-рых стационарных состояниях, к-рым отвечают определ. значения энергии. Состояние с наинизшей энергией наз. основным, остальные -возбужденными. Изменение энергии атома при переходе из одного стационарного состояния в другое связано с изменением строения его электронной оболочки
Заключение
Характер любой системы, как известно, зависит не только от ее строения и состава ее элементов, но и от их взаимодействия. Именно такое взаимодействие определяет специфические, целостные свойства самой системы. Поэтому при исследовании разнообразных веществ и их реакционной способности ученым приходится заниматься и изучением их структур. Соответственно уровню достигнутых знаний менялись и представления о химической структуре веществ.
В данном реферате доказаны следующие задачи
- рассмотрены методы и концепции познания в химии;
- дано понятие состава вещества и химических систем;
- проанализировано изучение структуры веществ в рамках химической системы.
Рассмотрев таблицу Менделеева, выяснили, что Периодическая система является графическим выражением периодического закона.
Список литературы
1. Грушевская Т.Г. , Садохин П.П. Концепции современного естествознания: Учеб. Пособие: Высшая школа., М.: 1998
2. Линдер Г. Картины современной физики. Пер. с нем. Ю.Г.Рудого. Предисл. Н.В.Мицкевича. - М.: Мир, 1977. - 272 с. с ил.
3. Мигдал А.Б. Квантовая физика для больших и маленьких. - М.: Наука, 1989. - 144 с.
4. Эйнштейн А., Инфельд Л. Эволюция физики. - М.: Наука, 1965. - 328 с. с ил.
Похожие работы
... (на территориях по месту жительства, учебы), т.е. своей местности в рамках так называемой «малой родины». Поэтому в данном исследовании, во главу угла экологического обучения и воспитания в системе школьного географического образования положен краеведческий принцип, то есть всестороннее комплексное изучение «малой родины» 47, 49. В целом региональная направленность образования ...
... долей) исходных веществ. ► Стехиометрия – раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Законы стехиометрии так же непреложны, как и любые другие естественнонаучные законы; кроме того, их знание очень полезно для прикладной химии, потому что позволяет количественно рассчитать выход химической реакции и необходимое количество исходных ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
... для себя новую природу. 20. Самоорганизация систем. Синергетика Концепция самоорганизации систем все больше распространяется не только в естествознании, но и в социально-гуманитарных науках. Поэтому концепция самоорганизации становиться парадигмой исследования широкого класса систем. (Под парадигмой подразумевают фундаментальную теорию, которую применяют для объяснения широкого спектра ...
0 комментариев