Навигация
Приготовление исходной и посевной культуры
5.3 Приготовление исходной и посевной культуры
Посевной материал на каждой из стадии его получения (от пробирок до посевного аппарата) выращивают в строго асептических условиях по 24 ч. Состав питательных сред незначительно меняется при переходе от одного штамма к другому и практически остается постоянным на каждой из промежуточных стадий получения посевного материала. Только при выращивании продуцента в посевном аппарате в питательную среду вносят до 0,1% стерильного синтетического пеногаситсля.
Накопление биомассы до 6–8 г. АСВ на 1 л среды производят в аэробных условиях сначала в инокуляторах объемом 2 м3, потом в посевных аппаратах объемом 5 м. Полученный посевной материал в количестве 5–6% (от объема среды производственных аппаратов) стерильно передают в основные ферментаторы на 50 м3. Коэффициент заполнения аппарата 0,7. [2]
5.4 Выращивание продуцента в ферментаторе
Процесс биосинтеза осуществляют в строго асептических условиях в ферментаторах объемом 50 м3 с коэффициентом заполнения аппарата 0,7 в течение 48–52 ч и интенсивной аэрации [80–85 мг Ог/(л-мин)], что соответствует расходу 1 объема воздуха на 1 объем среды в 1 мин. Температуру культивирования на всех стадиях поддерживают постоянной на уровне 28–30°С. В конце процесса биосинтеза готовая культуральная жидкость содержит до 45 г./л глутаминовой кислоты. Выход глутаминовой кислоты по отношению к потребленным сахарам составляет 45–50%.
Поскольку производство глутаминовой кислоты направлено на получение высокоочищенных препаратов, последующая технологическая схема предусматривает производство продуктов, подготовленных непосредственно к применению в качестве пищевых добавок и в виде лекарственных форм.
Выделение глутаминовой кислоты из культуральной жидкости и последующая очистка ее в соответствии с требованиями фармакопеи
предполагает такую последовательность проведения технологических операций. [2]
5.5 Предварительная обработка культуральной жидкости
Осуществляется в результате добавления к ней определенного количества негашеной извести (или известкового молока) с последующим осаждением избытка ионов кальция фосфорной кислотой. Образующийся при этом осадок способствует лучшему отделению клеток продуцента и других балластных примесей. [2]
5.6 Отделение биомассы от культуральной жидкостиПроводят центрифугированием или фильтрованием под давлением. [2]
5.7 Осветление фильтрата
Состоит в очистке его от пигментных примесей, окрашивающих нативный раствор в темный цвет. Для этого обрабатывают фильтрат активированным углем или подвергают его ионообменной сорбции на анионите ИА-1. [2]
5.8 Концентрирование осветленного раствора глутаминовой кислоты
Проводят путем его вакуум-выпаривания при температуре 40–60 °С, при этом из исходного раствора глутаминовой кислоты отгоняют от 50 до 80% воды. [2]
5.9 Осаждение кристаллов глутаминовой кислоты в изоэлектрической точке
Эта стадия осуществляется путем подкисления полученного на предыдущем этапе концентрата соляной кислотой до рН 3,2 (изоэлектрическая точка глутаминовой кислоты) и охлаждения раствора до 4–15°С. Однократное проведение операции обеспечивает кристаллизацию 77% глутаминовой кислоты; при повторном ее проведении выход возрастает до 87%. Чистота получаемых кристаллов достигает 88%.
В результате последующей перекристаллизации чистоту получаемых кристаллов можно увеличить до 99,6%, что удовлетворяет требованиям фармакопеи. [2]
5.10 Отделение кристаллов глутаминовой кислоты от маточника
Это достигается центрифугированием с последующей декантацией и возвратом маточника на стадию вакуум-выпаривания. Полученные кристаллы промывают обессоленной водой и направляют на сушку. [2]
5.11 Сушка кристаллов глутаминовой кислоты
Проводится в вакууме или в токе нагретого воздуха при 60-70°С. [2]
5.12 Получение глутамата натрия
Для получения глутамата натрия влажные кристаллы с содержанием 98–99% глутаминовой кислоты по сухой массе растворяют и нейтрализуют 45–50%-ным раствором NaOH до рН 6,8. Этот раствор концентрируют, и при охлаждении выпадают кристаллы глутамата натрия, которые высушивают. Готовый препарат состоит на 98% из глутамата натрия. Выход готового продукта по глутаминовой кислоте по отношению к ее содержанию в исходной культуральной жидкости составляет 75–80%, максимально достигнутый выход не превышает 90%. [2]
6. Отходы производства и охрана окружающей среды
При производстве L-глутаминовой кислоты, в окружающую среду в составе конденсата и выбросов из ферментера попадают: бутиловый спирт, метилбутиловый кетон, фенол, крезол, пиридин, циклогексиламин, изомасляная кислота, пропионовая кислота и другие вещества.
Технологические стоки и промывные воды, включающие клетки продуцента, аминокислоты и другие компоненты культуральной жидкости, а также следовые количества глутаминовой кислоты, объединяют, упаривают и сушат с наполнителем до остаточной влажности 10%. Получают препарат, который используют как кормовой продукт, он содержит до 40% белковых веществ. [3]
7. Контроль производства
На биосинтез глутаминовой кислоты существенное влияние оказывают степень аэрации среды, перемешивание, рН среды, длительность и температура ферментации, возраст и доза посевного материала. Поэтому на всех стадиях процесса все параметры культивирования строго регламентируются и контролируются (температура, рН, изменение основных компонентов среды, накопление глутаминовой кислоты, аэрация, перемешивание и т.д.).
Уровень рН среды – это очень ответственный параметр процесса. Как известно, продуцентами являются бактериальные штаммы, и потому в большинстве случаев оптимум рН для культивирования лежит в области, близкой к нейтральной или слабощелочной. Для штаммов, используемых в нашей стране, наилучшие результаты по биосинтезу глутаминовой кислоты получаются, если рН среды поддерживается около 7–7,2. Для всех известных продуцентов глутаминовой кислоты рН, обеспечивающей максимальное накопление глутаминовой кислоты и рост культуры, лежит в пределах от 6 до 8,5. [3]
Снабжение растущей культуры кислородом является ответственным и важным фактором, влияющим на рост микроорганизма и образование им лизина. Кислород, используемый бактериальной клеткой, должен быть растворен в питательной среде. Для увеличения растворимости кислорода осуществляют барботирование среды воздухом с одновременным ее перемешиванием.
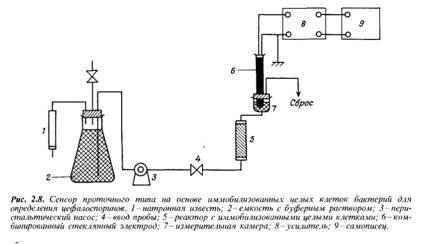
Контроль за ходом процесса биосинтеза осуществляют на разных этапах его проведения по оптической плотности раствора культуральной жидкости (по содержанию клеток продуцента), по содержанию субстрата в смеси или по сигналам датчиков рН и растворенного кислорода в ферментационной среде. К концу процесса биосинтеза содержание глутаминовой кислоты в культуральной жидкости достигает не менее 45 г./л, концентрация оставшегося субстрата не более 0,5–1,0%. [1]
Похожие работы
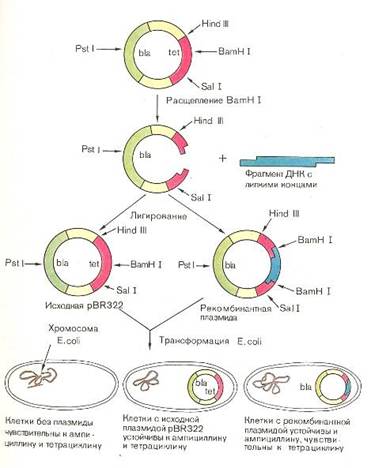
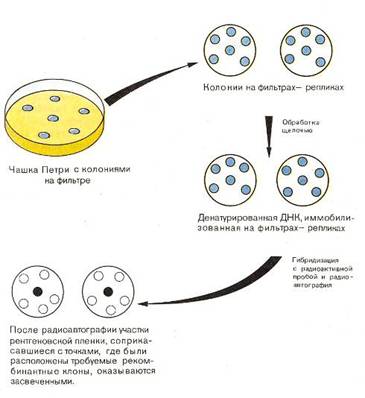
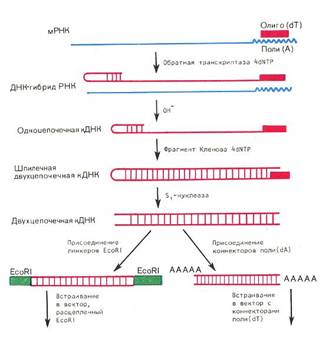
... частью содержится в цитоплазме клеток. Содержание РНК, как правило, в 5-10 раз больше, чем ДНК. Соотношение РНК/ДНК в клетках тем выше, чем интенсивнее в них синтез белка. Нуклеиновые кислоты обладают сильно выраженными кислотными свойствами и при физиологических значениях рН несут высокий отрицательный заряд. В связи с этим в клетках организмов они легко взаимодействуют с различными катионами и ...
... оценивали также БПК необработанных промышленных сточных вод различных типов. Найдено, что сигнал сенсора определяется соединениями, присутствующими в сточных водах. 2. Основные биосенсоры на основе растительных и животных тканей Тканевые материалы растительного и животного происхождения успешно используют в качестве биокаталитических компонентов биосенсоров. Биокаталитические материалы ...
... уксусная кислота и этанол. Практическое значение дыхания: 1. При дыхании дрожжи потребляет меньше субстрата, но при этом образуется больше биомассы. 2. Процесс дыхания выгоден и используется в основном для дрожжевого производства. Синтез углеводов в клетке ТРЕГАЛОЗА Местонахождение трегалозы: она располагается в цитоплазме, частично связанна с клеточной стенкой. В ...
... инженерию. Необходимо отметить, что если базовый стандарт по химии не предусматривает изучение вопросов биотехнологии, то таковой по биологии содержит наиболее общие её аспекты: достижения генной инженерии и перспективы биотехнологии. 2.2 Межпредметные связи по изучению аспектов биотехнологии в средней школе По программе Р.Г. Ивановой и Л.А. Цветкова в 10 классе предусмотрено изучение темы ...



0 комментариев