Навигация
Эмбриональные стволовые клетки
3. Эмбриональные стволовые клетки
Эмбриональные стволовые клетки (ЭСК) образуются из внутренней клеточной массы на ранней стадии развития зародыша – бластоциста. Зародыш человека достигает стадии бластоциста на стадии 4–5 дней после оплодотворения, бластоцист человека состоит из 50–150 клеток.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Таким образом образуются более 220 видов клеток. Свойство плюрипотентности отличает эмбриональные стволовые клетки от полипотентных клеток, которые могут дать начало лишь ограниченному количеству видов клеток. В отсутствие стимулов к дифференциации in vitro, эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность образования плюрипотентных клеток из фибробластов взрослого человека.
Ввиду пластичности и потенциально неограниченного потенциала самообновления, эмбриональные стволовые клетки имеют перспективы применения в регенеративной медицине и замещении поврежденных тканей. Однако в настоящий момент не существует никакого медицинского применения эмбриональных стволовых клеток. Стволовые клетки взрослых организмов и стволовые клетки спинного мозга используются для терапии различных заболеваний. Некоторые заболевания крови и иммунной системы (в том числе генетические) могут быть вылечены такими неэмбриональными стволовыми клетками. Разрабатываются методы лечения с помощью стволовых клеток таких патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота и нарушения работы спинного мозга
Существуют как этические, так и технические затруднения, связанные с трансплантацией гематопоэтических стволовых клеток. Эти проблемы связаны, в том числе, с гистосовместимостью. Такие проблемы могут быть разрешены при использовании собственных стволовых клеток или путем терапевтического клонирования.
Тотипотентность – способность образовывать любую из примерно 350 типов клеток организма (у млекопитающих).
Хоуминг – способность стволовых клеток, при введении их в организм, находить зону повреждения и фиксироваться там, исполняя утраченную функцию.
Факторы, которые определяют уникальность стволовых клеток, находятся не в ядре, а в цитоплазме. Это избыток мРНК всех 3 тысяч генов, которые отвечают за раннее развитие зародыша.
В настоящее время линии плюрипотентных клеток человека получают из двух источников с помощью методов, отработанных на животных моделях:
а) Плюрипотентные клетки выделяют непосредственно из внутренней клеточной массы эмбриона человека на стадии бластоцисты. Сам эмбриональный материал получали в больших количествах в клинических, а не исследовательских целях для осуществления экстракорпорального оплодотворения, всякий раз испрашивая разрешение на его использование у обоих доноров. Клетки внутренней клеточной массы культивировали и получали линию плюрипотентных клеток.
б) Другая группа исследователей выделяла плюрипотентные клетки из ткани плода. Разрешение на это давалось обоими супругами уже после того, как они сами приняли решение прервать беременность. Клетки отбирались из той области плода, которая должна была развиться в яичники или семенники.
Несмотря на то что плюрипотентные клетки в двух указанных случаях происходили из разных источников, полученные клеточные линии были идентичными.
Еще одним способом получения плюрипотентных клеток может стать метод, основанный на переносе в энуклеированную (лишенную ядра) яйцеклетку ядра соматической клетки. Соответствующие опыты уже проведены на животных. Сама яйцеклетка с новым ядром и ее непосредственные «потомки» способны при соответствующих условиях развиться в полноценный организм, то есть являются титопотентными. Из них формируется бластоциста, которая и служит источником плюрипотентных клеток.
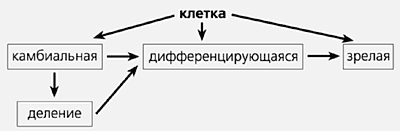
Изолированные плюрипотентные клетки человека – очень ценный материал для исследователей и клиницистов. Эксперименты с их использованием могут помочь разобраться в сложнейших процессах развития человеческого организма, и прежде всего в том, что именно влияет на принятие клеткой решения о переходе от стадии роста и деления к стадии дифференцировки. Известно, что ключевым моментом здесь является «включение» и «выключение» специфических генов, но мы мало что знаем и о самих этих генах, и о том, какие события предшествуют их переключению. Разобравшись в функционировании клетки в норме, мы сумеем понять, какие сбои в ее работе приводят к фатальным для организма последствиям.
Выделение плюрипотентных клеток человека открывает новые возможности перед исследователями, занимающимися поисками новых лекарственных веществ и их тестированием. Разнообразные клеточные линии (например, линии раковых клеток) используются в этих целях уже сейчас, а культура плюрипотентных клеток позволяет проводить тестирование сразу на нескольких типах клеток. Это не заменяет тестирование на уровне целого организма, но значительно облегчает поиск новых лекарственных веществ.
Одно из самых впечатляющих применений плюрипотентных клеток человека – это так называемая «клеточная терапия». Многие заболевания человека обусловливаются нарушением функционирования клеток или целых органов, и сегодня для устранения дефекта в таких случаях используется метод трансплантации. К сожалению, нередко повреждения носят множественный характер, и заменить все затронутые ими органы не представляется возможным. Плюрипотентные клетки, стимулированные к дифференцировке с образованием строго специализированных клеток, могут служить возобновляемым источником не затронутых поражением клеток, замещающих выбывшие из строя дефектные клетки. Это открывает широкие возможности для лечения самых разных заболеваний человека, включая такие серьезные, как болезнь Паркинсона, болезнь Альцгеймера, сердечнососудистые заболевания, ревматоидный артрит, диабет и другие.
Несмотря на всю перспективность описанного подхода, пройдет еще немало времени, прежде чем его удастся применить в клинике. Во-первых, необходимо выяснить, какие события предшествуют переходу клетки в организме человека к стадии дифференцировки; только тогда мы сможем направленно изменять ход событий, чтобы получить из плюрипотентных клеток именно те, которые нужны для трансплантации. Во-вторых, прежде чем вводить культивированные клетки в организм человека, следует решить проблему иммунологического отторжения. Поскольку плюрипотентные клетки, взятые из бластоцисты или ткани плода, вряд ли будут идентичны клеткам реципиента, необходимо научиться модифицировать их для минимизации этого различия или создать банк тканей.
В некоторых случаях проблему несовместимости удается решить, используя метод переноса ядра соматической клетки. Предположим, что пациент страдает прогрессирующей сердечной недостаточностью. Если взять у него любую соматическую клетку и ввести ее ядро в энуклеированную яйцеклетку-реципиент, мы получим химерную яйцеклетку, у которой практически весь генетический материал идентичен таковому у пациента. Из нее можно получить бластоцисту, а затем, отобрав клетки внутренней клеточной массы, – плюрипотентные клетки. Последние можно стимулировать к образованию клеток сердечной мышцы, идентичных в генетическом отношении нормальным клеткам пациента, и имплантировать их больному без необходимости подвергать подвергать его иммуносупрессорной терапии, чреватой серьезными последствиями.
Еще более впечатляющее применение стволовых клеток человека – генная терапия ex vivo. В этом случае в организм больного можно инфузировать не обычные стволовые клетки, а генетически модифицированные, которые замещают дефектные клетки или восполняют недостаток продукта того гена, который включен в геном инфузируемых клеток. Стволовые клетки можно получать от самого пациента или от совместимых с ним доноров. Следует отметить, однако, что генная терапия ex vivo с применением стволовых клеток человека делает лишь первые шаги. Гораздо более реальным является использование модифицированных эмбриональных стволовых клеток для создания трансгенных животных. Соответствующие эксперименты уже широко проводятся на мышах. Сначала получают эмбриональные стволовые клетки из внутренней клеточной массы бластоцисты мыши. Их генетически модифицируют (трансформируют) с помощью вектора, несущего нужный ген (трансген), культивируют и отбирают тем или иным способом. Популяцию трансфицированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку «суррогатной» матери. Скрещивая животных, несущих трансген в клетках зародышевой линии мыши, получают линию трансгенных мышей. В геном стволовой клетки можно не только встроить полезный ген, кодирующий какой-либо необходимый организму продукт, но и направленным образом вывести из строя («нокаутировать») ген, кодирующий, например, какой-нибудь токсин. Трансгенных мышей с нарушениями в определенном гене широко используют в качестве модели для изучения заболеваний человека на молекулярном уровне [2].
Похожие работы
... сердца, кожи, печени, почек и т.д. будут использоваться для проверки медикаментов на токсичность еще до клинических испытаний на взрослых людях. Однако главная область приложения стволовых клеток – это биомедицина. Стволовые клетки, если ими удастся манипулировать именно так, как хотелось бы современным ученым, расширят само определение медицины, обозначив переход от профилактики или сдерживания ...
... , что предотвратит реакцию иммунологической несовместимости тканей. Группа американских ученых под руководством Е.Мизей показала, что стволовые клетки, куда бы их ни имплантировали, способны достигать поврежденного места, в частности мозга, и обеспечивать там восстановительные процессы. Так, после внутривенного введения взрослым мышам стромальных стволовых клеток во многих областях мозга ( ...
... начала специализироваться), то количество делений, которое она может пройти, ограничено. Так, например, для фибробласта лимит делений составляет 50 делений, для стволовой клетки крови – 100. Применение клеточных технологий в клинике Клеточная терапия – не открытие конца 1990-х годов, но именно в это время появились научные работы, дающие новые широкие возможности ее применения и началось бурное ...
... .html 3. Что такое стволовые клетки? Источник http://www.stvolkletki.ru/whatis/ 4. Лицензированные Росздравнадзором организации Источник http://stem-cells.ru/index.html 5. Стволовые клетки Материалы предоставлены проектом Рубрикон. 6. Плоды просвещения. "Кровь жизни" Документальный фильм (Великобритания, 2001). 7. Плоды просвещения. "Регенерация" ...
0 комментариев