Навигация
Загальна характеристика обертової структури електронно-коливних смуг
3. Загальна характеристика обертової структури електронно-коливних смуг
Обертова структура електронно-коливних смуг визначається зміною обертової енергії при відповідному переході DЕоберт = DЕ¢оберт + DЕ²оберт. Для обертових рівнів верхнього електронно-коливного стану маємо: DЕ¢оберт = ![]() hy¢(y¢ + 1) і для обертових рівнів нижнього електронно-коливного стану маємо аналогічно: DЕ²оберт =
hy¢(y¢ + 1) і для обертових рівнів нижнього електронно-коливного стану маємо аналогічно: DЕ²оберт = ![]() hy²(y² + 1). Таким чином, без врахування поправок на центробіжне розтягування молекули одержимо: DЕоберт = =
hy²(y² + 1). Таким чином, без врахування поправок на центробіжне розтягування молекули одержимо: DЕоберт = = ![]() hy¢(y¢ + 1) –
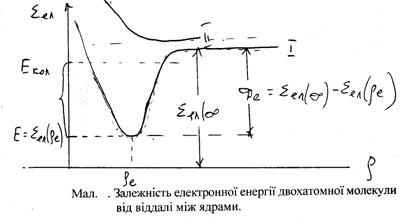
hy¢(y¢ + 1) – ![]() hy²(y² + 1). Обертові постійні для верхнього і нижнього стану різні і лише в деяких випадках приблизно співпадають. Їх основна відмінність визначається зміною рівноважної віддалі rе між ядрами при переході молекули з одного електронного стану в інший. Як уже вказувалося, при електронному збудженні молекули Еел збільшується; це приводить до збільшення моменту інерції і до зменшення обертової постійної. Тому В¢ < В².
hy²(y² + 1). Обертові постійні для верхнього і нижнього стану різні і лише в деяких випадках приблизно співпадають. Їх основна відмінність визначається зміною рівноважної віддалі rе між ядрами при переході молекули з одного електронного стану в інший. Як уже вказувалося, при електронному збудженні молекули Еел збільшується; це приводить до збільшення моменту інерції і до зменшення обертової постійної. Тому В¢ < В².
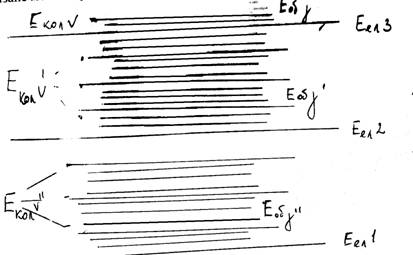
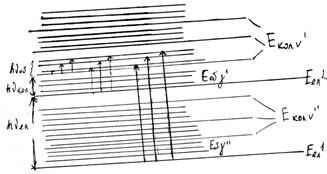
При електронних переходах в загальному випадку для обертового квантового числа у має місце звичайне правило відбору для моментів кількості руху: Dу = 0; ±1. Для зміни обертової енергії при електронно-коливних переходах можна використати всі формули, виведені для зміни обертової енергії при чисто коливних переходах. Ми маємо R-, P- і Q-гілки:
nR = n0 + 2B¢v + (3B¢v – B²v) j + (3B¢v – B²v) j2;
nP = n0 – (2B¢v + B²v) j + (B¢v – B²v) j2;
nQ = n0 + (B¢v – B²v) j + (B¢v – B²v) j2.
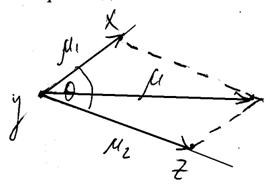
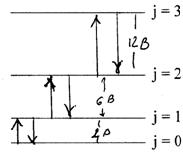
Відповідні R-, P- і Q-переходи показані на малюнку .
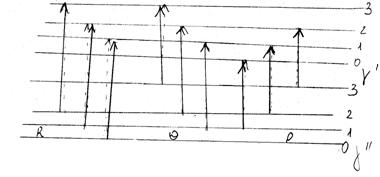
Мал. . R-, P- і Q-гілки обертових переходів в електронно-коливних спектрах Dj = +1(R);
Dj = +1(R); Dj = 1(Q); Dj = –1(P).
Якщо ввести к формули ціле число m, де
m = j¢ для R-гілки m = 1, 2, 3..,
m = –j² для P-гілки m = –1, –2, –3..,
m = j¢ = j² для Q-гілки m = 1, 2, 3..,
то формули приймуть вигляд:
R- і P-гілки: DЕ = n0 + (В¢ + В²) m + (В¢ – В²) m2;
Q-гілка: DЕ = n0 + (В¢ – В²) m (m + 1).
Тут n0 – частота електронно-коливного переходу, що відповідає m = 0.
4. Правила відбору і типи електронних переходівОсновні типи електронних переходів в двохатомних молекулах визначаються правилами відбору, як загальними, так і більш окремими. Перш за все, для повного моменту кількості руху молекули справедливе загальне правило відбору Dj = 0, ±1 (з додатково забороненим переходом j¢ = 0 ® j² = 0.
У відповідності з поділом станів молекули на додатні і від’ємні є правило відбору, що дозволяє переходи між станами одинакової симетрії + « –. Для молекул, що мають центр симетрії, парні електронні стани комбінують з непарними g « u. Важливою характеристикою електронних станів молекули є квантове число L, що визначає величину проекції орбітального моменту кількості руху на вісь молекули і рівне абсолютному значенню цієї проекції. Для L має місце правило відбору: DL = 0, ±1. Таким чином, можливі переходи S–S, S–P, P–P, P–D, D–D. Ці переходи можна розділити на три типи:
1 тип – переходи S–S, DL = 0, L = 0;
2 тип – переходи S–P, P–D, DL = 1;
3 тип – переходи P–P, D–D, DL = 0 і DL ¹ 0.
Відмітимо, що при позначенні електронних переходів спочатку записують символ верхнього стану, а потім нижнього і, відповідно, перехід записується L¢–L². Наприклад, S–P означає перехід між верхнім станом S і нижнім P-станом.
Для переходів першого типу є додаткове обмеження, зв’язане з тим, що S-стани можуть бути додатніми (S+) і від’ємними (S–). Дозволені переходи лише між S-станами одної симетрії: S+–S+; S––S–.
Переходи трьох типів відрізняються своєю обертовою структурою. Для переходів першого типу S–S є додаткове правило відбору, яке забороняє Q-гілку і виникають тільки R- і Р-гілки. Для переходів другого типу, зокрема S–P і P–S проявляються всі три гілки R, P і Q. Для переходів третього типу, зокрема P–P, також можливі всі три гілки, але в Q-гілці інтенсивність різко зменшується із збільшенням квантового числа і ця гілка слаба.
При участі спіна одержується подальша класифікація типів електронних переходів. Як і для атомів, є наближене правило відбору для повного спінового механічного моменту S, DS = 0. Найбільш простою є обертова структура переходів 1S±– 1S±. Для них одержуються R- і Р-гілки (Q-гілка відсутня).
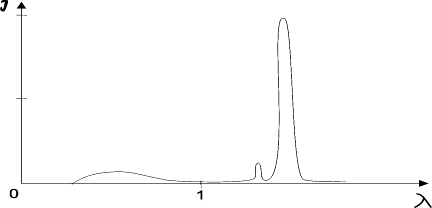
Суцільні спектри поглинання і випромінювання двохатомної молекули. Поряд з дискретними спектрами для лінійних молекул можуть виникати і суцільні спектри. Вони утворюються при переходах між двома станами, по крайній мірі один з яких відповідає неперервній послідовності значень енергії.
Суцільні спектри можуть одержуватися при переходах між дискретними нижніми рівнями і неперервними верхніми рівнями, між неперервними нижніми і дискретними верхніми. Суцільні спектри також будуть виникати при переходах між неперервними нижніми і неперервними верхніми рівнями. Розподіл інтенсивностей у суцільних спектрах, як і в дискретних, буде визначатися принципом Франка-Кондона, тобто найбільш імовірними будуть переходи, які зображаються вертикальними лініями, що з’єднують потенціальні криві комбінуючих рівнів. Правила відбору в цьому випадку такі, як і для переходів між різними електронними станами.
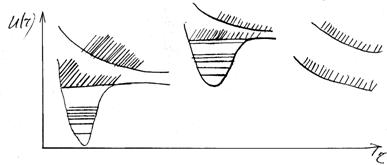
Мал. Схема утворення неперервних спектрів для стійких і нестійких спінів.
Визначення з досліду положення nгран. – межі сходження смуги, тобто межі дисоціації має суттєве значення. По положенню цієї межі можна визначити з досить високою точністю енергію дисоціації. Якщо через n0 позначити енергію електронного збудження і через D¢ – енергію дисоціації збудженого електронного стану, то nгран = n0 + D¢ і знаючи n0 можна знайти D¢.
Похожие работы
... для систем, частинок з антисиметричними хвильовими функціями, тобто до ферміонів. 2.2.3. Розподіл електронів за станами. Періодична система елементів. Сукупність електронів, які перебувають у всіх можливих станах з однаковим значенням головного квантового числа n, утворює електронну оболонку (електронний шар). Енергетичні шари прийнято позначати великими латинськими літерами відповідно до ...
... · NA, де r – питома вага речовини; М – молярна маса речовини = . Якщо врахувати орієнтаційний дипольний момент молекул у зовнішньому електричному полі, то рівняння Клаузиуса-Масотті набуває вигляду = . Це рівняння називають рівнянням Дебая. Поведінка речовин у змінному електричному полі. Рефракція. При дії на молекули діелектрика змінного поля поляризація залежить від зміни поля. ...
... дозволяє отримати грубу модель структури або субструктури [ 3,4 ]. Розділ 4. Техніка експерименту і характеристика методів проведення дослідження 4.1 Синтез твердих розчинів LnBa2Cu3O7 та LnxLa1-xBa2Cu3O7 (де Ln = Gd, Ho) Зразки полікристалічних розчинів LnBa2Cu3O7 (де Ln = Gd, Ho) були синтезовані твердо-фазним методом. Як вихідні речовини використовувались купрум (II) оксид CuO, барій ...
... в основному легкий. Наприклад, у зв’язку С–Н маса атома С у 12 раз більше маси атома Н, тому атом С залишається практично у спокої, а коливається Н. Електронні спектри молекул До основних характеристик кожного електронного стану молекули відносяться енергія, хвильова функція, степінь виродження, мультиплетність і час життя. Енергія молекули в заданому стані є функцією ядерної конфігурації, ...



0 комментариев