Навигация
Физико-химические свойства системы, положенной в основу химико-технологического процесса окисления сернистого ангидрида
4. Физико-химические свойства системы, положенной в основу химико-технологического процесса окисления сернистого ангидрида.
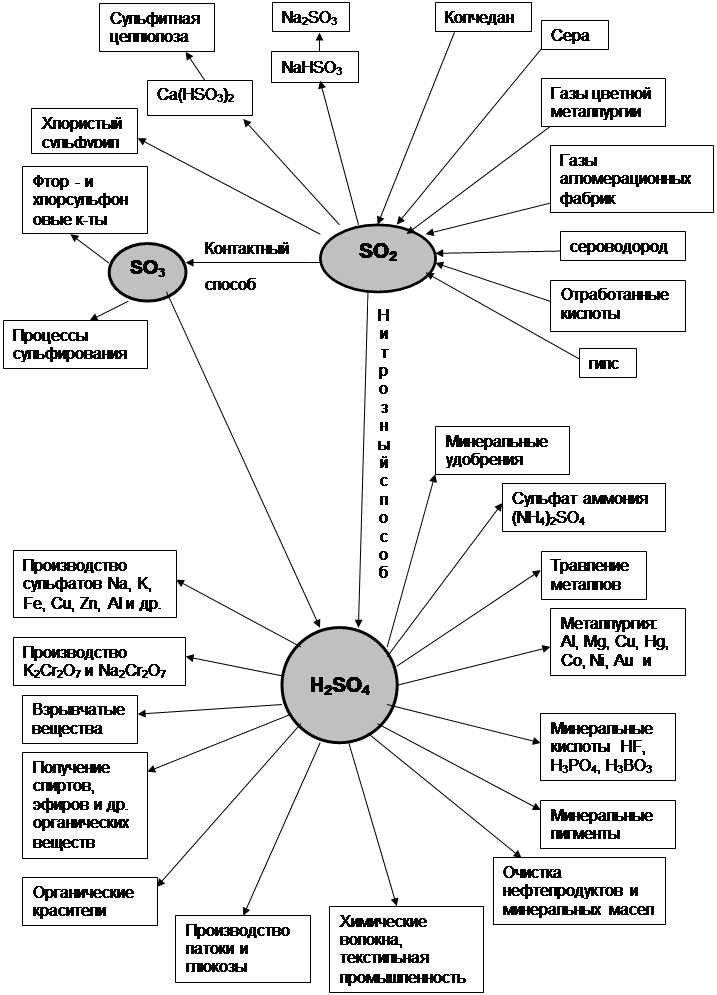
Реакция окисления оксида серы (IV) в оксид серы (IV), лежащая в основе процесса контактирования обжигового газа, представляет собой гетерогенно-каталитическую, обратимую, экзотермическую реакцию и описывается уравнением:
SО2+ 0,5О2 <=> SО3 – ΔН.
Тепловой эффект реакции зависит от температуры и равен 96,05 кДж при 25 оС и около 93 кДж при температуре контактирования. Система «SО2 – О2 – SО3» характеризуется состоянием равновесия в ней и скоростью окисления оксида серы (IV), от которых зависит суммарный результат процесса.
Константа равновесия реакции окисления оксида серы (IV) равна:
 (1)
(1)
где ![]() – равновесные парциальные давления оксида серы (VI), оксида серы (IV) и кислорода соответственно.
– равновесные парциальные давления оксида серы (VI), оксида серы (IV) и кислорода соответственно.
Степень превращения оксида серы (IV) в оксид серы (VI) или степень контактирования, достигаемая на катализаторе, зависит от активности катализатора, температуры, давления, состава контактируемого газа и времени контактирования и описывается уравнением:
 (2)
(2)
где ![]() – те же величины, что и в формуле (1)
– те же величины, что и в формуле (1)
Из уравнений (1) и (2) следует, что равновесная степень превращения оксида серы (IV) связана с константой равновесия реакции окисления:
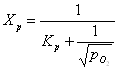 (3)
(3)
Зависимость Хр от температуры, давления и содержания оксида серы (IV) в обжиговом газе представлена в табл. 1 и на рис. 4.
Таблица 1. Зависимость Хр от температуры, давления и содержания оксида серы (IV) в обжиговом газе
| Температура, оС (при давлении 0,1 МПа и содержании SО2 0,07 об. долей) | Давление, МПа (при температуре 400 оС и содержании SО2 0,07 об. долей) | содержание SО2 об. долей | ||||||
| 1000 | 700 | 400 | 0,1 | 1,0 | 10 | 0,02 | 0,07 | 0,10 |
| 0,050 | 0,436 | 0,992 | 0,992 | 0,997 | 0,999 | 0,971 | 0,958 | 0,923 |
(об.дол.)
а б в
Рис. 4. Зависимость равновесной степени превращения оксида серы (IV) в оксид серы (VI) от температуры (а), давления (б) и содержания оксида серы (IV) в газе (в).
Из уравнения (3) и табл. 4 следует, что с понижением температуры и повышением давления контактируемого газа равновесная степень превращения Хр возрастает, что согласуется с принципом Ле-Шателье. В то же время, при постоянных температуре и давлении равновесная степень превращения тем больше, чем меньше содержание оксида серы (IV) в газе, то есть чем меньше соотношение SО2 : О2. Это отношение зависит от вида обжигаемого сырья и избытка воздуха. На этой зависимости основана операция корректирования состава печного газа, то есть разбавление его воздухом для снижения содержания оксида серы (IV).
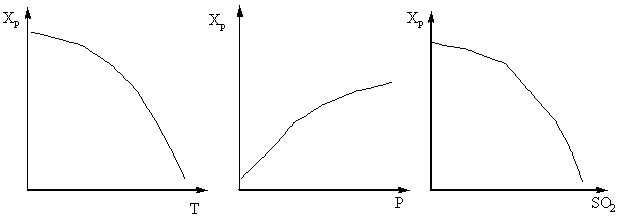
Степень окисления оксида серы (IV) возрастает с увеличением времени контактирования, приближаясь к равновесию по затухающей кривой (рис. 5).
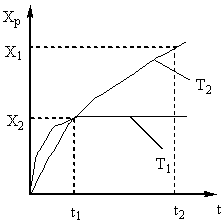
Рис. 5. Зависимость Хр от времени контактирования.
Следовательно, время контактирования должно быть таким, чтобы обеспечить достижение равновесия в системе. Из рис. 5 следует, что чем выше температура, тем скорее достигается равновесие (t1 < t2), но тем меньше степень превращения (Х1 < Х2 при Т1 > Т2). Таким образом, выход оксида серы (IV) зависит как от температуры, так и от времени контактирования. При этом, для каждого времени контактирования зависимость выхода от температуры выражается соответствующей кривой, имеющей максимум. Очевидно, что огибающая эти максимумы линия АА (рис. 6) представляет кривую оптимальных температур для различного времени контактирования, близкую к равновесной кривой.
η
Рис. 6. Зависимость выхода оксида серы (IV) от температуры при различном времени контактирования.
От скорости окисления зависит количество оксида серы (IV), окисляющееся в единицу времени, и, следовательно, объем контактной массы, размеры реактора и другие характеристики процесса. Организация этой стадии производства должна обеспечить возможно более высокую скорость окисления при максимальной степени контактирования, достижимой в данных условиях.
Энергия активации реакции окисления оксида серы (IV) кислородом в оксид серы (VI) весьма велика. Поэтому, в отсутствие катализатора реакция окисления даже при высокой температуре практически не идет. Применение катализатора позволяет снизить энергию активации и увеличить скорость окисления.
В производстве серной кислоты в качестве катализатора применяют контактные массы на основе оксида ванадия (V) марок БАВ и СВД, названные так по начальным буквам элементов, входящих в их состав.
БАВ (барий, алюминий, ванадий) состава:
V2О5 (7 %) + К2SО4 + ВаSО4 + Аl2(SО4)3 + SiО2 (кремнезем)
![]()
катализатор активатор носитель
СВД (сульфо–ванадато–диатомовый) состава
V2О5 (7 %) + К2S2О7 + диатомит + гипс
![]()
катализатор активатор носитель
Для описания скорости окисления оксида серы (IV) в оксид серы (VI) на ванадиевом катализаторе при неподвижном слое катализатора предложены различные кинетические уравнения. К ним относится, например, уравнение (4), связывающее скорость реакции со степенью превращения оксида серы (IV), константой скорости реакции , константой равновесия и давлением газа:
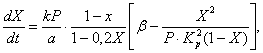 (4)
(4)
![]() (5)
(5)
где Х – равновесная степень превращения оксида серы (IV),
k – константа скорости окисления,
а – начальная концентрация оксида серы (IV) в газе,
b – начальная концентрация кислорода в газе,
Р – общее давление в газе,
Кр – константа равновесия реакции.
Из уравнений (4) и (5) следует, что скорость окисления зависит от константы скорости реакции, сильно возрастающей при повышении температуры. Однако при этом уменьшается константа равновесия Кр и уменьшается значение члена 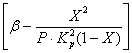 в уравнении (4). Таким образом, скорость процесса окисления оксида серы (IV) зависит от двух величин, изменяющихся с ростом температур в противоположном направлении. Вследствие этого кривая зависимости скорости окисления от температуры должна проходить через максимум. Из уравнения (4) также следует, что скорость окисления оксида серы (IV) тем больше, чем меньше достигаемая в этом процессе степень превращения оксида серы (IV) в оксид серы (VI). Вследствие этого для каждой степени превращения зависимость скорости реакции от температуры будет выражаться индивидуальной кривой, имеющей максимум. На рис. 7 представлена серия подобных кривых, соответствующих различные степеням превращения для газа постоянного состава. Из него следует, что скорость реакции окисления достигает максимума при определенных значениях температур, которая тем выше, чем меньше эта степень превращения, и представляют, очевидно, оптимальные температуры.
в уравнении (4). Таким образом, скорость процесса окисления оксида серы (IV) зависит от двух величин, изменяющихся с ростом температур в противоположном направлении. Вследствие этого кривая зависимости скорости окисления от температуры должна проходить через максимум. Из уравнения (4) также следует, что скорость окисления оксида серы (IV) тем больше, чем меньше достигаемая в этом процессе степень превращения оксида серы (IV) в оксид серы (VI). Вследствие этого для каждой степени превращения зависимость скорости реакции от температуры будет выражаться индивидуальной кривой, имеющей максимум. На рис. 7 представлена серия подобных кривых, соответствующих различные степеням превращения для газа постоянного состава. Из него следует, что скорость реакции окисления достигает максимума при определенных значениях температур, которая тем выше, чем меньше эта степень превращения, и представляют, очевидно, оптимальные температуры.
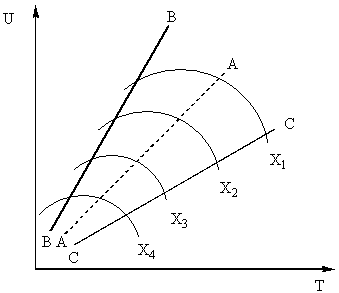
Рис. 7. Зависимость скорости окисления оксида серы (IV) от температуры при различных степенях превращения Х1 < Х2 < Х3 < Х4
Линия АА, соединяющая точки оптимальных температур, называется линией оптимальной температурной последовательности (ЛОТ) и указывает, что для достижения наилучших результатов процесс контактирования следует начинать при высокой температуре, обеспечивающей большую скорость процесса (на практике около 600 оС), а затем для достижения высокой степени превращения снижать температуру, выдерживая температурный режим по ЛОТ. Линии ВВ и СС на рис. 7 очерчивают область допустимых температур в реальном технологическом процессе контактирования.
В таблице 2 представлен температурный режим работы 4-х слойного контактного аппарата с промежуточным теплообменом, установленный в соответствии с изложенным выше принципом:
Таблица 2. Температурный режим контактного узла
| Слои | I | II | III | IV |
| Температурный режим в контактном аппарате, оС | 440–600 | 460–500 | 440–450 | 420–425 |
| Температурный режим в теплообменнике, оС | 600–460 | 500–440 | 450–420 | 420 |
| Хр | 0,70 | 0,90 | 0,96 | 0,98 |
Таким образом, противоречие между кинетикой и термодинамикой процесса процесса окисления оксида серы (IV) достаточно успешно снимается конструкцией и температурным режимом работы контактного аппарата. Это достигается разбивкой процесса на стадии, каждая из которых отвечает оптимальным условиям процесса контактирования. Тем самым определяются и начальные параметры режима контактирования: температура 400 – 440 оС, давление 0,1 МПа, содержание оксида серы (IV) в газе 0,07 об. долей, содержание кислорода в газе 0,11 об. долей.
5. Аппаратурно–технологическая схема тонкой очистки сернистого газа и окисления сернистого ангидрида в четырехслойном контактном аппарате с фильтрующими слоями катализатора.
Реакторы или контактные аппараты для каталитического окисления оксида серы (IV)по своей конструкции делятся на аппараты с неподвижным слоем катализатора (полочные или фильтрующие), в которых контактная масса расположена в 4-5 слоях, и аппараты кипящего слоя. Отвод тепла после прохождения газом каждого слоя катализатора осуществляется путем введения в аппарат холодного воздуха или газа, или с помощью строенных в аппарат или вынесенных отдельно теплообменников.
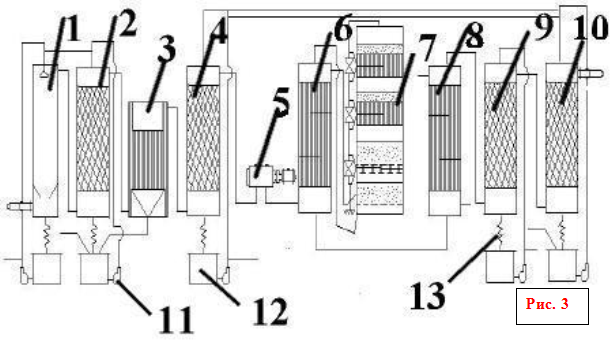
В настоящее время в производстве серной кислоты и олеума контактным методом наиболее распространенной является технологическая схема с использованием принципа двойного контактирования «ДКДА» (двойное контактирование – двойная абсорбция). Часть подобной схемы, за исключением печного отделения и отделения общей очистки газ, технологически однотипных для всех схем, представлена на рис. 9.
Производительность установки до 1500 т/сут по моногидрату. Расходные коэффициенты (на 1 т моногидрата): колчедан 0,82 т, вода 50 м3, электроэнергия 82 кВт·ч.
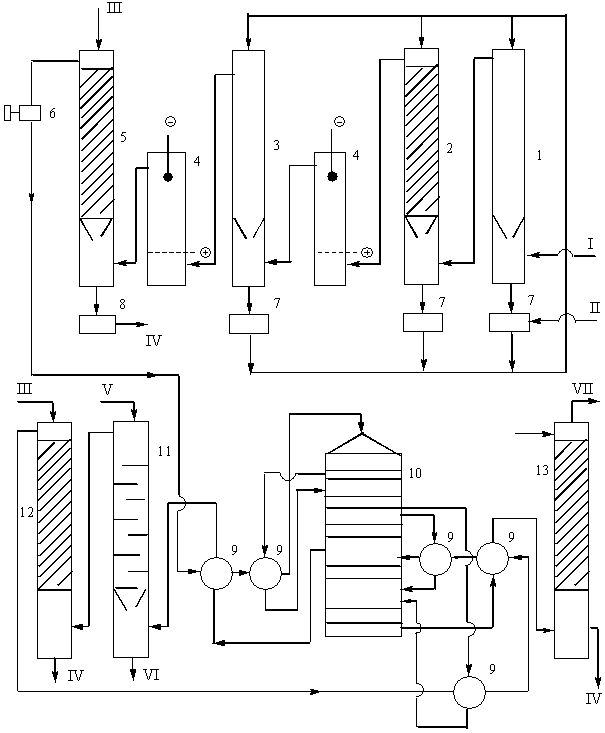
Рис. 9. Технологическая схема производства серной кислоты из колчедана двойным контактированием ДКДА.
1 – полая промывная башня, 2 – промывная башня с насадкой, 3 – увлажнительная башня, 4 – электрофильтры, 5 – сушильная башня, 6 – турбогазодувка, 7 – сборники 75 %-ной кислоты, 8 – сборник продукционной кислоты, 9 – теплообменники, 10 – контактный аппарат, 11 – олеумный абсорбер, 12 и 13 – моногидратные абсорберы. Потоки продуктов: I – печной газ при 300 оС, II – 75 %-ная серная кислота, III – охлажденная 98 %-ная кислота, IV – продукционная кислота на охлаждение, V – охлажденный олеум или моногидрат, VI – продукционный олеум на охлаждение, VII – выхлопные газы.
6. Материальный баланс 1 ступени контактного аппарата окисления сернистого газа.
Данные для расчета:
1. Общая производительность по серной кислоте в пересчете на моногидрат – 127 т/час;
2. полнота абсорбции серного ангидрида – 99,8 %;
3. состав исходного газа:
SО2 – 6,82 % (об.), О2 – 10,4 % (об.), СО2 – 0,4 % (об.), N2 – 82,38 % (об.);
температура 520 оС;
степень достижения равновесия – α = 0,650
1. Рассчитаем равновесную степень превращения SО2 в SО3. Рассмотрим расчет равновесия по известным значениям Кр для реакции окисления диоксида серы:
SО2 + 0,5О2 + СО2 +N2 <=> SО3 + СО2 +N2
а b т п
где а, b, т, п – количество (моль) компонентов исходной смеси SО2, О2, СО2 и N2 (а + b+ т + п = 1).
Количество каждого компонента (моль) при достижении равновесной степени превращения хА,е составит
SО2 О2 СО2 N2 SО3
а – а · хА,е b – 0,5а · хА,е т п а · хА,е
Общее число равновесной смеси:
а – а · хА,е + b – 0,5а · хА,е+ т + п + а · хА,е = 1 – 0,5а · хА,е
Константа равновесия

может быть рассчитано по уравнению (стр.433, [1]):
![]()
При температуре 520оС (793 К) константа равновесия равна:
![]()
Состояние равновесия реакции можно характеризовать значениями равновесной степени превращения

Обозначив общее давление через р, выразим равновесные давления компонентов:
![]()
![]()
![]()
Тогда
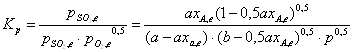
отсюда
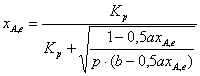 (6)
(6)
Подставляя исходные данные в уравнение (6), получим (р = 0,1 МПа):

Откуда методом итераций находим ![]() и, следовательно, в равновесной смеси содержится:
и, следовательно, в равновесной смеси содержится:
![]()
![]()
![]()
SО3 – 6,38 % (об.), SО2 – 0,688 % (об.), О2 – 7,54 % (об.), СО2 – 0,412 % (об.), N2 – 84,98 % (об.);
2. Практическая степень превращения равна:
![]()
3. Суммарное уравнение окисления оксида серы (IV) в оксид серы (VI) и абсорбции оксида серы (VI) с образованием серной кислоты:
SО2 + 0,5О2 + Н2О ![]() Н2SО4
Н2SО4
Похожие работы
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
... как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме. Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ...
... образуется азотная кислота: NO(HSO4) + H2O®H2SO4 + HNO2 Она - то и окисляет SO2 по уравнению: SO2 + 2HNO2®H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75% - ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество ...
... . Для автоматического регулирования необходимо максимально знать требования, предъявляемые различным химико-технологическим процессом. 1.Основная часть 1.1 Технологический процесс получение серного ангидрида при получении серной кислоты. Производство серной кислоты контактным способом состоит из следующих действий: 1. Разгрузка, складирование и подготовка сырья ...


0 комментариев