Навигация
Графит – серо-чёрное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступающее даже бумаге
2. Графит – серо-чёрное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступающее даже бумаге.
Атомы углерода в кристаллах графита находятся в состоянии sр2-гибридизации: каждый из них образует три ковалентные σ-связи с соседними атомами. Углы между направлениями связей равны 120°. В результате образуется сетка, составленная из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142 нм. Четвёртый электрон внешнего слоя каждого атома углерода в графите занимает р-орбиталь, не участвующую в гибридизации.
Негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя, и перекрываясь друг с другом, образуют делокализованные σ-связи. Соседние слои в кристалле графита находятся друг от друга на расстоянии 0,335 нм и слабо связаны между собой, в основном силами Ван-дер-Ваальса. Поэтому графит имеет низкую механическую прочность и легко расщепляется на чешуйки, которые сами по себе очень прочны. Связь между слоями атомов углерода в графите частично имеет металлический характер. Этим объясняется тот факт, что графит хорошо проводит электрический ток, но все, же не так хорошо, как металлы.
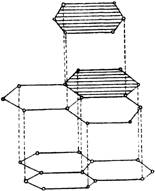
Структура графита
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
3. Карбин – мелкокристаллический порошок чёрного цвета. В его кристаллической структуре атомы углерода соединены чередующимися одинарными и тройными связями в линейные цепочки:
−С≡С−С≡С−С≡С−
Это вещество впервые получено В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым в начале 60-х годов XX века.
Впоследствии было показано, что карбин может существовать в разных формах и содержит как полиацетиленовые, так и поликумуленовые цепочки, в которых углеродные атомы связаны двойными связями:
=С=С=С=С=С=С=
Позднее карбин был найден в природе – в метеоритном веществе.
Карбин обладает полупроводниковыми свойствами, под действием света его проводимость сильно увеличивается. За счёт существования разных типов связи и разных способов укладки цепей из углеродных атомов в кристаллической решетке физические свойства карбина могут меняться в широких пределах. При нагревании без доступа воздуха выше 2000°С карбин устойчив, при температурах около 2300°С наблюдается его переход в графит.
Природный углерод состоит из двух изотопов ![]() (98,892%) и
(98,892%) и ![]() (1,108%). Кроме того, в атмосфере обнаружены незначительные примеси радиоактивного изотопа
(1,108%). Кроме того, в атмосфере обнаружены незначительные примеси радиоактивного изотопа ![]() , который получают искусственным путём.
, который получают искусственным путём.
Раньше считали, что древесный уголь, сажа и кокс близки по составу чистому углероду и отличающиеся по свойствам от алмаза и графита, представляют самостоятельную аллотропную модификацию углерода («аморфный углерод»). Однако было установлено, что эти вещества состоят из мельчайших кристаллических частиц, в которых атомы углерода связаны так же, как в графите.
4. Уголь – тонко измельчённый графит. Образуется при термическом разложении углеродсодержащих соединений без доступа воздуха. Угли существенно различаются по свойствам в зависимости от вещества, из которого они получены и способа получения. Они всегда содержат примеси, влияющие на их свойства. Наиболее важные сорта угля – кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха.
Древесный уголь образуется при нагревании дерева без доступа воздуха.
Сажа – очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) при ограниченном доступе воздуха.
Активные угли — пористые промышленные адсорбенты, состоящие в основном из углерода. Адсорбцией называют поглощение поверхностью твёрдых веществ газов и растворённых веществ. Активные угли получают из твердого топлива (торфа, бурого и каменного угля, антрацита), дерева и продуктов его переработки (древесного угля, опилок, отходов бумажного производства), отходов кожевенной промышленности, материалов животного происхождения, например костей. Угли, отличающиеся высокой механической прочностью, производят из скорлупы кокосовых и других орехов, из косточек плодов. Структура углей представлена порами всех размеров, однако адсорбционная ёмкость и скорость адсорбции определяются содержанием микропор в единице массы или объёма гранул. При производстве активного угля вначале исходный материал подвергают термической обработке без доступа воздуха, в результате которой из него удаляется влага и частично смолы. При этом образуется крупнопористая структура угля. Для получения микропористой структуры активацию производят либо окислением газом или паром, либо обработкой химическими реагентами.
1.3. Химические свойства углерода
При обычных температурах алмаз, графит, уголь химически инертны, но при высоких температурах активность их увеличивается. Как и следует из строения основных форм углерода, уголь вступает в реакции легче, чем графит и тем более алмаз. Графит не только более реакционноспособен, чем алмаз, но и, реагируя с некоторыми веществами, может образовывать такие продукты, каких не образует алмаз.
1. В качестве окислителя углерод реагирует с некоторыми металлами при высоких температурах, образуя карбиды:
ЗС + 4Аl = Аl4С3 (карбид алюминия).
2. С водородом уголь и графит образуют углеводороды. Простейший представитель – метан СН4 – может быть получен в присутствии катализатора Ni при высокой температуре (600-1000°С):
С + 2Н2![]() СН4.
СН4.
3. При взаимодействии с кислородом углерод проявляет восстановительные свойства. При полном сгорании углерода любой аллотропной модификации образуется оксид углерода (IV):
С + О2 = СО2.
При неполном сгорании образуется оксид углерода (II) СО:
С + О2 = 2СО.
Обе реакции экзотермичны.
4. Особенно ярко восстановительные свойства угля проявляются при взаимодействии с оксидами металлов (цинка, меди, свинца и др.), например:
С + 2CuO = СО2↑ + 2Cu,
С + 2ZnO = СО2↑ + 2Zn.
На этих реакциях основан важнейший процесс металлургии – выплавка металлов из руд.
В иных случаях, например при взаимодействии с оксидом кальция, образуются карбиды:
СаО + ЗС = СаС2 + СО↑.
5. Уголь окисляется горячими концентрированными серной и азотной кислотами:
С + 2Н2SO4 = СO2↑ + 2SO2↑ + 2Н2О,
конц.
ЗС + 4НNО3 = ЗСО2↑ + 4NO↑ + 2Н2О.
конц.
Любые формы углерода устойчивы по отношению к щелочам!
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... HСlO3 Хлораты Хлористая НClO2 Хлориты Хлорноватистая HClO Гипохлориты Хромовая H2CrO4 Хроматы Циановодородная (синильная кислота) слота) HCN Цианиды Основные типы химических реакций Среди разнообразных химических реакций можно выделить два типа, существенно отличающихся друг от друга. К первому типу реакций относятся те, в ходе которых степень окисления ...
... г/см3 ,с плотностью «легкого» алюминия, р=2,7г/см3, и тем более железа, р=7,9г/см3), а также в судостроении, где особенно ценна коррозионная стойкость. Углерод Соединения углерода Оксид углерода (1У) Угольная кислота имеет аллотропные модификации: алмаз, графит, карбин, фуллерен и др. проявляет восстановительные свойства горит в кислороде: С+О2=СО2+Q взаимодействует с ...
... к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из ...






0 комментариев