Навигация
Фотохимия кислорода и озона в атмосфере
3. Фотохимия кислорода и озона в атмосфере
Наиболее типичной фотохимической реакцией в верхних слоях атмосферы является диссоциация молекул кислорода с образованием атомов и радикалов. Так, при действии коротковолнового ультрафиолетового (УФ) излучения, образующиеся возбуждённые молекулы
O2 *: O2 + hν à O2*,
диссоциируют на атомы: O2* à O + O. Эти атомы вступают во вторичную реакцию с O2, образуя озон: O + O2 à O3. Образование озона проходит по обратимой реакции: 3O2 + 68ккал (285 кДж) ↔ 2O3.
Озон жадно поглощает ультрафиолетовое излучение в области от 2000 до 3000Å, и это излучение разогревает атмосферу. Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях (760 мм рт. ст. и 0оС) самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Озон – мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Также повышает степень окисления оксидов.
Озон в атмосфере, определяет характер поглощения солнечной радиации в земной атмосфере. Содержится в ничтожном количестве: толщина слоя озона, приведённого к нормальным условиям, в среднем для всей Земли составляет 2,5-3 мм. Основная масса озона в атмосфере расположена в виде слоя - озоносферы - на высоте от 10 до 50 км с максимумом концентрации на высоте 20-25 км. Озоновый слой, находящийся в верхней атмосфере, служит своеобразным щитом, охраняющим нас от действия ультрафиолетового излучения Солнца. Без этого щита развитие жизни на Земле в ее современных формах вряд ли было бы возможным.
4. Фотохимические реакции с участием метана
Рассмотрение поведения метана в атмосфере начнем с процессов исчезновения метана. Дело в том, что процессы вывода метана из атмосферы известны в количественном отношении гораздо полнее, чем процессы, обеспечивающие поступление метана в атмосферу. Интенсивность процессов стока метана должна быть примерно равной интенсивности источников метана, что позволяет более надежно судить о мощности источников метана в атмосфере.
Молекула метана довольно устойчива, и ее нелегко вывести из атмосферы. Метан малорастворим в воде (30 см3 газа растворяется в одном литре воды), и удаление его из атмосферы с помощью осадков не происходит. Для реального удаления из атмосферы метан необходимо переводить в нелетучие соединения или другие газообразные соединения.
Метан, как и многие другие примеси, исчезает из атмосферы, в основном в реакции с радикалом ОН:
ОН + СН4 = Н2О + СН3
Радикал ОН - одна из наиболее реакционноспособных частиц в химических процессах. Источником радикала ОН в тропосфере является тропосферный озон (О3). Под действием ультрафиолетового света молекулы тропосферного озона разрушаются с образованием молекулы кислорода и чрезвычайно реакционноспособного атома кислорода в возбужденном электронном состоянии (О*):
О3 + hν = О2 + О*
Атомы кислорода отрывают один атом водорода от воды и получается два радикала ОН:
О* + Н2О = 2ОН
Итак, реакции в атмосфере, приводящие к выводу метана, таковы:
ОН + СН4 = Н2О + СН3,
CH3 + O2 = CH3O2,
CH3O2 + NO = CH3O + NO2,
CH3O + O2 = CH2O + HO2,
НО2 + NO = OH + NО2,
2[NO2 + hν = NO + O],
CH4 + 4O2 = CH2O + H2O + 2O3
Образующиеся молекулы формальдегида начинают участвовать в следующих трех реакциях, которые дают начало новым циклам:
CH2O + hν = H2 + CO,
СН2O + hν = Н + НСO,
CH2O + OH = HCO + H2O
Вторая и третья реакции дают начало следующим циклам, протекающим в присутствии оксидов азота, в результате которых возникают две молекулы озона и два радикала ОН. Реакция формальдегида с радикалом ОН также приводит к образованию озона:
CH2O + OH = HCO + H2O,
CH2O + 2O2 + hν = CO + O3 + H2O
Таким образом, в результате многоступенчатого процесса из относительно небольшого количества молекул метана образуется сравнительно большое количество озона.
5. Фотохимические процессы оксидов азота
NO и NO2 всегда присутствуют в атмосфере в количествах, достаточных для протекания реакций с их участием. 65% от общего количества связанного азота на Земле является результатом деятельности азотфиксирующих микроорганизмов почвы, 25% приходится на промышленный синтез аммиака. Оставшаяся часть (10%) – результат сгорания азота в его окись в атмосфере за счет высокотемпературных (пожары, грозовые разряды) и фотохимических процессов в верхних слоях атмосферы. Эти процессы составляют источник более или менее постоянных концентраций оксидов азота в атмосфере, и их уровень является оптимальным для поддержания на постоянном уровне химических явлений в атмосфере Земли, прежде всего постоянства концентрации озона.
Фотохимические реакции с участием оксидов азота протекают под действием солнечной радиации и в верхних слоях атмосферы. Загрязнение стратосферы этими веществами происходит в процессе работы реактивных двигателей самолетов и ракет. Кроме того, под действием ультрафиолетовой радиации происходит фотохимическое окисление азота воздуха, продуктами которого являются NO и NO2. С ними связаны процессы деструкции озона, причем в них проявляется каталитическая роль этих веществ:
O + NO2 à NO + O2
NO + O3 à NO2 + O2
Исследования последних лет показывают постепенное повышение содержания закиси азота в атмосфере. Это связано с тем, что при среднем времени жизни молекулы N2O в атмосфере около 180 лет и увеличении объемов антропогенного загрязнения отсутствуют пути естественного стока N2O, за исключением фотохимических реакций в стратосфере:
N2O + O à N2 + O2,
N2O + O à 2NO
Итак, оксид азота - важный фактор, определяющий состояние окружающей нас атмосферы и внешние условия существования. Однако это же вещество является и мощным внутренним биорегулятором.
Заключение
Таким образом, фотохимические процессы играют важнейшую роль в поддержании постоянства газового состава атмосферы Земли. Вместе с химическими процессами в нижних слоях атмосферы, на поверхности Земли, а также в литосфере и гидросфере они составляют сложную систему, которая, благодаря своему функционированию, является основой обеспечения жизнедеятельности и поддержания гомеостаза живых организмов. Озон, полученный в результате химических превращений кислорода под действием ультрафиолета Солнца, образует озоновый слой, который изменяет спектр достигающего земной поверхности ультрафиолетового излучения, отсекая коротковолновую его составляющую, и тем самым защищая населяющие Землю живые организмы от его вредного воздействия. Метан, неоднократно взаимодействуя с кислородом, оксидами азота и гидроксильным радикалом OH, так же образует озон. В итоге вместо одной исчезнувшей в атмосфере молекулы метана возникает 3,5 молекулы озона. В атмосфере оксид азота (II) окисляется до диоксида азота. При высокой концентрации оксиды азота могут оказывать токсическое действие на центральную нервную систему человека. Однако под действием солнечного света диоксид азота распадается на монооксид и атомарный кислород, который превращает кислород О2 опять же в озон О3.
Накапливаясь в нижних слоях атмосферы, озон способен оказывать вредное воздействие на организм: вызывает кашель, головокружение, усталость. Озон – сильнейший окислитель: при его содержании в воздухе всего лишь 1•10–5% (по объему) он разъедает резину, разрушает металлы, вступает в реакции с углеводородами, образуя опасные для человека вещества. Однако максимальная концентрация озона все же наблюдается в верхних атмосферных слоях, где его роль сложно переоценить.
Список литературы
1) Некрасов Б.В. Основы общей химии. М.: Химия, 1989.
2) Бажин Н.М. Химия в интересах устойчивого развития. 1993. Т. 1.
3) Прокофьева И. . Атмосферный озон, М.-Л., 1951
4) Зеленин К.Н. Оксид азота(II): Новые возможности давно известной молекулы // Соросовский Образовательный Журнал. 1997. № 10.
5) Джуа М. История химии. М.: Мир, 1982.
6) Уэйн Р. Основы и применение фотохимии. М., «Мир», 1991
Похожие работы
... света и, поглощая квант, переходят в возбужденное состояние. Эти вещества обладают и другой особенностью - способностью передавать энергию возбуждения молекулам кислорода, переводя их тем самым в синглетное состояние. Такие вещества называют сенсибилизаторами (S). Оксиды азота и являются активными сенсибилизаторами, вызывающими образование синглетного кислорода: S + hn S* S* + 3O2 S + 1O2 а ...
... ) в атмосферу выбрасывается около 2 тыс. куб. м условного оксида углерода и более 150 т. пыли. Производство цемента и других строительных материалов также является источником загрязнения атмосферы пылью. Основные технологические процессы этих производств - измельчение и химическая обработка шихт, полуфабрикатов и получаемых продуктов в потоках горячих газов всегда сопровождается выбросами пыли и ...
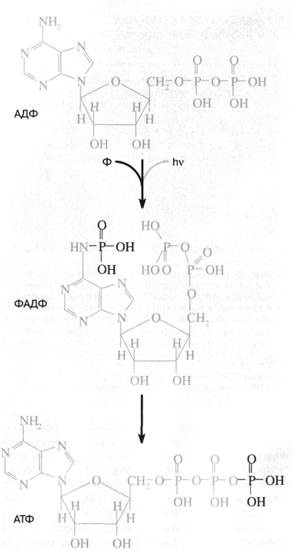
Перенос фосфорила с аде-ниновой "головы" нуклеотида на фосфатный "хвост" должен сопровождаться его стабилизацией, поскольку весьма лабильный фосфоамид заменяется на менее лабильный фосфоангидрид (рис. 1). Стадии 2 и 3 гипотетичны и призваны объяснить механизм синтеза АТФ под действием ультрафиолетового света в опытах С. Понамперумы и сотрудников [3]. АДЕНИНСОДЕРЖАЩИЕ КОФЕРМЕНТЫ Аденин ...
... территории, обусловленные главным образом ее природно-ресурсным потенциалом и общей устойчивостью природных ландшафтов (комплексов, геосистем) к антропогенным воздействиям. Из истории С начала 20 века ученые наблюдают за состоянием озонового слоя атмосферы. Сейчас уже все понимают, что стратосферный озон является своего рода естественным фильтром, препятствующим проникновению в нижние ...

0 комментариев