Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра общей химической технологии
КУРСОВАЯ РАБОТА
по предмету: Технология химических производств
на тему:
Технология производства нитробензола
Казань 2008
Задание
1. Составить и описать технологическую схему производства нитробензола
2. Составить материальный баланс процесса
3. Рассчитать технологические и технико-экономические показатели
В основу расчета принять следующие реакции
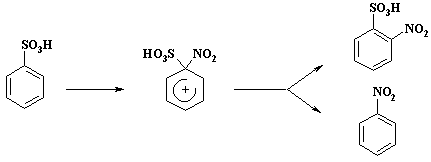
C6H6+HNO3→C6H5NO2+H2O
C6H5NO2+HNO3→C6H4(NO2)2+H2O
Исходные данные:
| Пропускная способность установки по бензолу,т/год: | 1000 |
| Конверсия бензола % Концентрация бензола % масс | 40 99 |
| Состав нитрующей смеси % масс 1. азотная кислота 2. серная кислота 3. вода | 20 59.6 20.4 |
| Массовое соотношение бензол: нитрирующая смесь | 1:4 |
|
Количество денитробензола, % масс, от количества нитробензола | 4 2 |
Теоретическая часть
Производство нитробензола
Нитробензол (темп, пл, +5,7°, темп. кип. 210,9°) представляет собой нерастворимую в воде желтоватую жидкость с запахом горького миндаля; ядовит, как все нитросоединения.
Впервые нитрование бензола было осуществлено Митчерлихом. В промышленности оно было начато в 1847 г.
Нитрующую смесь для нитрования бензола до нитробензола составляли с таким расчетом, чтобы количество азотной кислоты лишь немного превышало теоретическое, а серную кислоту берут в таком количестве чтобы к концу процесса нитрования в отработанной кисоте содеожолсь около 70%
Нитрование проводится при 40°. Повышение температуры способствует образованию динитробензола.
Процесс нитрования можно проводить по периодической, и по непрерывной схеме.
При периодической процесс начинают с наполнения нитратора бензолом затем включают печку, подогревают бензол до 40 — 45° и постепенно вводят нитрующую смесь, регулируя поступление и охлаждение нитратора водой таким образом, чтобы поддерживать температуру процесса около 40°.
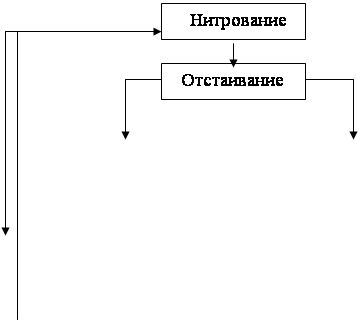
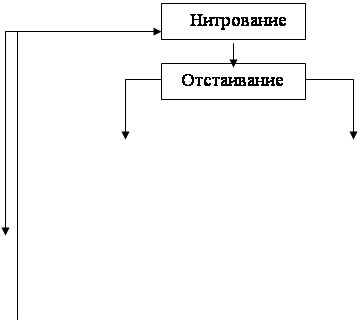
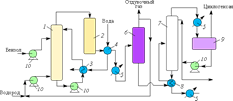
Закончив приливание нитрующей смеси, прекращают охлаждение и дают температуре подняться до 50°. При низкой температуре содержимое нитратора «выдерживают» около 1 часа, втечение этого времени реакция нитрования почти полностью заканчивается; остается всего около 1% непрореагировавшего бензола. После выдержки содержимое нитратора сливают или передавливают в сифонную трубку в отстойник-сепаратор, представляющий собой цилиндрический аппарат с коническим дном и мешалкой. В отстойнике продукты нитрования разделяются на два слоя: верхний— нитрообензольный и нижний—кислотный. Из отстойника отработанная кислота. содержащая 70—72% H2SO4, небольшое количество окисленных продуктов, окислов азота и растворенного и эмульгированного бензола, поступает в сборник. Сырой нитробензол промывают в отстойнике несколько раз холодной водой, а затем раствором соды.
Рисунок 1.Типовая схема процесса получения нитросоединений.
|
|
| ||||||
![]()
![]()
 | |||
![]() Нитрирующая смесь
Нитрирующая смесь
отработанная Кислый
кислота нитропродукт
 | |||||
![]() Исходное Промытая
Исходное Промытая
![]()
![]() вещество и отработ.
вещество и отработ.
нитропродукт кислота
На денитрацию
|
![]()
![]() вода
вода
 | |||||
раствор
Nа2СО3 Промывные воды
|
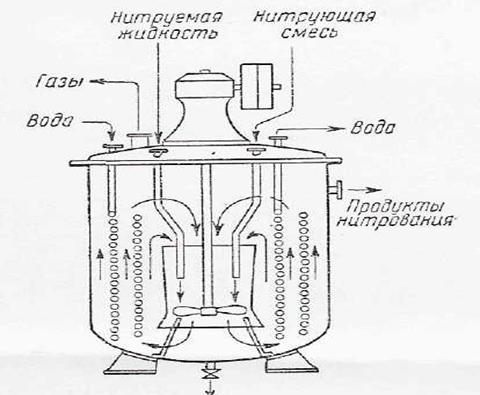
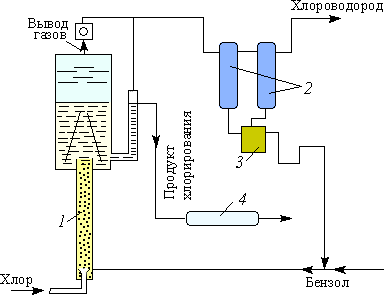
На крупных установках нитробензол получают непрерывным методом. В процессах непрерывного нитрирования бензола применяются нитраторы различных систем. Простотой, надежностью конструкции отличается нитратор с вертикальной циркуляцией реакционной массы (рисунок 2).
Такой нитратор представляет собой чугунный, или выполненный кислотоупорной стали котел с змеевиками и быстроходной пропеллерной мешалкой, помещенной внутри направляющего вертикального стального цилиндра. Бензол и нитрующая смесь непрерывно поступают через трубки в центральную часть нитратора смешиваются с его содержимым, скользят снизу вверх, омывая змеевики, а затем сверху вниз через направляющий цилиндр. Избыток реакционной смеси непрерывно отводится из штуцера в верхней части нитратора.
Рисунок 2. Нитратор непрерывного действия.
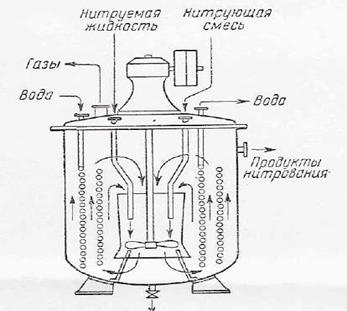
Для доведения реакции нитробензола до конца выходящую из нитратора реакционную смесь будут дополнительно выдерживать в цилиндрическом резервуаре с мешалкой (дозреватель). Остальные процессы отстаивание и промывка сырого нитробензола—также легко осуществляются по непрерывкой схеме.
Материальный баланс
C6H6+HNO3→C6H5NO2+H2O
C6H5NO2+HNO3→C6H4(NO2)2+H2O
Схема потоков:

![]() C6H6
C6H6![]()
![]() ; HNO3; H2SO4; H2O; C6H6
; HNO3; H2SO4; H2O; C6H6![]() ; HNO3; H2SO4; H2O; C6H5NO2;
; HNO3; H2SO4; H2O; C6H5NO2;
примесь C6H6; примесь C6H6; C6H4(NO2)2;
Mr(C6H6)=12*6+6=78кг/кмоль;
Mr(HNO3)=1+14+16*3=63кг/кмоль;
Mr(H2SO4)=1*2+32+16*4=98кг/кмоль;
Mr(C6H5NO2)=12*6+5+14+16*2=123кг/кмоль;
Mr(C6H4(NO2)2)=12*6+4+14*2+16*4=168кг/кмоль;
Mr(H2O)=12+16=18кг/кмоль.
| Приход | Расход | |||
| кг/ч | кмоль/ч | кг/ч | кмоль/ч | |
| C6H6 | 113,014 | 1,449 | 65,13+4,521 | 0,835+0,058 |
| HNO3 | 91,324 | 1,45 | 55,818 | 0,886 |
| примесь C6H6 | 1,141 | - | 1,141 | - |
| H2SO4 | 272,146 | 2,777 | 272,146 | 2,777 |
| H2O’ | 93,151 | 5,175 | 93,151 | 5,175 |
| C6H5NO2 | - | - | 67,404 | 0,548 |
| C6H4(NO2)2 | - | - | 1,368 | 0,008 |
| H2O(1) | - | - | 10,008 | 0,556 |
| H2O(2) | - | - | 0,144 | 0,008 |
| Сумма: | Σ1=570,776 | Σ2=570,831 | ||
1. mтехн(C6H6)=1000*1000/365/24=114,155кг/ч;
2. mчист(C6H6)=114,155*0,99=113,014кг/ч;
Vчист(C6H6)=113,014/78=1,449кмоль/ч;
mприм(C6H6)=114,155-113,014=1,141кг/ч.
3. Потери бензола 4% масс.:
mп(C6H6)=113,014*0,04=4,521кг/ч;
Vп(C6H6)=4,521/78=0,058кмоль/ч;
m (C6H6)=113,014-4,521=108,493кг/ч;
V (C6H6)=108,493/78=1,391кмоль/ч.
4. Полученного в целевой реакции нитробензола:
V (C6H5NO2)= Vпр(C6H6), где Vпр(C6H6) –
количество прореагировавшего бензола;
Vпр(C6H6)=1,391*0,4=0,556кмоль/ч;
mпр(C6H6)=0,556*78=43,368кг/ч;
m (C6H5NO2)=0,556*123=68,388кг/ч.
5. Количество денитробензола от количества нитробензола 2% масс.:
m (C6H4(NO2)2)=68,388*0,02=1,368кг/ч;
V (C6H4(NO2)2)=1,368/168=0,008кмоль/ч.
6. Количество прореагировавшего нитробензола:
Vпр(C6H5NO2)= V (C6H4(NO2)2)=0,008 кмоль/ч;
Vост(C6H5NO2)= V- Vпр=0,556-0,08=0,548кмоль/час;
mост(C6H5NO2)=0,548*123=67,404кг/ч.
7. Не прореагировавший бензол:
Vост(C6H6)= V- Vпр=1,391-0,556=0,835кмоль/ч;
mост(C6H6)=0,835*78=65,13кг/ч.
8. Общее количество нитрирующей смеси, поданной в реакцию:
m(смесь)= 4*mтехн(C6H6)=4*114,155=456,62кг/ч.
9. Состав нитрирующей смеси:
mвсего(HNO3)=456,62*0,2=91,324кг/ч;
Vвсего(HNO3)=91,324/63=1,45кмоль/ч;
m(H2SO4)=456,62*0,596=272,146кг/ч;
V(H2SO4)=272,146/98=2,777кмоль/ч;
m(H2O')=456,62*0,204=93,151кг/ч;
V(H2O')=93,151/18=5,175кмоль/ч.
10. Количество прореагировавшей азотной кислоты:
V0(HNO3)= V1 – V2, где V1- прореагировало с образованием целевого продукта – нитробензола, V2 – на побочную реакцию.
V2(HNO3)= Vпр(C6H5NO2)=0,008кмол/ч;
V0(HNO3)=0,556+0,008=0,564кмоль/ч;
11. Не прореагировало азотной кислоты:
Vост(HNO3)= V– V0=1,45-0,564=0,886кмоль/ч;
mост(HNO3)=0,886*63=55,818кг/ч.
12. Количество образовавшейся воды:
V (H2O(1))= V (C6H5NO2)=0,556кмоль/ч;
V (H2O(2))= V (C6H5NO2)=0,008кмоль/ч;
m(H2O(1))=0,556*18=10,008кг/ч;
m(H2O(2))=0,008*18=0,144кг/ч.
Технологические и технико-экономические показатели процесса
1. Пропускная способность установки по всем видам сырья: 570,776кг/ч.
2. Конверсия по бензолу: 40%.
3. Фактический выход нитробензола:
Qф= m(C6H5NO2)=67,404кг/ч;
4. Теоретический выход нитробензола:
Mr(C6H6) - Mr(C6H5NO2)
mтехн(C6H6) - Qт
78 - 123
114,155 - Qт
Qт=114,155*123/78=180,014кг/ч;
5. Выход нитробензола на поданный бензол:
β= Qф/Qт*100%=67,404/180,014*100%=37,44%.
6. Теоретический выход нитробензола на превращенный бензол:
Mr(C6H6) - Mr(C6H5NO2)
mпр(C6H6) - Qт
78 - 123
43,368 - Qт’
Qт’=43,368*123/78=68,388кг/ч;
7. Выход нитробензола на превращенный бензол:
β’= Qф/Qт’*100%=67,404/68,388*100%=98,56%.
8. Расходные коэффициенты по сырью:
теоретические:
по бензолу:
γC6H6т= Mr(C6H6)/ Mr(C6H5NO2)=78/123=0,634кмоль/кмоль;
по азотной кислоте:
γC6H6т= Mr(HNO3)/ Mr(C6H5NO2)=63/123=0,512кмоль/кмоль;
фактические:
по бензолу:
γC6H6ф= mтехн(C6H6)/ m(C6H5NO2)=114,155/67,404=1,694кг/кг;
по азотной кислоте:
γC6H6ф= mтехн(HNO3)/ m(C6H5NO2)=456,62/67,404=6,77кг/кг;
Список литературы
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., «Химия», 2005, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: «Химия», 2008, 846 с.
3. Общая химическая технология / Под ред. А.Г. Амелина. М.: «Химия», 2007, 400 с.
4. Расчеты химико-технологических процессов / Под ред. И.П. Мухленова. Л.:Химия, 2008, 300 с.
Похожие работы
... серная кислота 3. вода 21 58.6 20.4 Массовое соотношение бензол-нитрирующая смесь 1 : 4.3 Потери бензола % масс 3 1. Теоретическая часть Технологическая схема производства нитробензола Нитробензол (темп, пл, +5,7°, темп. кип. 210,9°) представляет собой нерастворимую в воде желтоватую жидкость с запахом горького миндаля; ядовит, как все нитросоединения. Впервые ...
... Толщина наносимого слоя ангоба не должна превышать 0,2 мм, так как более толстое покрытие при высыхании и обжиге может отслоиться. Раздел 2. Характеристика этапов производства фарфоровой и фаянсовой посуды 2.1 Расчет керамических масс по рациональным составам компонентов В расчетах керамических масс большинство из использующихся сложных соединений дается в виде составляющих их элементов, ...
... азотной кислоты оказывается в таком случае ниже 100 %. Количество вводимой серной кислоты определяется фактором нитрующей активности Ф.Н.А. В таблице 2 приведены показатели промышленных процессов нитрования некоторых ароматических углеводородов. 1.4. Механизм нитрования ароматических углеводородов Процесс нитрования углеводородов смесью азотной и серной кислот протекает в ...
... в реакторе регулируется за счет испарения циклогексана. Гидрирование проводится при 200 °С и давлении 4 МПа (парциальное давление водорода ~0,3 МПа). Рис. 3. Технологическая схема процесса производства циклогексана: 1 — основной реактор гидрирования; 2 — вспомогательный реактор гидрирования; 3 — 5, 8 — теплообменники; 6 — сепаратор высокого давления; 7 — колонна стабилизации; 9 — сепаратор; ...




0 комментариев