Навигация
Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах
7. Фоторецепторные белки: например, родопсин, участвующий в зрительных процессах.
8. Резервные белки используются, как запасной материал для питания развивающегося зародыша и новорожденного организма – это белки семян зернобобовых культур, альбумин – яичный белок, казеин молока. Ферретин – белок животных тканей в котором запасено железо. Резервные белки являются важнейшими компонентами растительной и животной пищи.
Имеется много других белков, функции которых довольно необычны. Например, монеллин – белок, выделенный из африканского растения, имеет очень сладкий вкус. Его изучают как вещество нетоксичное и не способствующее ожирению, с целью использования в пищу вместо сахара. Плазма крови некоторых антарктических рыб содержи белок, обладающий свойствами антифриза.
Технология многих производств основана на переработке белков, изменении их свойств; в кожевенной промышленности, при выделке мехов, натурального шелка, выработке сыров, хлеба и т.д.
1.8 Строение белковой молекулыДля описания строения белковой молекулы были введены понятия о первичной, вторичной, третичной и четвертичной структурах белковой молекулы. В последние годы появились еще такие понятия, как сверхвторичная структура, характеризующая энергетически предпочтительные агрегаты вторичной структуры, и домены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области.
Количество и последовательность расположения аминокислот, и местоположение дисульфидных связей в полипептидной цепи определяют первичную структуру белка. Между первичной структурой белка и его функцией у данного организма существует самая тесная связь. Для того, чтобы белок выполнял свойственную ему функцию, необходима совершенно определенная последовательность аминокислот в полипептидной цепи этого белка. Даже небольшие изменения в первичной структуре могут значительно изменять свойства белка и соответственно его функции. Например, в эритроцитах здоровых людей содержится белок– гемоглобин с определенной последовательностью аминокислот. Небольшая часть людей имеет врожденную аномалию структуры гемоглобина: их эритроциты содержат гемоглобин, у которого в одном положении вместо глутаминовой кислоты (заряженной, полярной) содержится аминокислота валин (гидрофобная, неполярная). Такой гемоглобин существенно отличается по физико-химическим и биологическим свойствам от нормального. Появление гидрофобной аминокислоты, приводит к возникновению «липкого» гидрофобного контакта (эритроциты плохо передвигаются в кровеносных сосудах), к изменению формы эритроцита (из двояковогнутого в серповидный), а также к ухудшению переноса кислорода и т.д. Дети, родившееся с этой аномалией, в раннем детстве погибают от серповидноклеточной анемии.
Исчерпывающие доказательства в пользу утверждения, что биологическая активность определяется аминокислотной последовательностью, были получены, после искусственного синтеза фермента рибонуклеазы (Меррифилд). Синтезированный полипептид с той же аминокислотной последовательностью, что и естественный фермент, обладал такой же ферментативной активностью.
Исследования последних десятилетий показали, что первичная структура закреплена генетически и в свою очередь определяет вторичную, третичную и четвертичную структуры белковой молекулы и ее общую конформацию. Первым белком, у которого была установлена первичная структура, был белковый гормон инсулин (содержит 51 аминокислоту). Это было сделано в 1953 г. Фредериком Сэнгером. К настоящему времени расшифрована первичная структура более десяти тысяч белков, но это очень небольшое количество, если учесть, что в природе белков около 1012.
Зная первичную структуру белка, можно точно написать его структурную формулу, если белок представлен одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, то их предварительно разъединяют, используя специальные реактивы. Для определения первичной структуры отдельной полипептидной цепи, методами гидролиза с использованием аминокислотных анализаторов, устанавливают ее аминокислотный состав. Затем, применяя специальные методы и реагенты, определяют природу концевых аминокислот. Для установления порядка чередования аминокислот, полипептидную цепь подвергают ферментативному гидролизу, при котором образуются осколки этой полипептидной цепи – короткие пептиды. Эти пептиды разделяют методом хроматографии и устанавливают последовательность аминокислот в каждом. Таким образом, достигается этап, когда последовательность аминокислот в отдельных пептидах (фрагментах белка) известна, но остается невыясненной последовательность самих пептидов. Последнюю устанавливают с помощью так называемых перекрывающихся пептидов. Для этого используются какой-либо другой фермент, расщепляющий исходную полипептидную цепь в других участках, и определяют аминокислотную последовательность вновь полученных пептидов. Пептиды, образованные под действием двух ферментов, содержат одинаковые фрагменты аминокислотных последовательностей., совмещая их устанавливают общую аминокислотную последовательность полипептидной цепи.
Большой вклад в изучение строения белковой молекулы сделали Л. Полинг и Р. Кори. Обратив внимание на то, что в молекуле белка больше всего пептидных связей, они первыми провели кропотливые рентгеноструктурные исследования этой связи. Изучили длины связей, углы под которыми располагаются атомы, направление расположения атомов относительно связи. На основании исследований были установлены следующие основные характеристики пептидной связи.

1. Четыре атома пептидной связи и два присоединенных a-углеродных атома лежат в одной плоскости. Группы R и Н a-углеродных атомов лежат вне этой плоскости.
2. Атомы О и Н пептидной связи и два a-углеродных атома и R-группы имеют транс-ориентацию относительно пептидной связи.
3. Длина связи С-N, равная 1,32 Е, имеет промежуточное значение между длиной двойной ковалентной связи (1,21 Е) и однородной ковалентной связи (1,47 Е). Отсюда следует, что связь С-N имеет частично характер двойной связи. Т.е. пептидная связь может существовать в виде резонансных и таутамерных структур, в кето-енольной форме.
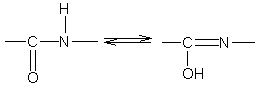
Вращение вокруг связи –С=N– затруднено и все атомы, входящие в пептидную группу, имеют планарную транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах. Каждый планарный пептидный фрагмент содержит две связи с a-углеродными атомами, способными к вращению. Это связи Сa–N (угол вращения вокруг этой связи обозначается j) и связь Сa–С (угол вращения вокруг этой связи обозначается y).
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Вторичная структура белковой молекулы образуется в результате того или иного вида свободного вращения вокруг связей, соединяющих a-углеродные атомы в полипептидной цепи.
В природных полипептидных цепях обнаружены три основных типа структуры: a-спираль, складчатый лист и статистический клубок. Спиральная структура образуется если в цепи одинаковые углы поворотов (j) для всех связей Сa–N и углом поворота (y) для всех связей Сa–С и равны соответственно –48є и –57є. Наиболее часто встречается правозакрученная a-спираль. Эта структура очень стабильна, т.к. в ней почти или полностью отсутствуют стерические затруднения, особенно для R-групп боковых цепей аминокислот. R-группы аминокислот направлены наружу от центральной оси a-спирали. В a-спирали диполи =С=О и >N–Н соседних пептидных связей ориентированы оптимальным образом (почти коаксиальны) для дипольного взаимодействия, образуя вследствие этого обширную систему внутримолекулярных кооперативных водородных связей, стабилизирующих a-спираль. Шаг спирали (один полный виток) 5,4Е включает, 3,6 аминокислотных остатка.
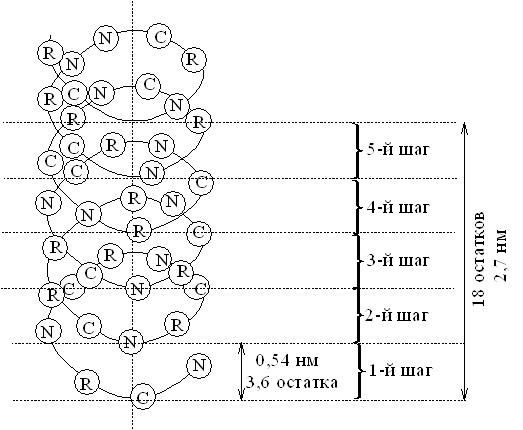
Рисунок 1 – Структура и параметры a-спирали белка
Спиральную структуру могут нарушить два фактора:
1) в наличие остатка пролина, циклическая структура которого вносит излом в пептидную цепь – нет группы –NН2, поэтому невозможно образования внутрицепочечной водородной связи;
2) если в полипептидной цепи подряд расположено много остатков аминокислот, имеющих положительный заряд (лизин, аргинин) или отрицательный заряд (глутаминовой, аспарагиновой кислот), в этом случае сильное взаимное отталкивание одноименнозаряженных групп (–СОО– или –NН3+) значительно превосходит стабилизирующее влияние водородных связей в a-спирали.
Структура типа складчатого листа также стабилизирована водородными связями между теми же диполями =NН......О=С<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Углы вращения для связей Сa-N(j) и Сa-С (y) близки соответственно к –120+1350. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные
одинаковонаправленные полипептидные цепи или антипараллельные,
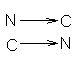
которые укрепляются благодаря водородным связям между этими цепями. Такие структуры называются b-складчатые листы (рисунок 2).
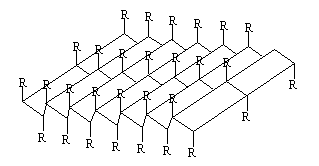
Рисунок 2 – b-структура полипептидных цепей
a-Спиральные складчатые листы – это упорядоченные структуры, в них имеется регулярная укладка аминокислотных остатков в пространстве. Участки белковой цепи с нерегулярной укладкой аминокислотных остатков в пространстве, которые также удерживаются благодаря водородным связям – называются неупорядоченными, бесструктурными – статистическим клубком. Все эти структуры возникают самопроизвольно и автоматически вследствие того, что данный полипептид имеет определенную аминокислотную последовательность, которая предопределена генетически. a-спирали и b-структуры обуславливают определенную способность белков к выполнению специфических биологических функций. Так, a-спиральная структура (a-кератин) хорошо приспособлена к тому, чтобы образовывать наружные защитные структуры-перья, волосы, рога, копыта. b-структура способствует образованию гибких и нерастяжимых нитей шелка и паутины, а конформация белка коллагена обеспечивает высокую прочность на разрыв, необходимую для сухожилий. Наличие только a-спиралей или b-структур характерно для нитевидных-фибрилярных белков. В составе глобулярных-шаровидных белков содержание a-спиралей и b-структур и бесструктурных участков сильно варьирует. Например: инсулин спирализован-на 60%, фермент рибонуклеаза – 57%, белок куриного яйца лизоцим – на 40%.
Сведения о чередовании аминокислотных остатков в полипептидной цепи, а также о наличии в белковой молекуле спирализованных, складчатых и неупорядоченных участков еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу.
Эти особенности строения белка выясняются при изучении его третичной структуры, под которой понимают общее расположение в пространстве в определенном объеме полипептидной цепи.
Третичная структура устанавливается с помощью рентгеноструктурного анализа. Первая модель молекулы белка – миоглобина, отражающая его третичную структуру, была создана Дж. Кендрю с сотрудниками в 1957г. Несмотря на большие трудности к настоящему времени удалось установить третичную структуру более 1000 белков, в том числе гемоглобина, пепсина, лизоцима, инсулина и т.д.
Третичная структура белков образуется путем дополнительного складывания пептидной цепи содержащей a-спираль, b-структуры и участки без периодической структуры. Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами.
В последнее время появились доказательства, что процесс формирования третичной структуры не является автоматическим, а регулируется и контролируется специальными молекулярными механизмами. В этом процессе задействованы специфические белки – шапероны. Основными функциями их являются способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков, и обеспечение доставки (транспорта) их к субклеточным мишеням, создавая условия для завершения свертывания белковой молекулы.
Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
- водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –N< в кольце остатка гистидина.
- электростатические силы притяжения между радикалами, несущими противоположно заряженные ионные группы (ион-ионные взаимодействия), например отрицательно заряженная карбоксильная группа (– СОО– ) аспарагиновой кислоты и (NН3+) положительно заряженной e-аминогруппой остатка лизина.
- гидрофобные взаимодействия обусловлены силами Ван-дер-Ваальса между неполярными радикалами аминокислот. (Например, группами –СН3 – аланина.
Стабилизируется третичная структура и ковалентной дисульфидной связью (–S–S–) между остатками цистеина. Эта связь очень прочная и присутствует не во всех белках. Важную роль эта связь играет в белковых веществах зерна и муки, т.к. оказывает влияние на качество клейковины, структурно-механические свойства теста и соответственно на качество готовой продукции – хлеба и т.д.
Белковая глобула не является абсолютно жесткой структурой: в известных приделах возможны обратимые перемещения частей пептидной цепи относительно друг друга с разрывом небольшого количества слабых связей и образования новых. Молекула как бы дышит, пульсирует в разных своих частях. Эти пульсации не нарушают основного плана конформации молекулы, подобно тому, как тепловые колебания атомов в кристалле не изменяют структуру кристалла, если температура не настолько велика, что наступает плавление.
Только после приобретения белковой молекулой естественной, нативной третичной структуры он проявляет свою специфическую функциональную активность: каталитическую, гормональную, антигенную и т.д. Именно при образовании третичной структуры происходит формирование активных центров ферментов, центров ответственных за встраивание белка в мультиферментный комплекс, центров, ответственных за самосборку надмолекуляных структур. Поэтому любые воздействия (термические, физические, механические, химические), приводящие к разрушению этой нативной конформации белка (разрыв связей), сопровождается частичной или полной потерей белком его биологических свойств.
Изучение полных химических структур некоторых белков показало, что в их третичной структуре выявляются зоны, где сконцентрированы гидрофобные радикалы аминокислот, и полипептидная цепь фактически обматывается вокруг гидрофобного ядра. Более того, в ряде случаев в белковой молекуле обособляются два и даже три гидрофобных ядра, в результате возникает 2-х или 3-х ядерная структура. Такой тип строения молекулы характерен для многих белков, обладающих каталитической функцией (рибонуклеаза, лизоцим и т.д.). Обособленная часть или область молекулы белка обладающая в определенной степени структурной и функциональной автономией называется доменом. У ряда ферментов, например, обособленны субстрат-связывающие и кофермент связывающие домены.
Третичная структура белка имеет прямое отношение к его форме, которая может быть различной: от шарообразной до нитевидной. Форма белковой молекулы характеризуется таким показателем, как степень асимметрии (отношение длинной оси к короткой). У фибриллярных или нитевидных белков степень асимметрии больше 80. При степени асимметрии меньше 80 белки относятся к глобулярным. Большинство из них имеет степень асимметрии 3-5, т.е. третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи, приближающейся по форме к шару.
В биологическом отношении фибриллярные белки играют очень важную роль, связанную с анатомией и физиологией животных. У позвоночных на долю этих белков приходится 1/3 от их общего содержания. Примером фибрилярных белков может служить белок шелка – фиброин, который состоит из нескольких антипараллельных цепей со структурой складчатого листа. Белок a-кератин содержит от 3-7 цепей. Коллаген имеет сложную структуру, в которой 3 одинаковые левовращающие цепи скручены вместе с образованием правовращающей тройной спирали. Эта тройная спираль стабилизирована многочисленными межмолекулярными водородными связями. Наличие таких аминокислот, как гидроксипролина и гидроксилизина также вносит вклад в образование водородных связей, стабилизирующих структуру тройной спирали. Все фибриллярные белки плохо растворимы или совсем нерастворимы в воде, так как в их составе содержится много аминокислот, содержащих гидрофобные, нерастворимые в воде R-группы изолейцин, фенилаланин, валин, аланин, метионин. После специальной обработки нерастворимый и неперевариваемый коллаген превращается в желатин-растворимую смесь полипептидов, который затем используют в пищевой промышленности.
Глобулярные белки выполняют разнообразные биологические функции. Они выполняют транспортную функцию, т.е. переносят питательные вещества, неорганические ионы, липиды и т.д. К этому же классу белков принадлежат гормоны, а также компоненты мембран и рибосом. Все ферменты тоже глобулярные белки.
Белки содержащие две или большее число полипептидных цепей называют олигомерными белками для них характерно наличие четвертичной структуры. Полипептидные цепи (промеры) в таких белках могут быть либо одинаковыми либо разными. Олигомерные белки называют гомогенными, если их протомеры одинаковы и гетерогенными, если их протомеры различны. Например-белок гемоглобин состоит из 4-х цепей: двух -a и двух -b протомеров. Фермент a-амилаза состоит из 2-х одинаковых полипептидных цепей. В олигомерных белках каждая из полипептидных цепей характеризуется своей вторичной и третичной структурой, и называется субъединицей или протомером. Протомеры взаимодействуют друг с другом не любой частью своей поверхности, а определенным участком (контактной поверхностью). Контактные поверхности имеют такое расположение атомных группировок, между которыми возникают водородные, ионные, гидрофобные связи. Кроме того, геометрия протомеров также способствует их соединению. Протомеры подходят друг к другу, как ключ к замку. Такие поверхности называются комплиментарными. Каждый протомер взаимодействует с другим во множестве точек, это приводит к тому, что соединение с другими полипептидными цепями или белками невозможно. Такие комплиментарные взаимодействия молекул лежат в основе всех биохимических процессов в организме. Под четвертичной структурой понимают расположение полипептидных цепей (протомеров) относительно друг друга, т.е. способ их совместной укладки и упаковки с образованием нативной конформации олигомерного белка, в результате чего белок обладает той или иной биологической активностью.
1.9 Физико-химические свойства белковБелки, благодаря присутствию в их составе ионных и полярных группировок (–NH2; –COOH; –SH; –OH и т.д.) существуют в водных растворах в виде заряженных частиц. В зависимости от соотношения в белке основных (NH-аминных) и кислых (–СООН карбоксильных) группировок и рН среды молекула белка в водном растворе приобретает положительный или отрицательный заряд. Большинство белков животного происхождения содержат в своем составе больше дикарбоновых аминокислот аспарагиновой и глютаминовой и поэтому в водных растворах они заряжаются отрицательно (белки-анионы). Некоторые белки содержат в своем составе значительные количества диаминокислот (аргинина, лизина, гистидина) и поэтому заряжаются положительно (белки-катионы). Одноименный заряд молекул способствует взаимному отталкиванию частиц, что обеспечивает устойчивость их в водном растворе.
Число ионизированных групп в белке может быть увеличено или уменьшено при изменении рН среды. В кислой среде подавляется диссоциация карбоксильных групп и отрицательный суммарный заряд белка уменьшается. Наоборот, в щелочной среде подавляется ионизация аминных групп и положительный суммарный заряд белка уменьшается. При определенном значении рН число положительных зарядов на поверхности белковой молекулы будет равным числу отрицательных зарядов и, в целом заряд молекулы белка станет равным нулю. Состояние белка, при котором суммарный заряд его равен нулю, называется изоэлектрическим состоянием. рН, при котором белок находится в изоэлектрическом состоянии называется изоэлектрической точкой белка и обозначается рI. В изоэлектрической точке отсутствие заряда у молекул белка ослабляет силы отталкивания между белковыми частицами, что благоприятствует агрегации белковых молекул и выпадению белка в осадок, т.е. в изоэлектрической точке раствор белка неустойчив, так как белок теряет один из факторов стабилизации белковых водных растворов – заряд.
При добавлении щелочи или кислоты к белку, выпавшему в осадок в изоэлектрическом состоянии, наступает перезарядка его молекул, и белок вновь переходит в раствор – растворяется.
Белки сохраняют свою нативную структуру, а, следовательно, выполняют свойственную им функцию только при определенных физико-химических параметрах среды. Если каким-то образом разрушить связи стабилизирующие пространственную структуру (вторичную, третичную, четвертичную) белковой молекулы, то упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается и молекула целиком или в значительной части принимает форму случайного беспорядочного клубка. Такое изменение белка называют денатурацией. При денатурации белка первичная структура сохраняется.
Денатурацию можно вызвать действием физических и химических факторов. Высокая температура (выше 60є) вызывает разрушение в белке гидрофобных и водородных связей.
Скорость тепловой денатурации зависит от температуры, влажности, (сухие белки более устойчивы к денатурации) присутствия солей, их концентрации. Тепловая денатурация сопровождается агрегацией белков, выпадением их в осадок, что представляет собой уже вторичное явление. Типичным примером денатурации может служить свертывание белков куриного яйца при нагревании.
Белки денатурируют и при многих механических воздействиях: растирании, энергичном встряхивании, при облучении ультрафиолетовом, высокочастотном и т. д. При лиофилизации большинство белов не денатурирует, поэтому этот способ сушки используется для получения белковых препаратов.
Действие кислот и щелочей так же вызывает денатурацию вследствие перезарядки и изменения диссоциации ионогенных аминокислот. При сильном подкислении или подщелачивании все диссоциирующие группы белка имеют одноименный заряд (преимущественно NН3+-групп при низких значениях рН и –СОО– – при высоких). Взаимное отталкивание одноименных зарядов вызывает разрыв части слабых связей, в результате чего нарушается нативная структура. Однако имеются белки, которые устойчивы при крайних значениях рН. Например, пепсин при рН 1,5-2 имеет максимальную активность, у аргиназы оптимум рН 9,5-9,7.
Денатурация может быть вызвана катионами тяжелых металлов и некоторыми анионами – иода, тиоционата и др. Считают, что при этом образуются прочные комплексные соединения и происходит нарушение собственных связей в белке ионных, водородных, гидрофобных.
Действие органических растворителей вызывает нарушение гидрофобных взаимодействий в молекулах белка.
Полярные денатурирующие агенты низкие спирты, этиленгликоль, диоксан и др. образуют водородные связи с аминогруппами или карбоксильными группами пептидного остова и с некоторыми группами радикалов аминокислот, подменяя собственные внутримолекулярные водородные связи в белке, вследствие чего четвертичная, третичная и вторичная структуры частично или полностью разрушаются.
Некоторые химические соединения (глицерин, глюкоза и др. сахара) оказывают на белки защитное действие. Считают, что это связано с их адсорбцией на глобулах белков и образованием крупных гидрофильных комплексов. Денатурация белков сопровождается изменением их физико-химических свойств. Снижается растворимость, гидрофильность белка, его вязкость, оптические свойства. Денатурированные белки дают более интенсивные цветные реакции на аминокислоты, т.к. они стали более доступными вследствие развертывания полипептидной цепочки. «Обнажаются» при этом и пептидные связи, поэтому протеолиз денатурированных белков ферментами протекает с большей скоростью, чем нативных.
При денатурации белок теряет свою биологическую активность, что выражается в неспособности ферментов, гормонов, вирусов выполнять свои функции т. е. они инактивируются.
В определенных условиях, при удалении денатурирующего агента или при медленном охлаждении раствора белка денатурированного нагреванием происходит ренативация – восстановление исходной (нативной) конформации и специфической биологической функции белка.
Процесс денатурации белков играет большую роль в технологии пищевых продуктов при их тепловой обработке. Так потеря всхожести и ухудшение хлебопекарных свойств, происходящее вследствие перегрева зерна при его неправильной сушке в зерносушилке, является следствием денатурации белков. Процесс глубокой денатурации происходит при выпечке хлеба. Копчение мяса при температуре (40-90єС) сопровождается частичной денатурацией белков и освобождением скрытых функциональных групп (–SH, –COOH, –NH2, –OH–, =С=О и др.), которые могут вступать во взаимодействие с летучими продуктами коптильных газов. В результате всех перечисленных процессов происходит необратимая дегидратация, коагуляция части белков, в связи с чем уменьшается влагоудерживающая способность ткани, продукт лучше обезвоживается и уплотняется.
Бланшировка плодов и овощей вызывает денатурацию окислительных ферментов – пероксидазы, о–дифенолоксидазы, аскарбинатоксидазы и т.д. что ведет к сохранению витамина С и препятствует образованию темноокрашенных соединений – меланинов. Тепловая обработка пищевых продуктов повышает их вкусовые качества и усвояемость, поскольку денатурированные белки обладают лучшей атакуемостью пищеварительными ферментами.
Белковая глобула обладает гидрофильностью. Водная оболочка белковой молекулы возникает в результате взаимодействия гидрофильных групп белковой молекулы с диполями воды с образованием водородных связей. Так, пептидная группировка притягивает одну молекулу воды, аминогруппа –NH2 – тоже одну, карбоксильная группа –СООН – четыре. Вблизи молекулы белка отмечается упорядоченное расположение молекул воды. По мере удаления от молекул белка расположение молекул воды носит все более беспорядочный характер. Водная оболочка является одним из факторов устойчивости белковых растворов – препятствует слипанию молекул белка и их осаждению.
При контакте сухого белка с водой он набухает, молекулы воды проникают в белковую массу, гидратируют молекулы белка, разъединяя их. Важную роль в этом процессе играют не только электростатические силы, но и силы осмоса. Дальнейшее поглощение воды приводит к растворению белка.
При определенных условиях белковые растворы образуют коллоидные системы – гели или студни, в которых растворитель и белок образуют одну внешне гомогенную массу. В гелях имеется гидратационная вода, окружающая толстым слоем коллоидные частицы белка, а так же вода, удерживаемая в капиллярных пространствах между ними. Высушенный гель, помещенный в воду, впитывает ее в очень больших количествах – набухает.
Гидрофильные свойства белков, т.е. их способность образовывать студни, набухать имеет большое значение в биологии и пищевых производствах. Очень подвижным студнем, является цитоплазма – полужидкое содержимое клетки, хрусталик глаза и т.д. Типичным белковым сильногидраторованным гелем является пшеничная клейковина, она содержит около 66% воды. Гидрофильные, водоудерживающие свойства продуктов необходимо так же учитывать при замораживании и размораживании мяса, овощей, фруктов, что бы сохранить, не ухудшить их качество. Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна (кондиционирование, прорастание зерна) и хлебопечении. Студни используются в процессе приготовления различных заливных блюд.
Если у белковых глобул отнять гидратную оболочку, то частицы белка начнут слипаться, образуя ассоциации частиц белка, и осядут. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, поэтому их легче осаждать. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей – например спиртом и ацетоном. Молекулы этих веществ, являясь более гидрофильными, чем молекулы белка, образуют собственные гидраты с водой, оттягивая воду от белка, лишая их водной оболочки способствуют агрегации белка.
Обезвоживание белков можно проводить путем добавления нейтральных растворов солей высокой концентрации. Этот процесс называют высаливанием. Осаждающая способность соли зависит от размеров катиона и аниона, а так же от величины их заряда. Катионы и анионы по высаливающей способности можно расположить в ряды, в которых эта способность убывает.
Катионы: Cs+, Rb+, K+, Na+, Li+, Ba2+, Sr2+, Co2+, Mg2+.
Анионы: SO4-2, CL-, Br, NO3-, J-, CNS-, Mg 2+.
Эти ряды называются лиотропными рядами. Высаливающее действие объясняется тем, что при высокой концентрации ионов в растворе белка, они оттягивают на себя от молекул белка поляризованные молекулы воды и тем самым лишают белок гидратной оболочки, которая препятствует осаждению белка. Метод высаливания используется для разделения и получения в очищенном виде белков и ферментов.
При добавлении растворов нейтральных солей (Na2SO4, (NH4)2SO4, MgSO4 и др.) небольших концентраций, растворимость белков в воде возрастает. Растворению белков, как и других веществ, способствуют те факторы, которые уменьшают взаимодействие между молекулами растворяемого вещества. Нейтральные соли в малых концентрациях увеличивают степень диссоциации ионизированных групп белковых молекул и тем самым уменьшают белок-белковое взаимодействие. Известно, что степень диссоциации электролитов ( в том числе белков) прямо пропорциональна диэлектрической постоянной растворителя, которая в свою очередь пропорциональна степени поляризации молекул растворителя, их дипольному моменту. Нейтральные соли в малых концентрациях еще больше увеличивают диэлектрическую постоянную воды. В результате вода усиливает диссоциацию растворенного вещества, в частности белка. Входя между заряженными группами и ориентируясь вокруг них, диполи воды препятствуют их взаимодействию.
Растворимость белков зависит так же от рН растворителя, его состава, температуры. Минимальной растворимостью обладают белки в ИЭТ, что объясняется отсутствием электростатического отталкивания между молекулами белка.
Белки способны образовывать высококонцентрированные системы жидкось-газ-пены. В качестве традиционных пенообразователей используют белки сыворотки крови, молока, которые подвергают вначале гидролизу, а затем сушат на распылительных сушках. Устойчивость пены, в которой белок является пенообразователем зависит от его природы, концентрации и температуры.
Белки в качестве пенообразователей играют важную роль при образовании пены в пиве. В кондитерской промышленности это свойство белков используется при выработке пастилы, зефира, суфле. Структуру пены имеет хлеб и это влияет на его органолептические и структурно-механические свойства.
Благодаря гидрофильным и гидрофобным группировкам белки являются поверхностно-активными веществами и могут влиять на растворимость других веществ. Они выступают в роле эмульгаторов – веществ, стабилизирующих эмульсию, которую образуют взаимнонерастворимые жидкости (вода-жир). В организме человека в эмульгированном состоянии находятся жиры в крови и лимфе. Молоко представляет собой эмульгированные казеиногеном капельки жира в воде. Белки в качестве эмульгаторов находят применение в пищевой промышленности при производстве майонезов, кондитерских изделий, кремов, шоколада и т.п.
1.10 Выделение белков и установление их однородностиВыделение белков из биологических тканей проводят после тщательного измельчения исследуемого материала, вплоть до разрушения клеточной структуры. Разрушают клетки механическим путем, растирая ткань с песком в ступке или в гомогенизаторе. Существуют и другие методы, например поочередное замораживание и оттаивание, обработка ультразвуком.
На всех этапах выделения и очистки белков следует учитывать их большую способность к потере природных, нативных свойств, т.е. к денатурации.
В большинстве случаев процесс разрушения клеток сопровождается выделением тепла, поэтому с целью предотвращения тепловой денатурации все операции следует проводить при пониженных температурах (около +4°С) в термостатированных холодных комнатах.
Современные методы измельчения тканей обычно сочетают с одновременной экстракцией белков из гомогенатов тканей. В качестве растворителей используют 8-10% растворы солей, различные буферные растворы, органические растворители (спирт, ацетон и т.п.), а так же неионные детергенты –вещества, разрушающие гидрофобные взаимодействия между белками и липидами и между белковыми молекулами.
После достижения полной экстракции белков, приступают к разделению-фракционированию смеси белков на индивидуальные белки. Для этого применяют различные методы: высаливание, осаждение органическими растворителями, хроматографию, электрофорез.
При выделении и очистке белков используют четыре основных вида хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматографию по сродству). В адсорбционной хроматографии разделение компонентов смеси основано на их различной сорбируемости на твердом адсорбенте. В качестве адсорбентов используют активированный древесный уголь, оксиды алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще всего буферным раствором) вносят в колонку и равномерно утрамбовывают. Исследуемый образец в небольшом объеме растворителя вносят в колонку. Компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к десорбции компонентов из колонки, используя подходящие элюенты. Сбор фракций осуществляют при помощи автоматического коллектора фракций.
При распределительной хроматографии твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Разновидностью распределительной хроматографии является хроматография на бумаге. В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец наносят в виде капли (пятна) на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол, уксусная кислота, вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
В ионообменной хроматографии в зависимости от заряда разделяемых белков используют подходящую ионообменную смолу (катионит или анионит) с функциональными группами которой обмениваются и задерживаются на колонке часть белков, в то время как другие белки беспрепятственно элюируются из колонки. Связанные с ионообменной смолой белки, отделяют, применяя более концентрированные солевые растворы или изменяя рН элюента.
Аффинная хроматография основана на принципе избирательного взаимодействия белков (или других молекул) с закрепленными на носителе специфическими веществами – лигандами, которыми могут быть субстраты или коферменты (если выделяется какой-либо фермент) и т.д. Благодаря высокой специфичности белков к иммобилизованному (закрепленному) лиганду, к нему присоединяется только один какой-либо белок из смеси. Снятие с колонки этого белка осуществляется подобранными специальными элюентами.
В гель-хроматографии в качестве стационарной фазы используют гель в виде крошечных гранул, так что такую стационарную фазу можно рассматривать как молекулярные сита. Гранулы геля изготовлены из полимера со сшитой структурой, подобной ситу. В качестве такого полимерного материала используются или сшитая агароза, или декстран (полисахарид), или сшитый полиакриламид. В водной среде полимерный материал сорбирует воду и набухает, превращаясь в гелеподобные гранулы, сохраняющие пористую структуру, причем размер пор такого набухшего материала определяется степенью сшивки полимера. Нанесенные на колонку соединения (в виде раствора в подвижной фазе) начинают взаимодействовать с гранулами геля, проникая в объем гранул через поры, что замедляет движение растворенного вещества по колонке. Молекулы небольшого размера лучше задерживаться на колонке, поскольку легче проникают в объем гранул и распределяются там. Молекулы с размерами, большими, чем размеры пор, совсем не будут проникать внутрь гранул, они первыми вымываются из колонки.
Результаты хроматографического разделения представляются графически в виде зависимости измеряемого свойства (поглощение в УФ области и т.п.) от объема элюата, вышедшего из колонки. Пики на таком графике соответствуют выходу индивидуальных белков. Если при разделении получается только один пик, это указывает на чистоту исходного препарата, нанесенного на колонку.
Свойство белков приобретать определенной величины заряд при данном значении рН раствора нашло широкое применение для их разделения методом электрофореза. Электрофорез основан на передвижении заряженной частицы в электрическом поле. Движение ее происходит в жидкой среде, которая удерживается инертным твердым носителем, например, полоской бумаги, гелевой пленкой из крахмала, полиакриламида, декстрона и т.д.
При постоянном напряжении движение заряженной молекулы белка определяется отношением заряда к ее размеру:
m =¦ (Q/r)
где Q-суммарный заряд белковой молекулы;
r-радиус молекулы.
С увеличением этого отношения подвижность молекулы растет. Так как каждый белок имеет свою определенную величину Q/r, скорость перемещения различных белков в электрическом поле будет различной. Электрофорез используется для разделения белков и определения их молекулярных масс.
Применение в определенной последовательности выше перечисленных методов позволяет получить белок в очищенном состоянии, не лишенный, однако, некоторых примесей солей. Для полного очищения белков от низкомолекулярных примесей используются методы диализа, кристаллизации, гельхроматографии и ультрафильтрации.
Является ли полученный белковый препарат индивидуальным белком или смесью имеет важное значение. Всегда можно ожидать, что в составе изолированного белка есть примесь других белков; это может привести к неправильным выводам о свойствах исследуемого белка. Поэтому большое внимание уделяется оценке гомогенности – однородности белков. Критерием чистоты белков служат следующие показатели: получение белка в кристаллическом состоянии; дальнейшая неразделяемость при электрофорезе и ультрацентрифугировании; независимость растворимости от количества твердой фазы; постоянство аминокислотного состава; определенный молекулярный вес; для многих белков – постоянство специфических биологических свойств (ферментативная активность, гормональная активность и т.д.)
1.11 Классификация белковБелки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. При гидролизе сложных белков наряду с аминокислотами образуется вещество небелковой природы – простетическая группа. Классификация простых белков основана на их растворимости.
Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумин пшеницы называют лейкозин, гороха – легумелин. Альбумины содержат все незаменимые аминокислоты.
Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 –10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Многие альбумины и глобулины обладают ферментативным действием.
Проламины. Эта группа белков характерна исключительно для семян злаков. Эти белки растворяются в 60-80%-ом растворе этилового спирта. Эти белки содержат значительные количества пролина и глютаминовой кислот. Лизина они не содержат или содержат его в следовых количествах. Хорошо изучены проламины пшеницы – глиадины, ячменя – гордеин, кукурузы – зеин. Проламины – это комплексы белков различающиеся по составу и молекулярной массе.
Глютелины находятся, как правило, с проламинами. Растворяются они в щелочах (чаще 0,2%-ым NaOH). Глютелины не однородные белки, а смеси разных белков со сходными свойствами. Наиболее исследованы глютелин пшеницы, орезенин риса.
Глютенин и глиадин пшеницы образуют комплекс, который называют клейковиной. Клейковина муки влияет на структурно-механические свойства теста, а, следовательно на качество хлеба.
Протамины – самые низкомолекулярные белки. Встречаются эти белки в молоках рыб. На 2/3 эти белки состоят из аргинина, поэтому имеют основной характер. Протамины не содержат серы.
Гистоны – содержаться в хромосомах клеточных ядер, они участвуют в стабилизации пространственной структуры ДНК. Гистоны на 20-30% состоят из основных аминокислот. Из растворов их осаждают аммиаком.
Протеноиды – подгруппа нерастворимых фибриллярных белков животного происхождения. К ним относятся фиброин – шелка, кератин – волос, рогов, перьев, сухожилий и связок. Характерная особенность протеноидов – высокое содержание в них серы. Эти белки не гидролизуются пищеварительными ферментами.
Протеиды – сложные белки, в которых белок связан с веществом небелковой природы – простетической группой. В зависимости от химической природы простетической группы их делят на липопротеины, гликопротеины, хромопротеины, нуклеопротеины, фосфопротеины, металлопротеины.
В липопротеинах простетическая группа представлена каким-либо липидом. Эти белки входят в состав клеточных мембран, участвуют в структурной организации миелиновых оболочек, нервной ткани, хлоропластов и т.д., а так же присутствуют в свободном состоянии.
Гликопротеины – в качестве простетической группы содержат углеводный компонент. Это могут быть глюкоза, монноза, N-ацетилглюкозамин, L-фукоза и т.д. Эти белки выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное, гормональное, и антивирусное действие.
Типичные представители гликопротеинов – белки, входящие в состав слюны, а так же некоторых растительных слизей. Растительные гликопротеины называют еще лектинами. Некоторые лектины оказывают антипитательное действие – они нарушают процессы всасывания питательных веществ. Антипитательное действие лектинов фасоли твердо установлено.
Хромомпротеины – состоят из простого белка и связанного с ним окрашеного небелкового компонента. Среди хромопротеинов различают гемопротеины, содержащие в качестве простетической группы железо- или магнийпорфирины; флавопротеины – содержащие производные изоаллоксазина. Хромопротеины участвуют в таких функциональных процессах жизнедеятельности, как транспорт кислорода и углекислого газа, фотосинтез, окислительно-восстановительные реакции, свето- и цветовосприятие и т.д. К группе хромопротеинов относятся гемоглобин и его производные, хлорофилсодержащие белки, такие ферменты как каталаза и пероксидаза, сукцинатдегидрогеназа, все белки цитохромы.
Нуклеопротеины – одна из самых важных групп белков, состоящая из простых белков связанных с нуклеиновыми кислотами. Эти белки играют первостепенную роль в хранении и передаче генетической информации и биосинтезе белка и содержаться в основном в ядрах клеток. Дезоксирибонуклеопротеины содержат дезоксирибонуклеиновую кислоту (ДНК). Рибонуклеопротеины содержат рибонуклеиновую кислоту (РНК)
Фосфопротеины – эти белки содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе роста и развития зародышей и молодого растущего организма. Наиболее изучены фосфопротеины – казеин молока, вителлин яичного желтка, ихтулин икры рыб. Металлопротеины наряду с белком содержат ионы какого-либо металла или нескольких металлов. Металлопротеины выполняют различные функции. Например, белок трансферрин (содержит железо) служит физиологическим переносчиком железа в организме. Другие металлопротеины являются биологическими катализаторами-ферментами – амилазы (содержат Са2+) гидролизуют крахмал, карбоангидроза (Zn2+) расщепляет угольную кислоту, аскорбинотоксидаза (Cu2+) разрушает витамин С и т.д.
Похожие работы
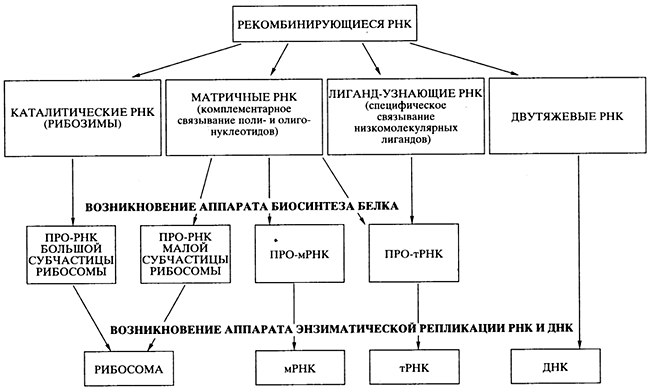
... , образуя вначале нуклеосому, а после гетерохроматин, из которого состоят хромосомы; ü передача наследственного материала происходит путем репликации ДНК; ü реализация наследственной информации в процессе синтеза белка. 5. РНК 5.1. Состав РНК Первые сведения о нуклеотидном составе РНК относились к препаратам, представляющим собой смеси ...
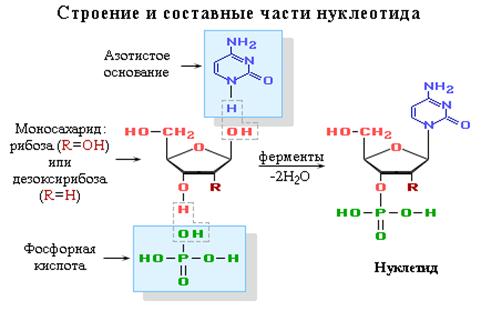
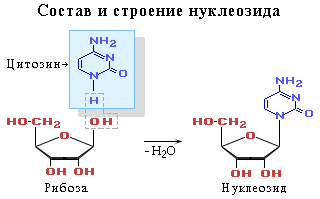
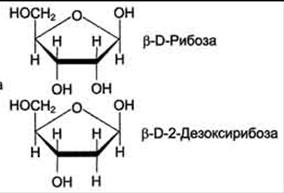
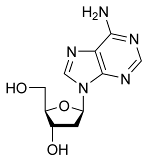
... 7,0 свободные нуклеотиды в клетках находятся главным образом в форме R —рибоза— где R—азотистое основание. Уникальны биохимические функции нуклеотидов. В качестве основных можно отметить следующие: 1) являются строительными блоками нуклеиновых кислот (ДНК и РНК); участвуют в молекулярных механизмах, с помощью которых генетическая информация хранится, реплицируется и транскрибируется; ...
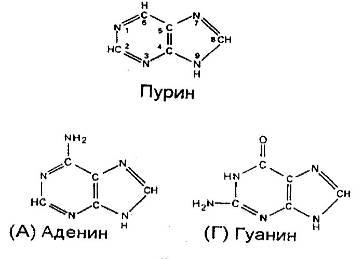
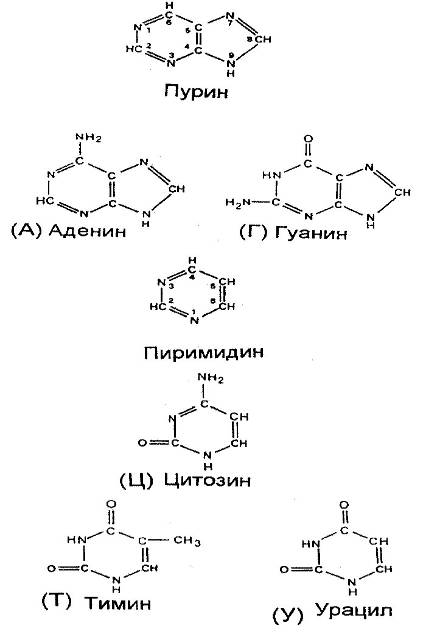
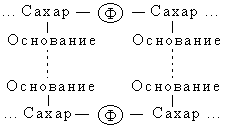
... у него отсутствует метильная группа (CH3). Урацил встречается в ДНК некоторых вирусов, где он выполняет ту же функцию, что и тимин. Трехмерная структура. Важной особенностью нуклеиновых кислот является регулярность пространственного расположения составляющих их атомов, установленная рентгеноструктурным методом. Молекула ДНК состоит из двух противоположно направленных цепей (иногда содержащих ...
... то есть ген, способствующий неограниченному размножению клеток — клетки становятся злокачественными и возникает раковая опухоль. Что современная химия и биохимия умеют делать с нуклеиновыми кислотами Химия и биохимия нуклеиновых кислот не только углубили наши представления об огромной группе важнейших биологических процессов, связанных с сохранением, размножением и использованием наследственной ...


0 комментариев