Навигация
ПАТОЛОГОАНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ
5. ПАТОЛОГОАНАТОМИЧЕСКИЕ ИЗМЕНЕНИЯ
Они неспецифичны и приобретают некоторое диагностическое значение лишь с учетом клинико-эпизоотологических данных.
Макроскопическое исследование.
Наиболее ранняя диагностика бешенства на вскрытии очень важна в целях скорейшего проведения необходимых мероприятий. Хотя патологоанатомическая картина вскрытия животных довольно специфична, но комплекс признаков часто выражен очень слабо, а в некоторых случаях (у убитых животных) они могут полностью отсутствовать. Существует даже на этот счет парадоксальное высказывание, что сам факт отрицательного вскрытия является положительным моментом, чтобы заподозрить бешенство. Безусловно, в этом случае необходимо учитывать клинические и анамнестические данные.
При наружном осмотре трупа животного, павшего от бешенства, обращает па себя внимание синюшность видимых слизистых оболочек (глаз, носа, ротовой полости) и сухость кожи. Нередко отмечают истощение, обнаруживают следы укусов и расчесы. На коже головы и других частей туловища можно обнаружить всевозможные повреждения: раны, царапины, ссадины. Шерсть в области головы и шеи обычно смочена слюной. При вскрытии отмечают застойное полнокровие внутренних органов. Желудок обычно пуст, но у плотоядных в нем могут быть различные несъедобные предметы. Шерсть обычно матовая, взъерошенная. Находят и результаты аутофагии (самопожирание).
Нередко в лабораторию дли диагностики бешенства поступает только голова животного. В этом случае патологоанатомические изменения приобретают особо важное диагностическое значение. Под оболочками мозга и на слизистой боковых желудочков можно обнаружить точечные и полосчатые кровоизлияния, а между оболочками и в желудочках мозга небольшое скопление слабо розовой жидкости. Извилины сглажены, вещество мозга размягчено, сосуды кровенаполнены. Эти макроскопические признаки энцефалита бывают выражены но многих случаях бешенства по-разному, или они проявляются очень ярко, или едва различимы.
Гистологические изменения
головного и спинного мозга характерны для диффузного негнойного энцефаломиелита (гиперемия, мелкие периваскулярные кровоизлияния, пролифёративная реакция со стороны мезенхимы и глии). В цитоплазме нейронов обнаруживают тельца Бабеша — Негри. Эти включения величиной от 0,5 до 30 мкм могут иметь круглую, яйцевидную, грушевидную или треугольную, сигаровидную формы. Основное вещество телец ацидофильно, но в него вкраплены неокрашивающиеся и похожие на вакуоли образования, в которых видны мелкие базофильные гранулы. Такая структура позволяет дифференцировать эти тельца от других внутриклеточных включений. Тельца Бабеша-Негри можно обнаружить в головном и спинном мозге, в ганглионарных клетках слюнных желез и даже вне нервных клеток, например в эпителии роговицы глаз. Частота обнаружения, число и размеры телец зависят от особенностей штамма возбудителя болезни, вида больного животного, продолжительности инкубационного периода и общей продолжительности болезни. Чаще всего включения обнаруживают, если животное погибло при выраженных клинических признаках болезни. При бешенстве, распространяемом лисицами, тельца Бабеша — Негри обнаруживают довольно редко или выявляют единичные мелкие включения.
6. ДИАГНОЗ И ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
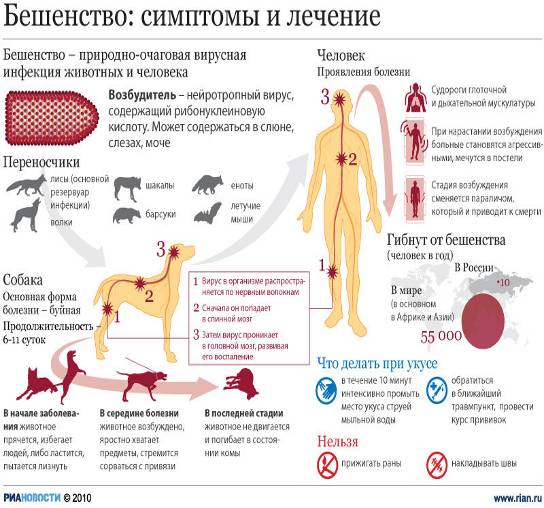
Предварительный диагноз ставят с учетом эпизоотологических и клинических показателей. Принимают во внимание характер эпизоотической ситуации в данной местности и в соседних районах, учитывают сезонность болезни и данные анамнеза, свидетельствующие о нападении или появлении подозрительных по заболеванию диких хищников или собак. Из клинических признаков наиболее важны непровоцируемая агрессивность (при буйной форме болезни), возникновение парезов и параличей, развивающихся в определенной последовательности. Клинико-эпизоотологический диагноз дает основания для немедленного проведения мероприятий, предупреждающих заражение людей и животных, но должен быть подтвержден лабораторными исследованиями. В лабораторию направляют (с нарочным) трупы или головы мелких животных, а от крупных — головы или головной мозг. Труп, голову пересылают в двойных полиэтиленовых мешках, в металлических контейнерах или в другой влагонепроницаемой таре, а мозг (свежий или консервированный 30—50 %-ным глицерином) — в плотно закрытых стеклянных банках. При взятии и упаковке материала обязательно соблюдение мер предосторожности — работа в перчатках, масках, защитных очках, тщательное мытье рук с мылом.
Окончательный диагноз ставится на основе лабораторных исследований образцов материалов от подозреваемых на бешенство животных.
Животное должно быть изолировано и наблюдаем минимум 10 дней. Наблюдение за течением болезни следует проводить до смертельного исхода. Преждевременный убой такого животного может повлиять на точность лабораторного диагноза, так как появление телец Бабеша-Негри в мозгу зависит от продолжительности клинической стадии заболевания. В случае убоя необходимо исключить повреждение мозга, нельзя применять химические яды, так как они могут исказить результаты биологической пробы.
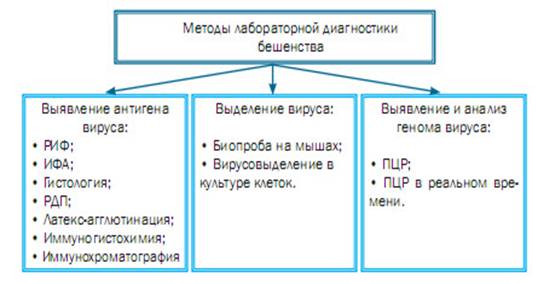
Для лабораторной диагностики бешенства используют методы: гистологический (обнаружение телец Бабеша — Негри), иммунофлюоресценции, биопробы. Предложен и ряд других (иммунопероксидазы ELISA, иммунопреципитации в агаровом геле, реакции вируснейтрализации, РСК и т.д.), но они не превосходят по чувствительности первые три.
В лаборатории проводят микроскопическое исследование мозга для обнаружения телец Бабеша — Негри. Их обнаружения достаточно для подтверждения диагноза. Но при отсутствии этих телец бешенство не исключается. Для выявления рабического антигена используют реакцию преципитации (РП) в агаровом геле. Ее компонентами служат вещество мозга (консервированный глицерином или формалином материал непригоден) и преципитирующий антирабический глобулин. Можно исследовать даже загнивший мозг. Но при отрицательной РП тоже нельзя исключить бешенство — реакция положительна лишь при достаточной концентрации вирусного антигена. Поэтому чаще используют метод флюоресцирующих антител (МФА). При положительном результате он позволяет поставить окончательный диагноз. В мазках-отпечатках из свежего мозга или в отпечатках с роговицы глаз, которые обработаны антирабической сывороткой (глобулином), меченной флюоресцирующим красителем, обнаруживают светящиеся зеленоватые гранулы разной величины. Для реализации МФА необходим люминесцентный микроскоп. Наконец, при необходимости подтверждения наличия или отсутствия вируса в мозге ставят биопробу на белых мышах-сосунах или кроликах. Биопроба остается наиболее надежным методом практической диагностики бешенства. Для идентификации обнаруженного вируса пользуются реакцией нейтрализации на мышах.
В последние годы разработаны новые методы диагностики бешенства.
Радиоиммунный метод основан на связывании меченных радионуклеидом специфических антител с рабическим антигеном в отпечатках мозга с последующим измерением радиоактивности образовавшегося комплекса.
Перспективно использование для экспресс-диагностики иммуноферментного анализа (ИФА) и метода выделения вируса из патологического материала в культуре клеток с последующим применением МФА. Перспективна и идентификация вируса с помощью наборов моноклональных антител.
Дифференциальный, диагноз
Необходимо исключить болезнь Ауески, при которой больные животные неагрессивны, не бывает извращении аппетита, паралича нижней челюсти. У собак исключают нервную форму чумы, отличающуюся затяжным течением, высокой контагиозностыо, возможностью выздоровления больных животных. Бешенство лошадей сходно по клинической картине с инфекционным энцефаломиелитом. Отличия: сильная желтушность слизистых оболочек, отсутствие агрессивности, выздоровление некоторых больных. Подозрение на бешенство может возникнуть при отравлениях, коликах и других незаразных болезнях, для которых характерны сильные боли и беспокойство животных, а также при наличии инородных тел в ротовой полости или глотке, закупорке пищевода. Но в таких случаях не развиваются типичные для бешенства параличи. Однако для точной дифференциации всех этих болезней от бешенства необходимы лабораторные исследования.
ЛЕЧЕНИЕ
В настоящее время нет данных об успешном лечении болезни. Заболевание успешно профилактируется у человека введением антирабической вакцины, т.е., человек не заболевает.
У животных введение антирабических вакцин после укуса тоже разработано (вакцина "Рабикан" из штамма "Щелково-51"), но не практикуется. Заболевших животных немедленно изолируют и убивают, так как их передержка связана с риском заражения людей.
ИММУНИТЕТ И ЗАЩИТА
Одним из основных и эффективных способов предотвращения бешенства является своевременная и эффективная иммунопрофилактика, основанная на использовании антирабических вакцин. С момента создания Л. Пастером первой антирабической вакцины прошло более 100 лет. За это время предложено, апробировано и внедрено в ветеринарную практику множество разных препаратов против бешенства.
Природа антирабического иммунитета недостаточно изучена. Полагают, что вакцинация вызывает биохимические изменения, снижающие чувствительность нервных клеток к вирусу. Несомненная защитная роль вируснейтрализующих антител, продукцию которых активно стимулирует вакцина. Активизируются Т-лимфоциты, ответственные за продукцию интерферона. Таким образом, наиболее вероятно синергическое действие гуморальных и клеточных факторов защиты. При заражении иммунизированных животных особенно велика роль антител, нейтрализующих вирус в местах его внедрения.
Используя принципы изготовления и механизмы действия в организме, все антирабические вакцины условно можно разделить на 4 группы: цельновирионные, субъединичные, рекомбинантные и ДНК-вакцины.
В ветеринарной практике широкое распространение получили живые и инактивированные цельновирионные вакцины на основе вакцинных штаммов вируса бешенства (Paris Pasteur, Pitman-Moore, CVS-27, Kelev, Flury LEP и HEP, SAD, ERA, Внуково-32, Щелково-51 и ТС-80), которые выращивают в первичных (почка собаки, хомяка, поросенка) и перевиваемых [ВНК-21/13, WI-38 (диплоидная), CEF, Vero, линия 4647, MDBK и ПС] линиях клеток.
Практически все антирабические препараты в мире готовят, используя разные сочетания описанных штаммов вируса бешенства и культур клеток.
Из этих двух групп препаратов большее предпочтение отдают инактивированным, поскольку, несмотря на достигнутые успехи, применение живых вакцин в будущем может привести к необходимости защиты животных от массированной агрессии модифицированного природой "вакцинного" вируса бешенства.
С другой стороны, широкое использование инактивированных вакцин стало возможным благодаря успехам биотехнологии, в частности крупномасштабному культивированию вируса бешенства, в первичных и перевиваемых линиях клеток, что позволило конструировать и изготавливать высокоиммуногенные парентеральные препараты.
В настоящее время в Российской Федерации рекомендованы к применению несколько отечественных и зарубежных вакцин.
Одна из первых отечественных разработок - промышленная технология изготовления сухой инактивированной вакцины из фиксированного вируса бешенства, штамм Щелково-51, выращенного в ВНК-21/13 [9]. В 1976-1991 гг. было изготовлено и успешно испытано более 9 млн доз препарата, который при двукратной иммунизации обеспечивает напряженный иммунитет в течение 2 лет. При этом на 14-е сутки титр вируснейтрализующих антител в крови собак превосходит в 17-38 раз минимальный уровень антител, обеспечивающих защиту животных от заражения (0,5 МЕ/мл).
Сегодня Щелковский биокомбинат из штамма Щелково-51 и клеточной системы ВНК-21 выпускает: вакцину антирабическую инактивированную сухую культуральную; вакцину антирабическую инактивированную жидкую культуральную (Рабиков); вакцину антирабическую инактивированную сухую культуральную для собак и кошек (Рабикан).
Изготовляют антирабическую инактивированную культуральную сорбированную вакцину, выпускаемую в жидкой и сухой формах. Разработанная технология позволяет получать материал с высокой инфекционной (7,5-8,0 Ig МЛД /см3) и антигенной активностью (3-5 ME). Для инактивации используют теотропин отечественного производства, который обеспечивает щадящий режим, не изменяя конформационную структуру протективно значимых эпитопов гликопротеина вируса бешенства. Сухая и жидкая вакцина у собак и кошек создавали напряженный антирабический иммунитет, который формировался на 14-21-й день и сохранялся в течение 18 мес, что определяли путем контрольного заражения животных.
ВНИИЗЖ выпускает жидкую и сухую формы антирабической инактивированной культуральной вакцины, изготовленной из штамма Щелково-51, выращенного в суспензионной культуре клеток ВНК-21/17, инактивированного аминоэтилэтиленимином. Сорбирована она на гидроокиси алюминия.
Для иммунизации собак и кошек в Экспериментально-производственном предприятии по производству бактерийных и вирусных препаратов Института полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН разработана антирабическая культуральная концентрированная очищенная инактивированная сухая вакцина, изготовленная из штамма Внуково-32, выращенного в культуре клеток почек сирийского хомяка и инактивированного ультрафиолетовыми лучами.
Для вакцинации собак и кошек на территории нашей страны используют зарубежные антирабические вакцины: Дефенсор-3 (Пфайзер, США); Nobivac Rabies (Intervet, Голландия); Rabisin (Merial, Франция). Данные препараты из пастеровских штаммов вируса бешенства, инактивированного бета-пропилактоном, обеспечивают формирование иммунитета после двукратной вакцинации в течение 3-5 лет.
Кроме антирабических моновакцин применяют комбинированные мультивалентные препараты против разных возбудителей инфекционных болезней, что ведет к расширению стратегий иммунопрофилактики и значительно упрощает календарь прививок. Данные вакцины используют для иммунизации собак и кошек. Так в антирабическую вакцину для собак включены антигены возбудителей чумы и гепатита собак, лептоспироза и парвовироза плотоядных, а в комбинированные антирабические вакцины для кошек - антигены вируса панлейкопении кошек, калицивируса и парвовируса кошачьих. Установлена высокая иммуногенная потенция вакцины против парвовирусного энтерита и чумы собак, содержащей инактивированный вирус бешенства, штамм Щелково-51.
С 1999 г. на территории России применяют отечественную вакцину против чумы плотоядных, парвовирусного энтерита, инфекционного гепатита, аденовироза, лептоспироза и бешенства собак БИОРАБИК. [1]
Следующим типом антирабических вакцин являются субъединичные препараты, которые безопасны (не содержат вируса) и свободны от балластных белков. Однако из-за низкой иммуногенной активности и высокой стоимости их использование ограничено.
Успехи в области клонирования и экспрессии генов привели к созданию рекомбинантных вакцин против бешенства, которые просты в изготовлении, устойчивы во внешней среде и индуцируют напряженный иммунитет. Применение рекомбинантного вируса исключает попадание во внешнюю среду потенциально опасного генома вакцинного вируса бешенства.
Наибольшее распространение рекомбинантные препараты получили при пероральной вакцинации диких плотоядных. Хотя использование антигенов разных серотипов вируса бешенства позволяет изготовлять мультивалентные вакцины для парентерального введения. Так, использование вектора, несущего участки гликопротеинов серотипов 1 и 5, позволило создавать активный иммунитет к этим серотипам вируса бешенства.
Рекомбинантные вакцины широко применяют во многих странах мира как экологически наиболее безопасные для борьбы с бешенством диких плотоядных.
Относительно новой вехой рабиологической вакцинологии является разработка ДНК-вакцин, представляющих собой плазмидную ДНК, в которую встроен ген гликопротеина вируса бешенства. Преимущества этих препаратов: стабильность, высокая степень очистки, отсутствие балластных белков и контаминации посторонними агентами и индуцирование у животных системного и местного иммунитета. Двукратная внутримышечная вакцинация собак плазмидной ДНК, экспрессирующей гликопротеин вируса бешенства, защищает животных от контрольного заражения вирулентным штаммом вируса бешенства.
Еще одним важным преимуществом ДНК-вакцины является возможность встраивания в ДНК плазмиды гликопротеинов нескольких лиссавирусов, что позволяет повысить степень защиты против нескольких серотипов вируса бешенства. Эффективность иммунизации животных ДНК-вакцинами очевидна, однако потребуется еще много усилий для практической реализации нового подхода к профилактике бешенства.
Таким образом, несмотря на различные типы, современные вакцины позволяют формировать напряженный иммунитет, даже при однократном введении препаратов (ДНК-вакцина, рекомбинантная и инактивированная вакцины) титр антител спустя 540 дней составляет не менее порогового уровня (0,5 МЕ/мл).
Одним из важнейших факторов иммунопрофилактики является способ инъецирования антигена, для этого на протяжении длительного времени использовали подкожный метод введения антирабических препаратов. Однако установлено, что после внутрикожной и подкожной иммунизации мышей и овец инактивированными вакцинами у животных формируются антирабические вируснейтрализующие антитела с практически идентичной активностью. Полученные данные подтвердили связь между вводимым антигеном и центральной нервной системой, которая проявлется усилением иммунного ответа при инъецировании антирабической вакцины в места, богатые нервными окончаниями.
В настоящее время проблемы иммунизации пушных животных сохраняются, поэтому актуально использование внутрикожного введения антигена с помощью безыгольного инъектора, которое позволит существенно уменьшить материальные затраты при высокой иммунологической эффективности.
Таким образом, в распоряжении ветеринарной практики имеются разные типы антирабических препаратов, обеспечивающие защиту животных от летальной инфекции, однако наибольшее распространение получили инактивированные вакцины. Они высокоэффективны, обладают экономически обоснованной простой технологией изготовления. Использование описанных препаратов и внутрикожное их применение способствует снижению напряженности эпизоотической ситуации по бешенству в Российской Федерации.
В России на сегодняшний день рынок антирабических вакцин велик, как отечественные, так и импортные вакцины прошли обязательную сертификацию и признаны эффективными и годными для применения в Российской Федерации.
Отечественные вакцины против бешенства для животных представлены фирмами:
Щелковский биокомбинат - вакцина "Рабикан" для всех видов животных
Ветзвероцентр - вакцина "Дивак" для собак
Нарвак - вакцина "Мультикан" для собак, вакцина "Астерион" для собак
Вакцины зарубежных производителей:
Intervet (Голландия) - вакцина Nobivac R
Merial (Франция) - вакцина Eurican, Hexadog
Pfiser (Канада) - вакцина Defensor
Все эти вакцины создают напряженный иммунитет в течение не менее одного года, прекрасно зарекомендовали себя за время их применения.
Прививать собак и кошек против бешенства - обязанность владельцев домашних животных по Закону (Закон "О ветеринарии", Ветеринарное Законодательство РФ).
Похожие работы
... антигенной структурой.) Наряду с этим установлено существование естественных биовариантов вируса бешенства. Биоварианты вируса бешенства различаются по степени патогенности при внемозговом заражении, распределению в органах зараженных животных, способности формировать включения. Вирусы подобные возбудителю бешенства, имеют частичное антигенное с ним родство, а также сходный тип репродукции, но ...
... кошки стремятся, так же как и собаки, убежать из дома. В дальнейшем развивается паралич глотки и конечностей. Смерть наступает через 2...5 дней после проявления клинических признаков. При паралитическом бешенстве агрессивность выражена слабо. Лисицы при заболевании настораживают необычным поведением: они теряют чувство страха, нападают на собак, сельскохозяйственных животных, людей. Больные ...
... флюоресцирующих антител на отпечатках с роговицы или биоптатах кожи, однако в клинической практике это трудновыполнимо, и диагноз основывают на клинических проявлениях заболевания. Лечение и профилактика При подозрении на бешенство животное необходимо надежно изолировать (закрыть в будке или отдельном помещении) и сообщить о случившемся специалистам ветеринарной службы. Покусанные или ...
... рабиологи профессора Р.М.Шен, К.А.Ванаг, М.А.Селимов; сейчас работает только профессор С.В.Грибенча. (Исключение составляет Омский НИИ природно-очаговых инфекций, где ведутся интенсивные исследования по бешенству применительно к региону Сибири.) Затраты на постэкспозиционную профилактику одного пациента за рубежом составляют от 2 до 3 тысяч долларов, у нас - ориентировочно 300 рублей. Не трудно ...
0 комментариев