План
Введение
История
Физические свойства и нахождение в природе
Химические свойства
Способы получения одноосновных карбоновых кислот ароматического ряда
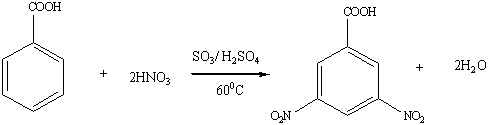
Нитробензойные кислоты
Применение
Заключение
Список литературы
Введение
Систематическое наименование бензойная кислота
Традиционные названия бензойная кислота
Химическая формула C6H5COOH
Молярная масса 122.12 г/моль
Физические свойства
Состояние (ст. усл.) твердая
Термические свойства
Температура плавления 122.4 °C
Температура кипения 249.2 °C
Температура разложения 370 °C
Удельная теплота парообразования 527 Дж/кг
Удельная теплота плавления 18 Дж/кг
Химические свойства
Растворимость в воде 0,001 г/100 мл
Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические.
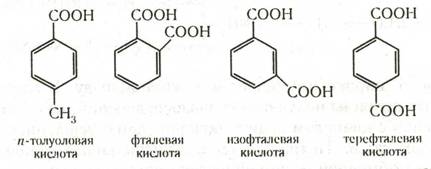
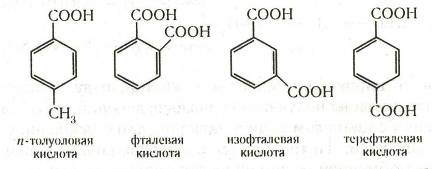
Ароматические кислоты могут быть разделены по количеству карбоксильных групп на одно-, двух- и более основные. Названия кислот, у которых карбоксильная группа непосредственно связана с ядром, производятся от ароматических углеводородов. Названия кислот с карбоксилом в боковой цепи производятся обычно от наименований соответствующих кислот жирного ряда. Наибольшее значение имеют кислоты первого типа: например, бензойная (бензолкарбоновая) С6Н5—СООН, п-толуиловая (п-толуолкарбоновая), фталевая (1,2-бензолдикарбоновая), изофталевая (1,3-бензолдикарбоновая), терефталевая (1,4-бензолдикарбоновая):
История
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Blaise de Vigenère (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Сульфосалициловая кислота
2-Окси-5-сульфобензойная кислота
HO3S(HO)C6H3COOH ·2H2O M 254,22
Описание
Сульфосалициловая кислота представляет собой бесцветные полупрозрачные кристаллы игольчатой формы или белый кристаллический порошок.
Сульфосалициловая кислота легко растворима в воде, спирте и эфире, нерастворима в бензоле и хлороформе, светочувствительна. Водные растворы имеют кислую реакцию.
Применение
Сульфосалициловая кислота применяется в медицине для качественного определения белка в моче, при проведении аналитических работ для определения содержания нитратов в воде.
В промышленности сульфосалициловая кислота используется в качестве добавок к основному сырью, при синтезе веществ.
Физические свойства и нахождение в природе
Монокарбоновые кислоты ряда бензола — бесцветные кристаллические вещества с температурой плавления выше 100 °С. Кислоты с пара-положением заместителей плавятся при значительно более высоких температурах, чем их изомеры. Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. Монокарбоновые кислоты довольно плохо растворяются в холодной воде и значительно лучше в горячей. Низшие кислоты летучи с парами воды. В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6·10-5 , уксусной кислоты 1,8·10-5. При 370С она разлагается до бензола и СО2 (в небольшом количестве образуются фенол и СО). При взаимодействии с бензоилхлоридом при повышенных температурах бензойная кислота превращается в бензойный ангидрид. Бензойная кислота и ее эфиры содержатся в эфирных маслах (например, в гвоздичном, толуанском и перуанском бальзамах, бензойной смоле). Производное бензойной кислоты и глицина – гиппуровая кислота – продукт жизнедеятельности животных.Кристаллизуется в виде бесцветных пластинок или игл, плавящихся при 121 оС, легко растворимых в спирте и эфире, но трудно растворимых в воде. В настоящее время бензойная кислота довольно широко применяется в промышленности красителей. Бензойная кислота обладает антисентическими свойствами и поэтому используется для консервирования пищевых продуктов. Значительное применение находят также различные производные бензойной кислоты.
Химические свойства
Бензол был открыт Фарадеем в 1825 г. и была установлена его брутто-формула-С6Н6. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5. Этой формулой пользуются и в настоящее время, хотя она, как позднее будет показано, несовершенна - не отвечает полностью свойствам бензола.
Наиболее характерной особенностью химического поведения бензола является удивительная инертность двойных углерод-углеродных связей в его молекуле: в отличие от рассмотренных; ранее непредельных соединений он устойчив к действию окислителей (например, перманганата калия в кислой и щелочной среде, хромового ангидрида в уксусной кислоте) и не вступает в обычные реакции электрофильного присоединения, характерные для алкенов, алкадиенов и алкинов.
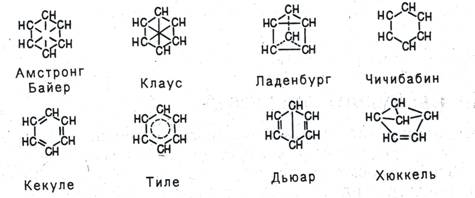
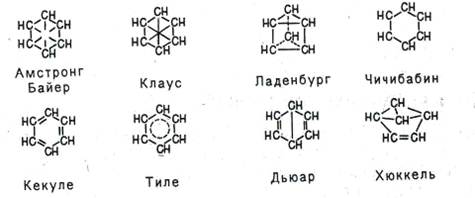
Пытаясь объяснить свойства бензола особенностями строения, многие ученые вслед за Кекуле выдвигали по этому поводу свои гипотезы. Поскольку непредельность бензола явно не проявлялась, считали, что двойных связей в молекуле бензола нет. Так, Армстронг и Байер, а также Клаус предположили, что в молекуле бензола четвертые валентности всех шести атомов углерода направлены к центру и насыщают друг друга, Ладенбург - что углеродный скелет бензола представляет собой призму, Чичибабин - что в бензоле углерод трехвалентен.
Тиле, усовершенствуя формулу Кекуле, утверждал, что двойные связи в последнем не фиксированы, а постоянно перемещаются-«осциллируют», а Дьюар и Хюккель предложили структурные формулы бензола с двойными связями и малыми циклами.
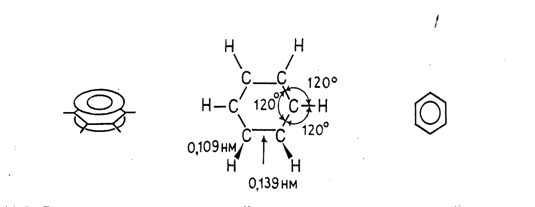
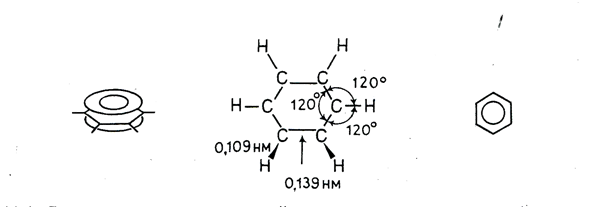
В настоящее время на основании данных многочисленных исследований можно считать твердо установленным, что шесть углеродных и шесть водородных атомов в молекуле бензола находятся в одной плоскости и что облака π-электронов атомов углерода перпендикулярны плоскости молекулы и, следовательно, параллельны друг другу и взаимодействуют между собой. Облако каждого π-электрона перекрывается облаками π-электронов соседних углеродных атомов. Реальная молекула бензола с равномерным распределением π-электронной плотности по всему кольцу может быть представлена в виде плоского шестиугольника, лежащего между двумя торами.
Отсюда следует, что формулу бензола логично изображать в виде правильного шестиугольника с кольцом внутри, подчеркивая тем самым полную делокализованность π-электронов в бензольном кольце и равноценность всех углерод-углеродных связей в нем. Справедливость последнего заключения подтверждена, в частности, результатами измерения длин С—С-связей в молекуле бензола; они одинаковы и равны 0,139 нм (С—С-связи в бензольном кольце короче ординарных (3,154 нм), но длиннее двойных (0,132 нм)). Распределение электронной плотности в молекуле бензола; длины связей, валентные углы
Очень важным производным бензойной кислоты является ее хлорангидрид — хлористый бензоил. Это жидкость с характерным запахом и сильным лакриматорным действием. Используется как бензоилирующий агент.
Пероксид бензоила используется как инициатор для реакций полимеризации, а также как отбеливающий агент для пищевых масел, жиров, муки.
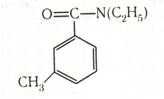
Толуиловые кислоты. Метилбензойные кислоты называют толуиловыми кислотами. Они образуются при частичном окислении о-, м- и п-ксилолов. NN-Диэтил-м-толуилмид является эффективным репеллентом — препаратом, отпугивающим насекомых:
п-трет-Бутилбензойную кислоту получают в промышленных масштабах жидкофазным окислением трет-бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Фенилуксусную кислоту получают из хлористого бензила через нитрил или через магнийорганические соединения. Это кристаллическое вещество с т. пл. 76 °С. Благодаря подвижности подородных атомов метиловой группы легко вступает в реакции конденсации. Эта кислота и ее эфиры применяются в парфюмерии.
Ароматические кислоты вступают во все те реакции, которые свойственны и кислотам жирного ряда. Реакциями с участием карбоксильной группы получают различные производные кислот. Соли получают действием кислот на карбонаты или щелочи. Эфиры — нагреванием смеси кислоты и спирта в присутствии минеральной (обычно серной) кислоты:
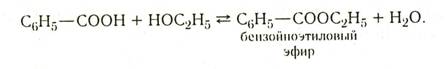
Если заместителей в орто-положении нет, то этерификация карбоксильной группы происходит так же легко, как в случае алифатических кислот. Если одно из орто-положений замещено, скорость этерификации сильно уменьшается, а если оба орто-положения заняты, этерификация обычно не идет (пространственные затруднения).
Эфиры орто-замещенных бензойных кислот могут быть получены реакцией солей серебра с галогеналкилами (эфиры пространственно затрудненных ароматических кислот легко и количественно омыляются в присутствии краун-эфиров). Вследствие пространственных затруднений они с трудом подвергаются гидролизу. Группы большие, чем водород, в такой степени заполняют пространство вокруг углеродного атома карбоксильной группы, что затрудняют образование и омыление эфира.
Получение С6Н5СООН:
Основные способы:
1. Путем окисления самых различных производных бензола, имеющих одну боковую цепь, например, толуола, этилбензола, бензилового спирта и т.д.: С6Н5СН3 ® С6Н5СООН
2. Из бензонитрила, который для этого гидролизуют кислотой или щелочью: 2Н2 О С6Н5СN ¾¾® С6Н5СООН + NH3
Бензойная (или росноладанная), Acidum benzoicum sublimatum, Flores Benzoës — весьма распространенное в природе вещество состава С7Н6О2, или С6Н5—СООН; содержится в некоторых смолах, бальзамах, в травянистых частях и в корнях многих растений (согласно прежним, до сих пор не проверенным наблюдениям), а также в цветах Unona odoratissima (в эссенции алан-жилан, или иланг-иланг), в бобровой струе, а главным образом в бензойной смоле, или росном ладане, откуда и ее название. О продуктах сухой перегонки этой смолы есть указания еще в сочинениях, относящихся к XVI ст.; Blaise de Vigenère в своем трактате (1608 г.) "Traité du feu et du sel" первый упоминает о кристаллическом веществе из бензойной смолы, которое впоследствии было исследовано ближе и получило название Flores benzoës. Состав его окончательно установлен Либихом в 1832 г., а Кольбе предложил рассматривать его как фенилкарбоновую кислоту. Б. кислота может быть получена из бензола синтетически и образуется при многих реакциях, совершающихся с телами ароматического ряда. Для фармацевтических надобностей пользуются исключительно кислотой, добытой посредством возгонки бензойной смолы. Лучше всего для этой цели брать сиамский росной ладан, так как в нем нет коричной кислоты, или калькуттский, более дешевый и также содержащий много Б. кислоты. Измельченную смолу слегка подогревают на песчаной бане в железных котелках, при чем масса сначала плавится, а затем выделяет тяжелые пары Б. кислоты, которые садятся на холодных частях прибора в виде кристаллов. Чтобы собрать вещество, котелок прикрывают бумажным конусом или крышкой с широкой трубкой, по которой пары отводят в деревянный ящик, оклеенный бумагой. По окончании операции (причем следует по возможности избегать сильного подогревания) кислота остается в приемнике или на бумажном конусе в виде снежно-белых кристаллов или хлопьев. Полученный этим путем препарат имеет явственный запах ванили, что зависит от содержания в смоле небольшого количества эфирного масла. Лучших выходов можно достигнуть, настаивая продолжительное время тонкоизмельченную смолу с известковым молоком или содой. Смесь затем нагревают до плавления смолы, и из образующейся бензойнокислой соли выделяют вещество соляной кислотой. Полученная таким способом кислота имеет более слабый запах, чем та, которая получается возгонкой. Для технических целей как исходный материал берут гиппуровую кислоту (см. это сл.), содержащуюся в моче травоядных. Мочу быстро выпаривают до ⅓ первоначального объема, фильтруют и обрабатывают избытком соляной кислоты, причем гиппуровая кислота выделяется в кристаллическом виде. По прошествии суток кристаллы отделяют от маточного раствора и очищают повторной кристаллизацией, пока почти вовсе не исчезнет упорно удерживающийся запах мочи. Очищенную гиппуровую кислоту кипятят с соляной кислотой, при чем происходит расщепление на Б. кислоту и гликокол:
HOOC—CH2[NH(C7H5O)] + H2O = HOOC—CH2(NH2) + C6H5—COOH.
В больших количествах Б. кислоту можно получать из толуола С6Н5—СН3, окисляя его азотной кислотой; но выгоднее (как и практикуется на заводах) брать для этой цели не толуол, а хлористый бензенил С6Н5CCl3; этот последний нагревают с водой в герметически закрытых сосудах; образующаяся таким путем кислота упорно удерживает галоидозамещенные продукты. Далее, Б. кислоту получают нагреванием известковой соли фталевой кислоты с едкой известью; наконец, значительные количества ее остаются в виде побочного продукта при фабрикации масла горьких миндалей вследствие окисления последнего. Добытую тем или другим путем Б. кислоту очищают перекристаллизацией из горячей воды; обесцвечивание растворов производится посредством обработки животным углем или нагреванием со слабой азотной кислотой. Синтетически бензойную кислоту получил Кекуле, действуя угольной кислотой на бромбензол в присутствии металлического натрия:
C6H5Br + 2Na + CO2 = C6H5CO2Na + NaBr.
Фридель и Крафтс приготовили ее прямо из бензола и угольной кислоты в присутствии хлористого алюминия. Чистая Б. кислота представляет бесцветные одноклиномерные иглы или таблички, уд. веса 1,2 (при 21°), не изменяющиеся на свету, тогда как полученная сублимацией из росного ладана желтеет спустя некоторое время вследствие разложения содержащегося в ней эфирного масла. Вещество плавится при 121,°4 Ц., кипит при 249°,2 без разложения и возгоняется ниже температуры кипения; не имеет запаха. Пары его действуют раздражающим образом на слизистые оболочки дыхательных органов. С парами воды кислота летит уже ниже 100°, а потому водные растворы ее нельзя сгущать посредством выпаривания. 1000 ч. воды растворяют при 0° 1,7 вес. ч., а при 100° 58,75 ч. Б. кислоты. Так же хорошо растворима она в алкоголе, эфире, хлороформе, эфирных и жирных маслах. Некоторые примеси, даже в очень незначительных количествах, настолько резко изменяют ее физические свойства, что одно время признавали существование изомерной Б. кислоты и называли ее салиловой кислотой, но оба вещества оказались вполне тождественными (Бейльштейн). При пропускании паров через сильно нагретую пемзу или, лучше, при сухой перегонке с едким баритом или гашеной известью Б. кислота распадается на бензол и углекислый газ. При сплавлении с едким кали получаются наряду с другими продуктами все три оксибензойные кислоты; окислители действуют на нее довольно трудно. С амальгамой натрия образуются: бензойный альдегид, бензильный алкоголь и другие продукты сложного состава. Хлор и бром, а также иод в присутствии иодноватой кислоты действуют замещающим образом; дымящаяся азотная кислота дает нитробензойные, а дымящаяся серная — сульфобензойные кислоты. Вообще, водороды фенильной группы в Б. кислоте один за другим могут быть замещены различными остатками, причем образуется громадное число разнообразнейших соединений, из которых для многих известно по нескольку изомерных форм. Из производных Б. кислоты, образующихся через замещение в карбоксильной группе, простейшие будут следующие:
Хлористый бензоил, хлорангидрид Б. кислоты, C6H5—COCl получен впервые Либихом и Вёлером в 1832 г. при обработке сухим хлором масла горьких миндалей; он образуется также при действии пятихлористого или треххлористого фосфора на бензойную кислоту или хлорокиси фосфора на бензойнонатровую соль. Бесцветная жидкость с резким запахом, уд. веса 1,324 (при 0°), кипящая при 198°; затвердевает в охладительной смеси в кристаллы (плав. при —1°). Горячей водой быстро разлагается на соляную и Б. кислоты; легко вступает в двойные разложения с целым рядом веществ; так, при действии аммиака Либих и Вёлер получили из него бензамид, или амид Б. кислоты, C6H5—CONH2, кристаллическое вещество, плавящееся при 128°, уд. веса 1,341 (при 4°), растворимое в горячей воде, алкоголе и эфире. Бензамид получается также при нагревании Б. кислоты с роданистым аммонием. Водоотнимающие вещества с легкостью переводят его в нитрил Б. кислоты, бензонитрил или цианистый фенил — C6H5CN. Этот последний получается также из калийной соли сульфобензойной кислоты и цианистого калия. Вещество представляет жидкость с горькоминдальным запахом, кипящую при 190°, уд. веса 1,023 (при 0°), застывающую при сильном охлаждении в твердую массу. Трудно растворим в кипящей воде и легко в спирте и эфире.
Способы получения одноосновных карбоновых кислот ароматического ряда
Одноосновные карбоновые кислоты ароматического ряда могут быть получены всеми общими способами, известными для кислот жирного ряда.
Окисление алкильных групп гомологов бензола. Это один из наиболее часто применяемых способов получения ароматических кислот:
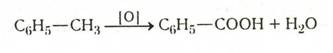
Окисление проводят либо при кипячении углеводорода с щелочным раствором перманганата калия, либо при нагревании в запаянных трубках с разбавленной азотной кислотой. Как правило, этот метод дает хорошие результаты. Осложнения бывают только в тех случаях, когда при действии окислителей разрушается бензольное кольцо.
Окисление ароматических кетонов. Ароматические кетоны легко получаются реакцией Фриделя — Крафтса. Окисление обычно ведут с помощью гипохлоритов по схеме:
![]()
Однако могут быть использованы и другие окислители. Ацетопроизводные окисляются легче, чем углеводороды.
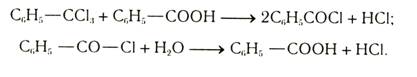
Гидролиз тригалогенопроизводных с галогенами у одного углеродного атома. При хлорировании толуола образуется три вида хлоропроизводных: хлористый бензил (идет для получения бензилового спирта), хлористый бензилиден (для получения бензойного альдегида), бензотрихлорид (перерабатывается в бензойную кислоту и в хлористый бензоил). Непосредственный гидролиз бензотрихлорида идет плохо. Поэтому бензотрихлорид нагреванием с бензойной кислотой превращают в хлористый бензоил, который далее при гидролизе легко дает бензойную кислоту:
Гидролиз нитрилов:
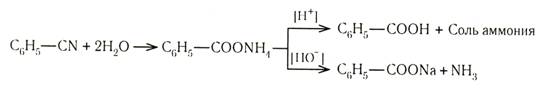
Этот способ широко применяется в жирном ряду. В ароматическом ряду исходные нитрилы получают из диазосоединений, из галогенопроизводных обменом с цианидом меди в пиридине или сплавлением сульфонатов с цианидом калия. Нитрилы кислот с нитрильной группой в боковой цепи получают обменной реакцией из галогенопроизводных.
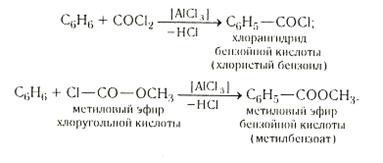
Реакция ароматических углеводородов с галогенопроизводными угольной кислоты
Карбоксильную группу можно ввести в ядро посредством реакции, аналогичной синтезу кетонов по Фриделю — Крафтсу. Катализатором служит хлорид алюминия:
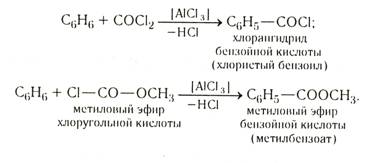
Реакции металлорганических соединений с СО2:
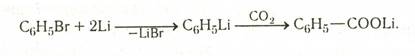
Обычно используются литий- или магнийорганические соединения.
Хлорангидриды получают действием на кислоты хлористого тионила или пентахлорида фосфора:
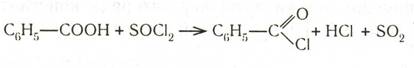
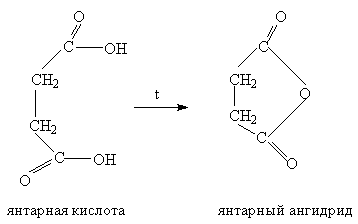
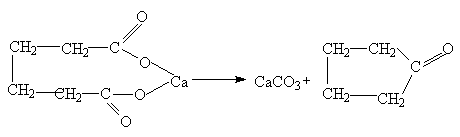
Ангидриды получают перегонкой смеси кислоты с уксусным ангидридом в присутствии фосфорной кислоты или действием хлорангидридов на соли:
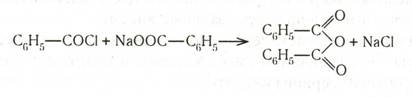
При действии хлористого бензоила на пероксид натрия получается кристаллический пероксид бензоила:
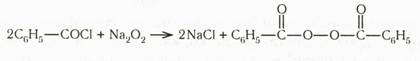
При действии алкоголята на пероксид бензоила получается соль надбензойной кислоты (гидропероксид бензоила). Эта кислота применяется для получения оксидов из непредельных соединений (реакция Прилежаева):
![]()
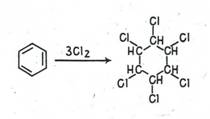
Бензол в отсутствие катализатора не реагирует с бромом и хлором, демонстрируя тем самым устойчивость трех двойных связей в его молекуле к действию электрофильных агентов. В то же время наличие последних подтверждается взаимодействием бензола с хлором при облучении, приводящим к образованию гексахлорциклогексана (гексахлоран):
Интересная реакция с участием двойных связей наблюдается при облучении бензола в жидкой фазе светом с длиной волны 253,7 нм. В этих условиях молекула бензола перестраивается, превращаясь в так называемые валентные изомеры.
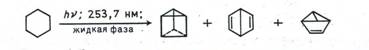
Нитробензойные кислоты
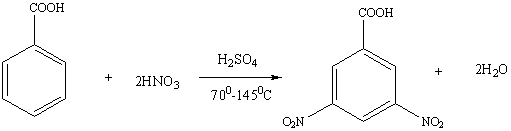
При нитровании бензойной кислоты получается 78%-мета-, 20% орто- и 2% пара-нитробензойных кислот. Два последних изомера без примесей других изомеров получают окислением орто- и пара- нитротолуолов.
Нитробензойные кислоты обладают более сильными кислотными свойствами, чем бензойная кислота (К = 6,6·10-5): о-изомер — в 100 раз, м-изомер — в 4,7 раза и п-изомер — в 5,6 раза. Аналогичная закономерность наблюдается и в случае галогенозамещенных кислот.
Применение
Бензойная кислота и ее соли обладают высокой бактерицидной и бактериостатической активностью, резко возрастающей с уменьшением рН среды. Благодаря этим свойствам, а также нетоксичности бензойную кислоту применяют:
консервант в пищевой промышленности (добавка 0,1% кислоты к соусам, рассолам, фруктовым сокам, джемам, мясному фаршу и др.)
в медицине при кожных заболеваниях как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а её натриевую соль – как отхаркивающее средство.
Кроме того, бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213). Эфиры бензойной кислоты (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные бензойной кислоты, например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей.
Бензойную кислоту используют в производстве
фенола
капролактама
бензоилхлорида
добавка к алкидным лакам, улучшающая блеск, адгезию, твердость и химическую стойкость покрытия
Большое практическое значение имеют соли и эфиры бензойной кислоты (бензоаты).
Бензоат натрия консервант пищевых продуктов, стабилизатор полимеров, ингибитор коррозии в теплообменниках, отхаркивающее средство в медицине.
Бензоат аммония – антисептик, консервант в пищевой промышленности, ингибитор коррозии, стабилизатор в производстве латексов и клеев.
Бензоаты переходных металлов – катализаторы жидкофазного окисления алкилароматических углеводородов в бензойную кислоту.
Сложные эфиры бензойной кислоты от метилового до изоамилового – душистые вещества. Метилбензоат – растворитель эфиров целлюлозы.
Изоамилбензоат – компонент фруктовых эссенций.
Бензилбензоат – фиксатор запаха в парфюмерии, растворитель душистых веществ, антисептик, репеллент от моли.
Меры предосторожности:
При попадании на кожу вызывает раздражения.
Вдыхание аэрозоля вызывает судорожный кашель, насморк, иногда тошноту и рвоту.
Заключение
Латинское название: Acidum benzoicum
Бензойная кислота C6H5СООН – простейшая одноосновная карбоновая кислота ароматического ряда.
Бензойная кислота – бесцветные кристаллы, плохо растворимые в воде, хорошо – в этаноле и диэтиловом эфире.
Используется в основном в виде натриевых (большая растворимость в воде)- Бензонат натрия, калиевых и кальциевых солей.
Температура плавления - 122.4°С,
Температура кипения - 249°С.
Легко возгоняется(один из способов получения- сухая перегонка смолы бензоина); перегоняется с водяным паром.
Бензойную кислоту (Б.к) применяют в медицине при кожных заболеваниях как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а её натриевую соль – как отхаркивающее средство.
Б. к. и ее соли обладают высокой бактерицидной и бактериостатической активностью, резко возрастающей с уменьшением рН среды.
Возможна реакция с некоторыми формами аскорбиновой кислоты (витамина С).
В организме бензойная кислота соединяется с глицином, образуя безвредную гиппуровую кислоту, которая выводится с мочой.
Допустимая доза бензойной кислоты и ее соли для человека - 5 мг/кг веса тела в день.
Концентрация рецептах: 0,2-0,5 % (на 50 г крема - 0,2 г бензоата натрия).
Активность бензойной кислоты падает в присутствии неионных ПАВ, белков и глицерина.
Используется совместно с другими консервантами.
Будучи растворима в жирах, она может применяться как консервант жиров, губных помад и т.д. Максимальная концентрация в косметических изделиях составляет 0,5 %.
Соли бензойной кислоты – бензоаты (например, бензноат натрия) тоже используются как консерванты.
Другое применение: Эфиры бензойной кислоты, обладающие сильным запахом, применяют в парфюмерной промышленности.
Различные производные бензойной кислоты, например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей.
Б. к. и ее эфиры содержатся в эфирных маслах (например, в гвоздичном), толуанском и перуанском бальзамах, бензойной смоле(до 20% кислоты и до 40% ее сложных эфиров).
Дополнительная информация:
На практике чаще всего используют водные растворы бензоата натрия с концентрацией от 5 до 25%.
Для приготовления раствора нужное количество консерванта растворяют приблизительно в половине требуемого объема питьевой воды, нагретой до 50…80С. После полного растворения соли в полученный раствор добавляют оставшуюся воду и тщательно перемешивают. Рекомендуется отфильтровать раствор через слой хлопчатобумажной ткани (бязи). Если консервант растворен в жесткой воде, то раствор может быть слегка мутным, но это не влияет на его консервирующее действие.
При разработке конкретной рецептуры внесения консерванта в продукт необходимо учитывать следующее:
кислотность среды влияет на эффективность консервантов - чем более кислую реакцию имеет продукт, тем меньше в него требуется добавить консерванта;
как правило, продукты пониженной калорийности имеют высокое содержание воды и легко подвергаются порче, поэтому количество добавляемого к ним консерванта должно быть на 30-40% больше, чем рекомендуется для обычных продуктов;
добавка спирта, большого количества сахара или другого вещества, проявляющего консервирующие свойства, снижает требуемое количество консерванта.
Литература
1 Земцова М.Н. Методические указания к выполнению курсовой работы по органической химии.
2. Химические реактивы и препараты Госхимиздат 1953, Стр. 241-242.
3. Карякин Ю.В., Ангелов И.И. Чистые химические вещества Изд. 4-е, пер. и доп. М.: Химия 1974, Стр. 121-122.
4. «Краткая химическая энциклопедия» Изд. Советская энциклопедия, Т.4 М. 1965 Стр. 817-826.
5. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов. – СПб: «Иван Фёдоров», 2002, Стр. 421-427.
6. Гитис С.С., Глаз А.И., Иванов А.В.Практикум по органической химии: -М.: Высш шк., 1991. - 303.: ил.
7. Шабаров Ю.С. Органическая химия: Учебник для вузов в 2-х кн. – М.: Химия, 1996.Стр. 558-561, 626-629.
Похожие работы
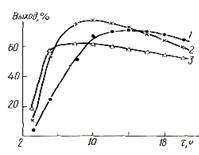
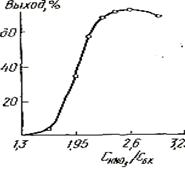
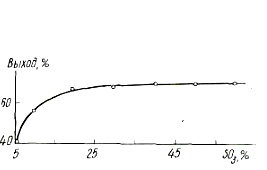
... операционный баланс будет равен суточному балансу. Производительность проектируемого производства составляет 13 тонн/год. Предполагается, что проектируемое производство будет работать 237 дней в году. Из этих данных определяем суточную производительность проектируемого объекта: т готовой динитробензойной кислоты. Таблица №12 Операционный материальный баланс стадии нитрования Приход кг ...
... продуктов. Сложные эфиры Б. к. (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные Б. к., например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей. Эталон в калориметрии; основное вещество для установки титра щелочей; для бензилирования в органическом анализе; растворитель при определении молекулярного ...
... смол и сополимеров со стиролом, акриловым и метакриловым эфирами. Гидратацией малеинового ангидрида получают яблочную кислоту, применяемую в пищевой промышленности. Монокарбоновые кислоты ароматического ряда Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с ароматическим ядром. Кислоты, содержащие карбоксильные ...
... на їх основі лікарських субстанцій”, 16 – 17 бер. 2006 р. – Х.: 2006. Анотація Арзуманов П.С. “Синтез похідних 3-аміно-4-оксо-3,4-дигідрохіназоліну на основі антранілоїлгідразиду та дикарбонових кислот; їх хімічні перетворення та біологічна активність”. – Рукопис. Дисертація на здобуття вченого ступеня кандидата фармацевтичних наук за спеціальністю 15.00.02 – фармацевтична хімія та ...
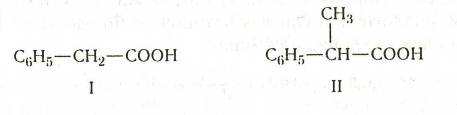


0 комментариев