Навигация
Исследование поверхностного натяжения растворов ТХУ
2.2.2 Исследование поверхностного натяжения растворов ТХУ
Поверхностное натяжение растворов ТХУ определяли методом стологмометрии (истечения жидкости через капилляр; d=0,54мм.) .
Рассматривались системы в дистиллированной и природной воде Симферопольского водохранилища с различными концентрациями ТХУ. Расчёт поверхностного натяжения проводили по формуле[17]:
s(ТХУраствор)=s(Н2О)* n(Н2О)/ n(ТХУ),
где s(ТХУраствор) – поверхностное натяжение раствора ТХУ,
s(Н2О) – поверхностное натяжение воды,
n(ТХУ) – число капель раствора ТХУ,
n(Н2О) – число капель воды.
Для расчёта поверхностного натяжения ТХУ природной воде необходимо знать s (Н2Оприр.), её находим по формуле:
s(Н2Оприр.)=s(Н2О)* n(Н2О)/ n(Н2Оприр.)
и затем рассчитываем:
s(ТХУ)=s(Н2Оприр.)* n(H2О) /n(ТХУприр.).
2.2.3 Распределение ТХУ в объёме модельных систем
На первом этапе было изучено накопление ТХУ в водных средах, с учетом её поверхностно активных свойств, и распределение ее в объеме исследуемых систем, содержащих дистиллированную воду и воду Симферопольского водохранилища, а затем оценено влияние сорбционных процессов на распределение ТХУ в данных системах. Концентрацию трихлоруксусной кислоты (ТХУ) в модельных системах определяли потенциометрическим титрованием едким натром. Распределение ТХУ в объёме наблюдалось в двух модельных системах:
1. Раствор ТХУ в дистиллированной воде.
2. Раствор ТХУ в воде симферопольского водохранилища.
3. Раствор ТХУ в дистиллированной воде в присутствии бентонита.
Был использован сосуд ёмкостью 10л. В модельной системе (3) он был заполнен раствором ТХУ в дистиллированной воде, и на дне которого был помещён бентонит. Аликвоты для титрования брались пипеткой со дна, из объёма и поверхности системы в обоих случаях. Рассчитали концентрации в придонной части, в объёме и на поверхности системы.
3. Обсуждение результатов.
Данные, полученные при изучении адсорбции ТХУ на бентоните представленны на рисунке 1.
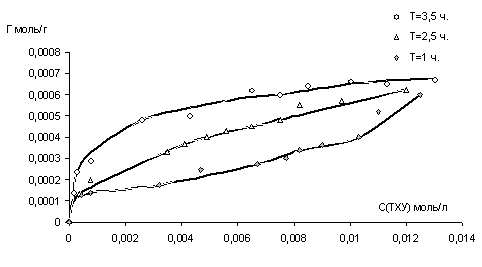
Рис.1.Кинетика адсорбции ТХУ (моль/г.) на монтмориллоните.
Как видно из рисунка, количество адсорбированного вещества пропорционально времени экспозиции, а после 3,5 часов зависимость приобретает экспоненциальный характер, что говорит о процессах насыщения поверхности.
Анализируя построенные графики можно рассчитать величину предельной адсорбции (Гпредельная) в ленгмюровских координатах ([С], [С]/Г):
Для данного случая уравнение Лэнгмюра имеет вид:
Г=7,12·10-4![]()
Очевидно, достаточно высокая адсорбционная емкость бентонита (около 50% от исходного содержания) по отношению к ТХУ в системе, будет обуславливать ее концентрирование в придонной части исследуемых гетерогенных водных систем.
Результаты изучения поверхностной активности трихлоруксусной кислоты в различных водных системах представленны на рисунке 2.
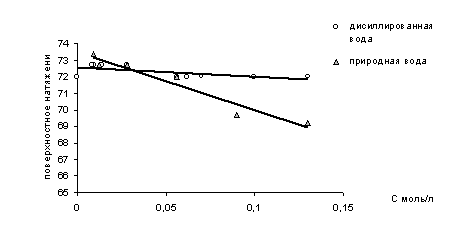
Рис.2 Зависимость поверхностного натяжения растворов трихлоруксусной кислоты от концентрации.
Из рисунка 2 следует, что в растворах с дистиллированной водой ТХУ не проявляет поверхностную активность, тогда как поверхностное натяжение природной воды в присутствии данного компонента незначительно изменяется обратно пропорционально увеличению концентрации растворов.
Возможно, одной из причин проявления поверхностной активности ТХУ в природной воде является повышенная по сравнению с дистиллатом минерализация природной воды. В условиях повышенной минерализации рост ионной силы раствора ведет к повышению степени диссоциации ТХУ. Образующиеся при этом достаточно подвижные трихлорацетат анионы степень гидратации, которых невелика, могут участвовать в формировании двойного электрического слоя на границе раздела жидкость / газ по Олти [18]. При этом концентрирование данных анионов на поверхности ведет к понижению поверхностного натяжения раствора.
Таким образом, поверхностная активность ТХУ в природной воде является одним из факторов, влияющих на распределение кислоты в изучаемой системе.
В результате изучения распределения ТХУ в объеме были полученны данные, представленные в таблицах 2,3.
Таблица 2. Распределение ТХУ в объеме модельных систем (t-1,5 ч.)
| С ср±DС моль/л Н2О природная | С ср±DС моль/л Н2О дист. | С ср±DС моль/л Н2О дист, бентонит. | |
| Поверхность | 18,8*10-3±6,3*10-5 | 10,5*10 -3±2,7*10-5 | 12,5*10-3±5,0*10-5 |
| Объём | 16,2*10-3±2,4*10-5 | 26,5*10 -3±5,4*10-4 | 12,9*10-3±7,9*10-5 |
| придонная часть | 3,94*10-3±3,2*10-5 | 2,00*10 -3±1,8*10-5 | 13,6*10-3±1,7*10-5 |
Результаты эксперимента, приведённые в таблице 2, говорят о том, что ТХУ концентрируется в основном в объёме дистиллированной воды. Однако при переходе к системе, содержащей природную воду, концентрация ТХУ у поверхности начинает возрастать, что, по-видимому, связано с изменением возрастанием поверхностной активности ТХУ в условиях повышенной минерализации.
В то же время, в гетерогенных модельных системах с бентонитом наблюдается выравнивание концентраций ТХУ у поверхности и в объеме, а также концентрирование кислоты у границы раствор/бентонит, что связано с адсорбционной активностью бентонита по отношению к ТХУ.
Изучение кинетики адсорбции ТХУ на бентоните показало, что тенденции к насыщению поверхности адсорбента наблюдается после трех часов экспозиции. В связи с этим представлял интерес изучение кинетики распределения ТХУ в объеме гетерогенной модельной системы с дистиллированной водой, полученные результаты представлены в таблице 3.
Таблица 3. Кинетика распределения ТХУ в модельной системе с бентонитом
| С (ТХУ) ср·10-3±DС моль/л Н2О дист, бентонит. | ||||
| 1,5 ч | 2,5 ч | 72 ч | 120 ч | |
| Поверхность | 12,5.±5,0*10-5 | 12,3±4,7*10-5 | 12,3±5,1*10-5 | 12,3±4,5*10-5 |
| Объём | 12,9±7,9*10-5 | 13,0±8,1*10-5 | 13,2±7,4*10-5 | 12,6±8,0*10-5 |
| придонная часть | 13,6±1,7*10-5 | 12,1±1,3*10-5 | 10,4±1,5*10-5 | 8,2±1,5*10-5 |
Из данных, приведенных в таблице, следует, что в течение первых двух часов идет концентрирование кислоты в придонной части системы, вследстви одновременного протекания диффузионных и адсорбционных процессов. Однако при больших временах экспозиции наблюдается постепенное уменьшение концентрации кислоты из-за преобладания сорбции в придонном слое (t=72 ч., t=120 ч.), а затем выравнивание концентраций в объеме и на поверхности, обусловленное диффузионными процессами (t=120 ч.).
Выводы
1. Обнаружено влияние повышения уровня минерализации природной воды на степень диссоциации трихлоруксусной кислоты и ее поверхностноактивные свойства.
2. Повышение поверхностной активности трихлоруксусной кислоты в природных водах связаны с формированием двойного електрического слоя на границе жидкость/газ по Олти.
3. Адсорбционные процессы в системах с монтмориллонитом снижают концентрацию трихлоруксусной кислоты и влияют на её перераспределение в объёме за счёт нивелирования градиента концентрации.
Список использованной литературы
1. Химические основы экологического мониторинга / В.В. Кузнецов.// Соросовский образовательный журнал.-1999.-№1.-С.35-40.
2. Мониторинг качества питьевой воды/А.А Мильнер, Г.Д. Резников. //Химия и технология воды-1996, т.18, №1, с. 83-87.
3. Формирование и контроль качества поверхностных вод. Вып. 3 Охрана вод от воздействия удобрений и ядохимикатов, 1976г. с.139
4. Врочинский К.К. Пути поступления и содержание пестицидов в воде водоисточников/Гидробиологический журнал, 1976, т.12, №5, с.93-101.
5. Брагинский Л.П. Персистентные пестициды в экологии пресных вод./А.П. Брагинский, Ф.Я. Комаровский, Л.И. Мережковский, Киев:1979г-141с.
6. Скурлатов Ю.И. Дука Г.Г. Химия и жизнь воды.- Кишенёв:1989-124с.
7. Экология города./Под ред. Стольберга Ф.В.,Киев: 2000г.-320с.
8. Лейте Вольфганг. Определение органических загрязнителей питьевых природных и сточных вод. М., Химия, 1981г.с.157-169.
9. Методы анализа пестицидов./Ю.С. Ляшков, Москва: 1972г.-159с.
10. Сиренко Л.А., Гавриленко М.Я. "Цветение" воды и евтрофирование. Киев: Наукова думка. 1978г.-231c.
11. Исследование биологического действия антропогенных факторов, загрязняющих водоемы/О.М. Кожова, Иркутск:ИГУ,1979-184с.
12. Роль микроелементов в жизни водоёмов ( сборник статей )/АН СССР, Всесоюзное гидробиологическое общество, (отв. Ред. Воробьёв) М:Наука, 1980г.-143с.
13. Лурье Ю. Ю., Рыбников А. И. Химический анализ производственных сточных вод. М., Химия,1974 г.-273с.
14. Тарасевич Ю. И. Природные сорбенты в процессах очистки воды.–Киев: Наука, 1981 г.-268с.
15. Тарасевич Ю. И., Овчаренко Ф. Д. Адсорбция на глинистых минералах. –К.: Наукова думка, 1975 г.-235с.
16. Основы аналитической химии./Ю.А.Золотова,т.2. М.:Высшая школа, 2002г.-494с.
17. Фролов К. И. Коллоидная химия. М.: Наука, 1976 г.-289с.
18. Alty T.Proc.Rog.Soc.Lond.Ser.A,V.106, 1934.-316p.
19. Бейерман, Клаус. Определение следовых количеств органических веществ: с англ. А. А. Кирюшкина. М.:Мир, 1987г.-462 с.
20. Мельников Н.Н. Пестициды. Химия, технология и применение. М: 1987г.-525c.
Похожие работы
... при 3000 об/мин в течение 20 мин. При этом достигается полное осаждение сывороточных белков. Надосадочную жидкость декантируют и экстрагируют из нее испытуемые вещества. Процессы экстракции анализируемых лекарственных веществ и их метаболитов из биологических объектов осуществляют с помощью таких органических растворителей, как диэтиловый эфир, хлороформ, бензол, дихлорэтан, дихлорметан, я- ...
0 комментариев