Навигация
1.1.3 Регуляция обмена белков
Регуляция обмена белков в печени осуществляется благодаря интенсивному биосинтезу в ней белков и окислению аминокислот. За сутки в организме человека образуется около 80—100 г белка, из них половина в печени. При голодании печень быстрее всех расходует свои резервные белки для снабжения аминокислотами других тканей. Потери белка в печени составляют примерно 20%; в то время как в других органах не более 4%. Белки самой печени в норме обновляются полностью каждые 20 суток. Большинство синтезированных белков печень отправляет в плазму крови. При потребности (например, при полном или белковом голодании) эти протеины так же служат источниками необходимых аминокислот.Поступив через воротную вену в печень, аминокислоты подвергаются ряду превращений, так же значительная часть аминокислот разносится кровью по всему организму и используется для физиологических целей. Печень обеспечивает баланс свободных аминокислот организма путем синтеза заменимых аминокислот и перераспределения азота. Всосавшиеся аминокислоты в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О и NH3) и освобождением энергии.
Все альбумины, 75-90% б-глобулинов (б1-антитрипсин, б2-макроглобулин – ингибиторы протеаз, белки острой фазы воспаления), 50% в-глобулинов плазмы синтезируются гепатоцитами. В печени происходит синтез белковых факторов свертывания крови (протромбина, фибриногена, проконвертина, акцелератора глобулина, фактора Кристмаса, фактора Стюарта-Прауэра) и часть естественных основных антикоагулянтов (антитромбин, протеин С и др.). Гепатоциты участвуют в образовании некоторых ингибиторов фибринолиза, регуляторы эритропоэза – эритропоэтины – образуются в печени. Гликопротеин гаптоглобин, вступающий в комплекс с гемоглобином для предупреждения его выделения почками, тоже имеет печёночное происхождение. Данное соединение принадлежит к белкам острой фазы воспаления, обладает пероксидазной активностью. Церулоплазмин, также являющийся гликопротеином, синтезируемым печенью, можно считать внеклеточной супероксиддисмутазой, что позволяет защищать мембраны клеток; мало того, он стимулирует продукцию антител. Подобным действием, только на клеточный иммунитет, обладает трансферрин, полимеризация которого так же осуществляется гепатоцитами.
Ещё один углеводсодержащий белок, но с иммуносупрессивными свойствами, способен синтезироваться печенью – б-фетопротеин, рост концентрации которого в плазме крови служит ценным маркёром некоторых опухолей печени, яичек и яичников. Печень - источник большей части протеинов системы комплемента.
В печени наиболее активно протекает обмен мономеров белков - аминокислот: синтез заменимых аминокислот, синтез небелковых азотистых соединений из аминокислот (креатина, глутатиона, никотиновой кислоты, пуринов и пиримидинов, порфиринов, дипептидов, коферментов пантотената и др.), окисление аминокислот с образованием аммиака, который обезвреживается в печени при синтезе мочевины [6].
Итак, рассмотрим общие пути обмена аминокислот. Общие пути превращения аминокислот в печени включают реакции дезаминирования, трансаминирования, декарбоксилирования и биосинтез аминокислот.
Дезаминирование аминокислот. Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы) (приложение 17). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты.
Трансаминирование аминокислот. Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на б-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования являются обратимыми и протекают при участии специфических ферментов аминотрансфераз, или трансаминаз.
Пример реакции трансаминирования:
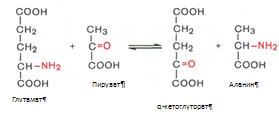
Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы аминокислот в виде СО2 . Образующиеся продукты реакции – биогенные амины. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот.
Обезвреживание аммиака в организме. В организме человека подвергается распаду около 70 г аминокислот в сутки, при этом в результате реакций дезаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в крови в норме не превышает 60 мкмоль/л . Аммиак должен подвергаться связыванию в печени с образованием нетоксичных соединений, легко выделяющихся с мочой.
Один из путей связывания и обезвреживания аммиака в организме это биосинтез глутамина (и, возможно, аспарагина). Глутамин и аспарагин выделяются с мочой в небольшом количестве. Скорее они выполняют транспортную функцию переноса аммиака в нетоксичной форме. Синтеза глутамина, катализируется глутаминсинтетазой.
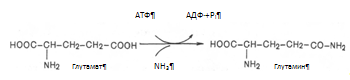
Второй и основной путь обезвреживания аммиака в печени – образование мочевины, который будет рассмотрен ниже в мочевинообразовательной функции печени.
В гепатоцитах отдельные аминокислоты подвергаются специфическим преобразованиям. Из серосодержащих аминокислот образуется таурин, который позднее включается в парные жёлчные кислоты (таурохолевая, тауродезоксихолевая), а также может служить антиоксидантом, связывая гипохлорит анион, стабилизировать мембраны клеток; происходит активация метионина, который в виде S-аденозилметионина служит источником метильных групп реакциях окончания генеза креатина, синтеза холина для холинфосфатидов (липотропных веществ).
Биосинтез заменимых аминокислот. Любая из заменимых аминокислот может синтезироваться в организме в необходимых количествах. При этом углеродная часть аминокислоты образуется из глюкозы, а аминогруппа вводится из других аминокислот путем трансаминирования. Алании, аспартат, глутамат образуются из пирувата, оксалоацетата и б-кетоглутарата соответственно. Глутамин образуется из глутаминовой кислоты при действии глутаминсинтетазы:
![]()
Аспарагин синтезируется из аспарагиновой кислоты и глутамина, который служит донором амидной группы; реакцию катализирует аспарагинсинтетаза пролин образуется из глутаминовой кислоты. Гистидин (частично заменимая аминокислота) синтезируется из АТФ и рибозы: пуриновая часть АТФ поставляет фрагмент —N=CH—NH— для имидазольного цикла гистидина; остальная часть молекулы образуется за счет рибозы.
Если в пище нет заменимой аминокислоты, клетки синтезируют ее из других веществ, и тем самым поддерживается полный набор аминокислот, необходимый для синтеза белков. Если же отсутствует хотя бы одна из незаменимых аминокислот, то прекращается синтез белков. Это объясняется тем, что в состав подавляющего большинства белков входят все 20 аминокислот; следовательно, если нет хотя бы одной из них, синтез белков невозможен.
Частично заменимые аминокислоты синтезируются в организме, однако скорость их синтеза недостаточна для обеспечения всей потребности организма в этих аминокислотах, особенно у детей. Условно заменимые аминокислоты могут синтезироваться из незаменимых: цистеин — из метионина, тирозин — из фенилаланина. Иначе говоря, цистеин и тирозин — это заменимые аминокислоты при условии достаточного поступления с пищей метионина и фенилаланина [5].
1.1.4 Участие печени в обмене витаминовУчастие печени в обмене витаминов складывается из процессов депонирования всех жирорастворимых витаминов: А, Д, Е, К, F (секреция желчи так же обеспечивает всасывание этих витаминов) и многих из гидровитаминов (В12, фолиевая кислота, В1, В6, РР и др.), синтеза некоторых витаминов (никотиновая кислота) и коферментов.
Особая печени заключается в том, что в ней происходит активация витаминов:
7. Фолиевая кислота с помощью витамина С восстанавливается в тетрагидрофолиевую кислоту (ТГФК) [8]; Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолатредуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:
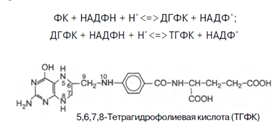
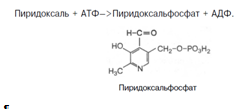
8. Витамины В1 и В6 фосфорилируются в тиаминдифосфат и пиридоксальфосфат соответственно [8]. Витамин В6 (пиридоксин) производный 3-оксипиридина. Термином витамин В6 обозначают все три производных 3-оксипиридина, обладающих одинаковой витаминной активностью: пиридоксин (пиридоксол), пиридоксаль и пиридоксамин:
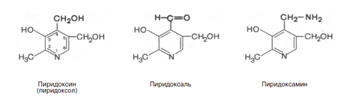
Хотя все три производных 3-оксипиридина наделены витаминными свойствами, коферментные функции выполняют только фосфорилированные производные пиридоксаля и пиридоксамина. Фосфорилирование пиридоксаля и пиридоксамина является ферментативной реакцией, протекающей при участии специфических киназ. Синтез пиридоксальфосфата, например, катализирует пиридоксалькиназа:
Витамин В1(тиамин). В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота.
В превращении витамина B1 в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиаминдифосфатом (ТДФ), участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа.
9. Часть каротинов преобразуется в витамин А под влиянием каротиндиоксигеназы. Каротины являются провитаминами для витамина А. Известны 3 типа каротинов: б-, в- и г-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает в-каротин, поскольку он содержит два в-иононовых кольца и при распаде в организме из него образуются две молекулы витамина А:
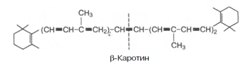
При окислительном распаде б- и г-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному в-иононовому кольцу.
4. Витамин Д подвергается первому гидроксилированию на пути получения гормона кальцитриола; в печени осуществляется гидроксилирование в 25-м положении. Ферменты, катализирующие эти реакции, называются гидроксилазами, или монооксигеназами. В реакциях гидроксилирования используется молекулярный кислород.
Похожие работы
... тромболитической терапии. Практически значимыми маркерами гибели миоцитов являются активности энзимов - АСТ, КФК, ЛДГ. Таблица 4 Некоторые показатели липидного спектра сыворотки крови мужчин г. Катайска, больных артериальной гипертонией I, II степени и ишемической болезнью сердца, M±m Показатели Группы Общий холестерин, N – 5,2-6,5 ммоль/л Триглицериды, N – 0,51-1,86 ммоль/л ...
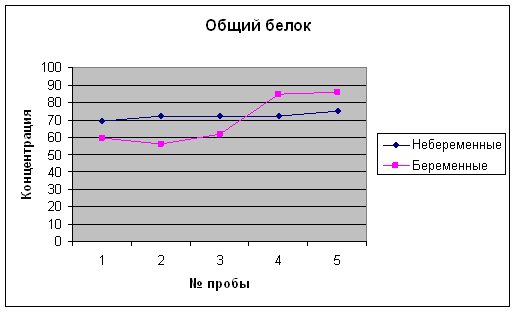
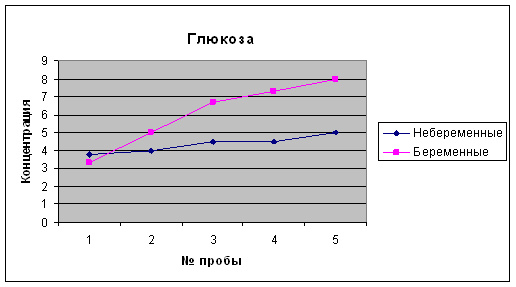
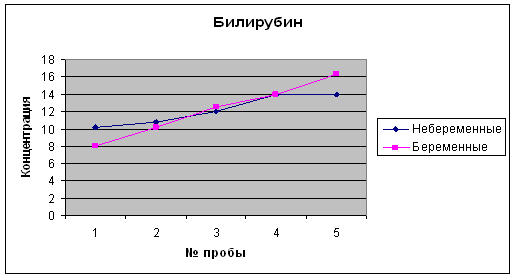
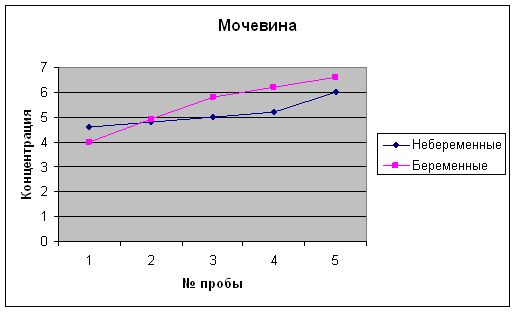
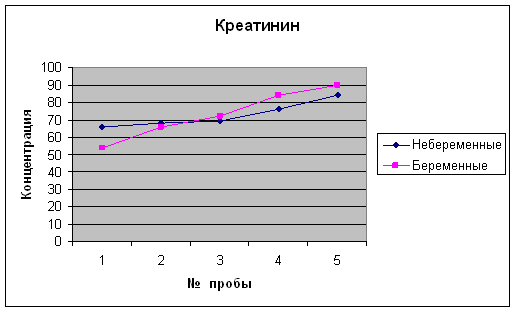
... 2,1-5,1 Мочевина, ммоль/л 3,3 – 8,3 2,8 – 7,1 Креатинин, мкмоль/л 53 – 97 39,8 –72,8 * * Наиболее выраженное снижение в I и II триместре беременности. 4 Результаты исследований Биохимические показатели крови беременных женщин Аскерова О.В. (36 нед) Показатель Результат Отклонение от нормы Общий белок 59,6 - Общий билирубин 8,0 N Глюкоза 3,3 - Креатинин 90 ...
... Куликов И.Н., 1996 40 54,23,2 Нагаев Б.С., 1996 70 0,310,02 Творогова М.Г. 1995 40 4,620,31 Приложение 3 Биохимические показатели крови практически здоровых людей, n=51 № п/п Ф. И. О. Возраст Пол Дата анализа ЭКА (г/л) ОКА (г/л) ...
... г. - М., 2001. - С.561. (Соавт. Хочава М.Р., Оганесян Э.Т., Фролова Л.М., Парфентьева Е.П., Москаленко С.В., Саджая Л.А., Репс В.Ф., Скульте И.В., Андреева О.А., Бобылев О. В). 3. Антиоксидантные и гепатозащитные свойства флавоноидов цитрусовых // Фундаментальные науки и прогресс клинической медицины: Материалы Рос. конф. молодых ученых России с междунар. участием (2; 24-28 апреля 2001; ...



0 комментариев