Реакция (III) окисления диоксида серы характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора.
В промышленности основным катализатором окисления SO2 является катализатор на основе оксида ванадия V2O5 (ванадиевая контактная масса). Каталитическую активность в этой реакции проявляют и другие соединения, прежде всего платина. Однако платиновые катализаторы чрезвычайно чувствительны даже к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевым катализатором.
Каталитическую активность проявляет также оксид железа(III) Fe2O3, однако лишь в области высоких температур. Каталитической активностью Fe2O3, входящего в состав огарка можно объяснить наличие в обжиговом газе, выходящем из печей КС, небольших количеств триоксида серы.
Скорость реакции и вид кинетического уравнения зависит от типа применяемого катализатора. В промышленности применяют в основном ванадиевые контактные массы БАВ, СВД, СВС, ИК, в составе которых ~ 8% V2O5, нанесенного на пористый носитель.
![]() Скорость каталитического окисления диоксида серы на ванадиевом катализаторе описывается уравнением:
Скорость каталитического окисления диоксида серы на ванадиевом катализаторе описывается уравнением:
dxso2 kp 1-xso2 x²so2
![]()
![]()
![]()
![]() = · β- (1.1),
= · β- (1.1),
dτ a 1-0,2xso2 pK²p(1-xso2)²
b - 0,5axso2
![]() где β = ; xso2 – степень превращения;
где β = ; xso2 – степень превращения;
1 - 0,5axso2 τ – время контактирования;
k – константа скорости прямой реакции; Kp – константа равновесия реакции (III); р – давление.
Для упрощенных расчетов можно пользоваться уравнением Борескова:
![]()
![]()
![]()
![]() 0,8
0,8
dcso2 cso2 - cso2· e
![]()
![]() ωrso2
= - = k co2 (1.2)
ωrso2
= - = k co2 (1.2)
![]()
![]() dτ cso3
dτ cso3
Из уравнений (1.1) и (1.2) следует, что скорость реакции зависит от степени приближения к равновесию и как функция температуры проходит через максимум (с ростом температуры растет константа скорости прямой реакции и уменьшаются константа равновесия и равновесная степень превращения).
Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке.
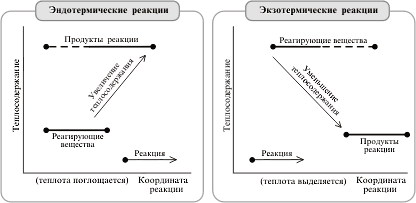
Так как реакция окисления SO2 относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижнем температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400 - 440˚C. Верхний температурный предел составляет 600 - 650˚C и определяется тем, что выше этих температур происходит перестройка структуры катализатора и он теряет свою активность.
В диапазоне 400 - 600˚C процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась.
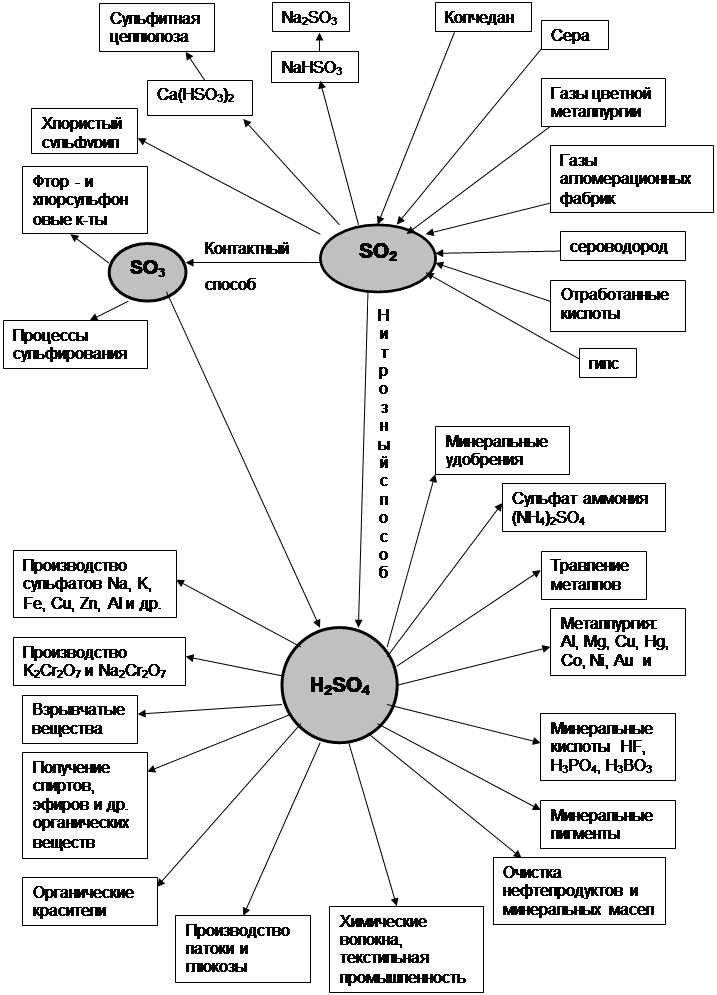
Одна из важнейших задач стоящих перед сернокислой промышленностью, - увеличение степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи, повсеместно применяемый сернокислой промышленности, - метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3. В оставшемся реакционном газа соотношение O2 : SO2 существенно повышается, что приводит к смещению равновесия реакции вправо (равновесная кривая 2 на рис. 2). Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном – двух слоях катализатора достигают 95% степени превращения оставшегося SO2. Суммарная степень превращения SO2 составляет в таком процессе 99,5-99,8%.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
Похожие работы
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
... газа, позволяющий регенерировать сернистый ангидрид независимо от его концентрации в технологических газах; основные характеристики: полная автоматизация процесса, возможность использования тепла реакции окисления сернистого ангидрида для получения товарного пара и полная экологическая чистота). Длительное время лучшим катализатором считался платиновый, однако с 1932 г. его вытеснили ванадиевые. ...
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
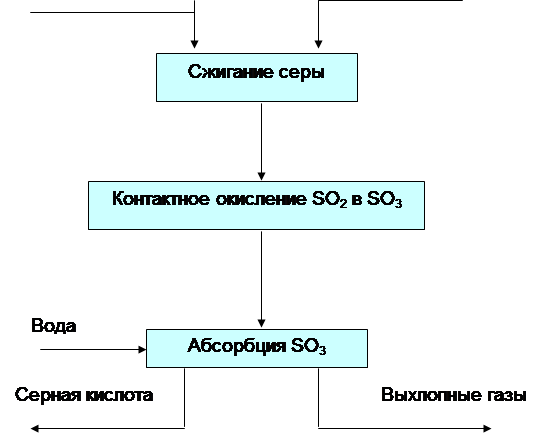
... Повышение степени превращения SO2 может быть достигнуто разными путями. Наиболее распространенный из них – создание схем двойного контактирования и двойной абсорбции (ДКДА). Получение H2SO4 из серы. Процесс производства серной кислоты из элементарной серы состоит из следующих основных реакций: подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха; сжигание ...




0 комментариев